Document de principes
Directives de détection et de prise en charge de l’hyperbilirubinémie chez les nouveau-nés à terme et peu prématurés (à compter de 35 semaines d’âge gestationnel)
Affichage : le 18 mars 2025
Auteur(s) principal(aux)
Eugene Ng, Gabriel Altit, Chloe Joynt, Nicole Radziminski, Michael Narvey, Comité d’étude du fœtus et du nouveau-né
Résumé
L’hyperbilirubinémie est une affection courante et généralement bénigne chez les nouveau-nés à terme et peu prématurés. La création d’une approche standardisée auprès de tous les nouveau-nés afin de prévenir, de détecter et de prendre en charge ceux qui sont atteints d’une hyperbilirubinémie importante sur le plan clinique permettra de limiter les risques de séquelles neurologiques à long terme de l’encéphalopathie bilirubinique aiguë ou de l’ictère nucléaire. Le présent document de principes contient des recommandations sur le dépistage universel, l’évaluation des facteurs de risque et les approches du traitement, des examens et de la surveillance de l’hyperbilirubinémie.
Mots-clés : bilirubine; exsanguinotransfusion; hémolyse; hyperbilirubinémie; ictère; nouveau-nés; photothérapie
CONTEXTE ET ÉPIDÉMIOLOGIE
Environ 10 % des nouveau-nés à terme et prématurés présentent une élévation des taux de bilirubine sérique totale (BST) qui justifie une surveillance étroite ou un traitement[1][2]. La standardisation des stratégies de dépistage et de prise en charge a considérablement réduit l’incidence d’hyperbilirubinémie néonatale grave (définie comme une BST de pointe supérieure à 425 µmol/L) ou d’exsanguinotransfusion de sang total (ESTT). Après la publication du document de principes de la Société canadienne de pédiatrie de 2007[3], le Programme canadien de surveillance pédiatrique a constaté que les cas de grave hyperbilirubinémie étaient plus de trois fois moins fréquents[4][5]. Des cas d’ictère nucléaire continuent toutefois d’être déclarés en Amérique du Nord et en Europe[6]-[11], et l’hyperbilirubinémie devant être traitée demeure la principale raison de réhospitaliser des nouveau-nés en Amérique du Nord[4].
Le présent document de principes remplace celui qu’a publié la Société canadienne de pédiatrie sur le sujet en 2007[3]. En 2022, l’American Academy of Pediatrics (AAP) a publié des directives révisées, contenant de nouvelles recommandations sur la prévention, l’évaluation et la prise en charge de l’hyperbilirubinémie néonatale[12]. Ces recommandations reposaient sur les meilleures données probantes à jour et, lorsqu’elles étaient insuffisantes, sur le consensus et les avis d’experts. Plusieurs éléments des directives de l’AAP sont intégrés au nouveau document de principes de la Société canadienne de pédiatrie, notamment :
- une stratégie de dépistage universel pour détecter les nouveau-nés à risque de grave hyperlibirubinémie;
- un algorithme pour évaluer et surveiller l’hyperbilirubinémie chez les nouveau-nés;
- le traitement, les examens et la surveillance des protocoles auprès des nouveau-nés atteints d’hyperbilirubinémie;
- le suivi des nouveau-nés traités contre l’hyperbilirubinémie après leur congé de l’hôpital.
LE DÉPISTAGE DE L’HYPERBILIRUBINÉMIE
Le dépistage de la maladie hémolytique iso-immune
La maladie hémolytique iso-immune néonatale attribuable aux incompatibilités érythrocytaires est une cause importante d’hyperbilirubinémie néonatale grave. En début de grossesse, dans le cadre des soins prénatals réguliers, le clinicien doit procéder au dépistage universel du groupage sanguin ABO et RhD et des anticorps[13]. Le dépistage des anticorps détecte les alloanticorps anti-érythrocytaires. Si les résultats ne sont pas connus ou disponibles au moment de l’accouchement ou si le dépistage des anticorps de la mère est positif, le dépistage néonatal précoce devrait inclure le groupage sanguin (ABO et RhD), les tests d’antigènes érythrocytaires pour déterminer l’anticorps apparenté (si le dépistage des anticorps de la mère est positif), un test direct à l’antiglobuline (TDA; anciennement appelé test de Coombs direct) et la bilirubine sérique totale (BST). Il est préférable d’utiliser des prélèvements du sang du cordon, même si ceux du sang périphérique sont acceptables.
Les données sont insuffisantes pour préconiser une stratégie de dépistage universel du TDA chez tous les nouveau-nés ou chez ceux des mères de groupe O, afin de détecter les nouveau-nés à risque d’hyperbilirubinémie marquée causée par une anémie hémolytique auto-immune[14]-[17]. Le TDA détecte la présence d’anticorps à la surface des globules rouges, mais un test positif ne confirme pas la présence d’anémie hémolytique ni n’en mesure la gravité[18]. Le clinicien peut observer un résultat faussement positif du TDA chez les nouveau-nés dont la mère a reçu des immunoglobulines Rh (IgRh) ou un résultat faussement négatif après une anémie hémolytique marquée ou la clairance des anticorps[19]. Le clinicien devrait connaître ces limites au moment d’interpréter le TDA. Pour mieux confirmer la présence d’anémie hémolytique, il est préférable de conjuguer le TDA à d’autres examens, tels que l’hémoglobine, la numération réticulocytaire et bilirubinique et un frottis sanguin, lorsqu’ils sont faciles d’accès. Le clinicien doit effectuer ces examens lorsqu’il soupçonne une anémie hémolytique néonatale en raison d’une augmentation rapide et précoce de la BST ou d’une hyperbilirubinémie grave[20][21].
RECOMMANDATIONS
- Procéder au groupage sanguin (ABO et Rh) et au dépistage des anticorps érythrocytaires chez la mère dans le cadre des soins prénatals réguliers. Lorsque les résultats ne sont pas connus ou disponibles, prendre toutes les dispositions nécessaires pour effectuer ces examens avant l’accouchement.
- Si le dépistage des anticorps de la mère est positif ou n’est pas connu au moment de l’accouchement, les nouveau-nés doivent être soumis à divers tests de dépistage, soit la bilirubine sérique totale (BST), l’hémoglobine, la numération réticulocytaire, le frottis sanguin, le test direct à l’antiglobuline (TDA) et le groupage sanguin, obtenus de préférence à partir d’un prélèvement de sang du cordon. Surveiller ces nouveau-nés de près pour détecter l’hyperbilirubinémie précoce (à moins de 24 heures de vie).
Une stratégie de dépistage universel pour prédire l’hyperbilirubinémie
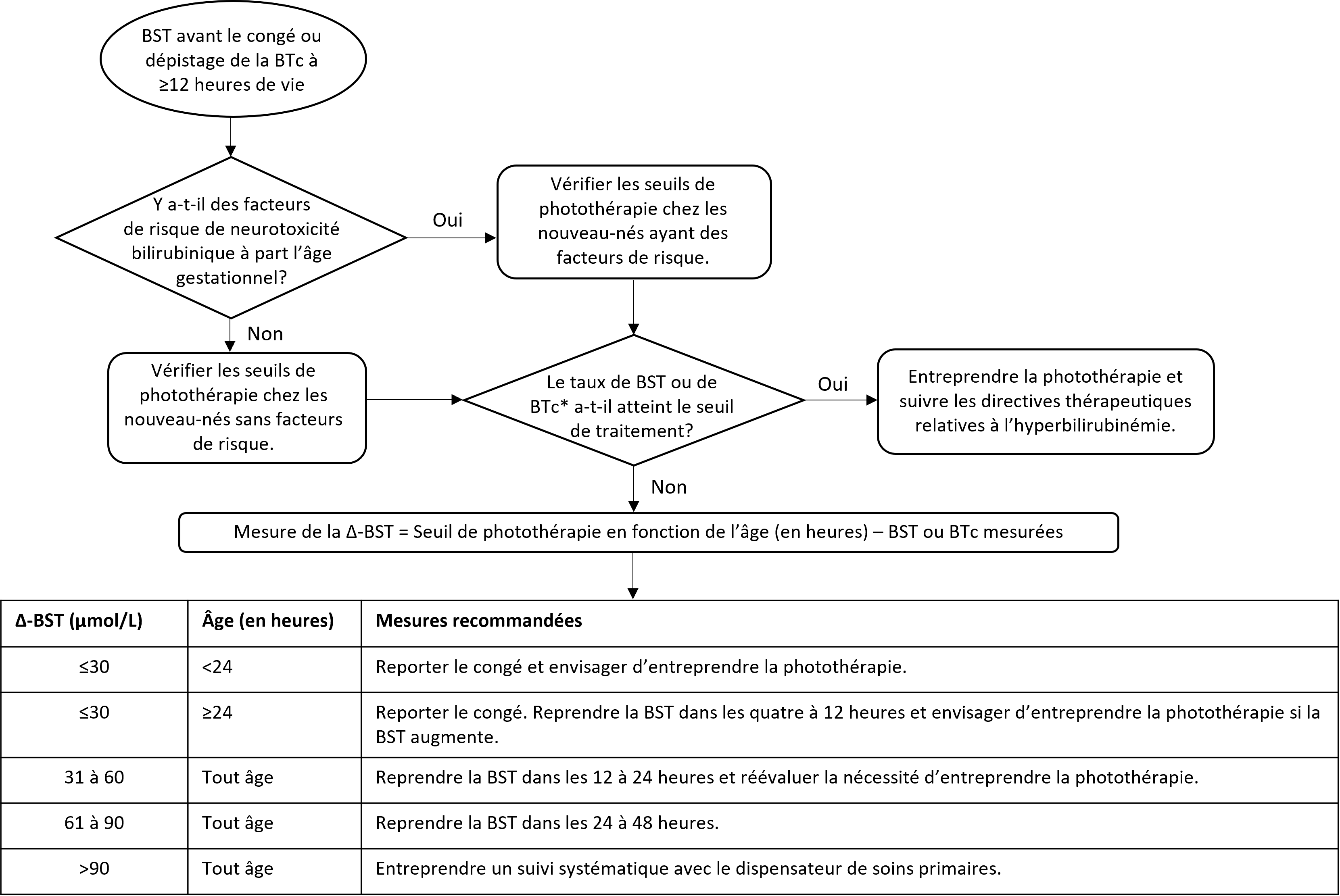
Le dépistage universel vise à détecter les nouveau-nés à risque d’hyperbilirubinémie. L’AAP[6] et la Société canadienne de pédiatrie[3] ont déjà recommandé le dépistage de tous les nouveau-nés en santé au moyen d’une BST programmée entre 18 et 72 heures de vie, puis la consignation du résultat sur un nomogramme prédictif afin de faciliter le suivi après le congé[22]. Une nouvelle approche est proposée à l’aide de la delta-bilirubine sérique de pointe (△-BST), c’est-à-dire la différence entre la concentration de BST programmée et le seuil de photothérapie à l’âge de la mesure pour déterminer le plan de soins le plus approprié[12] (voir la figure 1). La △-BST prédit mieux l’apparition d’une hyperbilirubinémie importante sur le plan clinique devant être traitée que le nomogramme prédictif original[23].
L’évaluation des facteurs de risque
Deux catégories de facteurs de risque d’ictère ont été décrites, qui se chevauchent jusqu’à un certain point. Les facteurs de risque d’hyperbilirubinémie (voir le tableau 1a) accroissent le risque de référence d’apparition de cette affection chez le nouveau-né[6][10][24]-[27], tandis que les facteurs de risque de neurotoxicité (voir le tableau 1b) accroissent les effets toxiques de la bilirubine sur le cerveau du nouveau-né. Pris isolément, chacun de ces facteurs a une valeur prédictive limitée, mais leurs risques s’additionnent[24]. Il est important d’avoir conscience des facteurs de risque d’hyperbilirubinémie pendant les soins du nouveau-né, mais seuls les facteurs de risque de neurotoxicité font partie des seuils de photothérapie et d’exsanguinotransfusion.
Il faut du jugement clinique pour déterminer le risque de neurotoxicité chez le nouveau-né. Certains facteurs de risque de neurotoxicité reposent sur l’hypothèse que la barrière hématoencéphalique est compromise chez les nouveau-nés atteints d’une affection grave (p. ex., un sepsis[28][29]), ce qui justifie le recours à des seuils de BST plus faibles pour entreprendre la photothérapie et atténuer le risque de neurotoxicité. De même, l’hypoalbuminémie réduit la liaison de la bilirubine et peut potentialiser l’effet neurotoxique de l’hyperbilirubinémie[30]. Les données probantes sont insuffisantes pour recommander la mesure systématique de l’albumine sérique chez tous les nouveau-nés, mais cette mesure peut être utile pour orienter la prise en charge des nouveau-nés gravement malades ou atteints d’une grave hyperbilirubinémie (s’approchant du seuil de préexsanguinotransfusion)[12].
|
Tableau 1b. Les facteurs de risque qui accroissent les effets neurotoxiques de la bilirubine (facteurs de risque de neurotoxicité) |
|
|
*L’anémie hémolytique peut être présumée d’après une augmentation rapide de la bilirubine sérique totale d’au moins 5 µmol/L/h (jusqu’à 24 heures de vie) ou d’au moins 3,5 µmol/L/h (après 24 heures de vie) Information tirée de la référence[12] |
La mesure programmée de la bilirubine sérique totale pour déterminer la delta-bilirubine sérique totale
Les nouveaux seuils de photothérapie, qui reposent sur l’âge gestationnel (AG) et la présence de facteurs de risque de neurotoxicité, sont décrits ci-dessous (voir les figures 2 et 3). Le calcul de la △-BST chez les nouveau-nés de 12 à 120 heures de vie indique à quel point la valeur de BST mesurée se rapproche du seuil de photothérapie : plus la △-BST est faible, plus le nouveau-né se rapproche d’un traitement de photothérapie. Les valeurs de bilirubine transcutanée (BTc) peuvent également être utilisées (voir la section sur la mesure de la bilirubine pour découvrir la corrélation entre la BTc et la BST).
|
△-BST = Seuil de photothérapie en fonction de l’âge (en heures) – BST ou BTc mesurée Par exemple, chez un nouveau-né de 24 heures de vie né à 37 semaines d’âge gestationnel dont le dépistage de la BST est de 150 µmol/L, le seuil de photothérapie (conformément à la figure 2) est de 200 µmol/L. Par conséquent, sa △-BST est de 200 µmol/L ─ 150 µmol/L = 50 µmol/L. |
La △-BST devrait être utilisée pour orienter la planification du congé : d’abord pour déterminer si le congé doit être reporté en attendant de nouvelles mesures de BST ou un traitement de photothérapie, puis si un nouveau-né est admissible au congé, afin de planifier le suivi. La mesure de la △-BST pour les besoins du dépistage ne s’applique qu’aux nouveau-nés d’au moins 12 heures de vie qui n’ont pas reçu de photothérapie. En cas d’accouchement à domicile ou de congé avant 12 heures de vie, des dispositions doivent être prises pour procéder au dépistage de la bilirubine pendant la période recommandée. Voir l’algorithme de la figure 1.
Le clinicien doit se rappeler que la principale mesure de cet algorithme consiste à retarder le congé ou à entreprendre la photothérapie (ou les deux) lorsque la △-BST du nouveau-né ne dépasse pas 30 µmol/L [première règle de 30].
RECOMMANDATIONS
- Mesurer la bilirubine sérique totale (BST) ou la bilirubine transcutanée (BTc) avant le congé chez tous les nouveau-nés à au moins 12 heures de vie. En l’absence d’inquiétude clinique d’ictère précoce, la BST peut être mesurée en même temps que le dépistage métabolique du nouveau-né afin de limiter le nombre d’interventions douloureuses.
- Si la BST de dépistage ou la concentration de BTc se situe sous le seuil thérapeutique, calculer la △‑BST pour déterminer la prise en charge appropriée avant d’envisager le congé (conformément à la figure 1).
Figure 1. Algorithme pour le dépistage universel de l’hyperbilirubinémie entre 12 et 120 heures de vie
Les conseils préventifs aux familles
Les listes de vérification avant le congé incluent de l’information écrite et orale sur l’ictère, de même que les résultats du dépistage (p. ex., la BST programmée ou la concentration de BTc, le moment où les mesures ont été prises, la △-BST et les étapes suivantes recommandées) et des communications claires aux proches, de préférence dans leur langue maternelle, de manière à pouvoir planifier le suivi auprès de leurs dispensateurs de soins primaires après le congé[31][32].
RECOMMANDATION
- Fournir à la famille de l’information orale et écrite dans sa langue maternelle au sujet de l’ictère néonatal, y compris les résultats et l’interprétation du dépistage afin de faciliter le suivi après le congé.
Le soutien à l’allaitement
Même si les nouveau-nés allaités sont plus à risque d’une hyperbilirubinémie importante sur le plan clinique que ceux qui prennent des préparations commerciales[33]-[35], les risques de complications de l’hyperbilirubinémie sont faibles lorsqu’on les compare aux innombrables avantages de l’allaitement et de l’alimentation par du lait humain[36][37]. Les mesures protectrices contre l’hyperbilirubinémie incluent les soins peau-à-peau précoces et l’allaitement, de même que l’évaluation de l’efficacité de l’alimentation par la surveillance du poids et du volume d’urine et de selle du nouveau-né[38]-[41]. L’éducation et le soutien à l’allaitement en milieu hospitalier et communautaire font partie des soins essentiels aux familles qui optent pour l’allaitement exclusif, et au moment du congé, celles-ci devraient recevoir de l’information sur les ressources locales et les services de soutien[42].
RECOMMANDATION
- Pour contribuer à prévenir l’ictère associé à une alimentation orale sous-optimale et à une perte de poids excessive, rendre le soutien à l’allaitement accessible à tous les nouveau-nés et les parents jusqu’à ce que l’alimentation soit bien établie.
L’ÉVALUATION CLINIQUE DE L’HYPERBILIRUBINÉMIE
La surveillance clinique de l’hyperbilirubinémie chez les nouveau-nés en santé
Tous les nouveau-nés devraient être soumis à un examen physique assuré par un professionnel de la santé avant 24 heures de vie[3][6]. En plus du dépistage universel par une BST ou une BTc programmée, la surveillance clinique pour dépister les nouveau-nés à risque d’hyperbilirubinémie marquée devrait faire partie de toutes les évaluations des nouveau-nés. Les points de détection incluent les facteurs de risque d’hyperbilirubinémie et de neurotoxicité bilirubinique, une analyse de l’alimentation, des selles et des urines, des mesures du poids et des évaluations visuelles de l’ictère (jaunisse de la peau et des sclères).
La concentration de BST de pointe est généralement observée entre 72 et 120 heures de vie, lorsque la plupart des nouveau-nés en santé sont déjà rentrés à la maison[43]. Un processus doit être en place pour assurer le suivi opportun des nouveau-nés après leur congé à des intervalles fondés sur la △-BST, de manière que les nouveau-nés atteints d’ictère puissent être évalués et traités rapidement. L’absence d’ictère à l’évaluation visuelle dans les 48 premières heures de vie est hautement prédictive de l’absence d’hyperbilirubinémie marquée[44], mais il est également vrai que l’inspection visuelle de la gravité de l’ictère n’est pas fiable, notamment chez les nouveau-nés à la peau plus foncée[36]. L’apparence d’ictère clinique devrait inciter le clinicien à mesurer la BST ou la BTc.
RECOMMANDATIONS
- Soumettre chaque nouveau-né à une évaluation clinique approfondie dans les 24 premières heures de vie, y compris l’évaluation de facteurs de risque d’hyperbilirubinémie et de neurotoxicité bilirubinique (voir les tableaux 1a et 1b) et l’évaluation clinique de l’ictère.
- Disposer d’un processus de suivi des nouveau-nés à risque d’hyperbilirubinémie après le congé, y compris des ressources pour favoriser les mesures de la BST ou de la BTc aux moments opportuns et des mécanismes pour offrir un traitement rapide de l’hyperbilirubinémie lorsque la situation l’indique.
- Soumettre les nouveau-nés chez qui on soupçonne une hyperbilirubinémie marquée à l’évaluation, quel que soit leur âge, à une mesure immédiate de la BST ou de la BTc.
La mesure de la bilirubine
On peut mesurer la BST au moyen de prélèvements veineux ou capillaires, car la corrélation entre les deux méthodes est acceptable[45][46]. Le prélèvement capillaire est la technique la plus courante et la plus étudiée pour dépister l’hyperbilirubinémie[47]. La mesure de la BTc peut fournir une estimation raisonnable des taux de BST lorsqu’elle est inférieure à 250 µmol/L[48]-[51]. Selon l’avis d’experts, il est recommandé d’effectuer une BST de confirmation lorsque la BTc chute dans les 50 µmol/L du seuil de photothérapie.
Il y a de nombreux bilirubinomètres transcutanés sur le marché, et des études comparatives ont établi une variabilité pouvant atteindre 65 µmol/L entre les appareils, notamment dans des plages pertinentes sur le plan clinique[52]. Chaque nouvel appareil devrait faire l’objet de tests de laboratoire à l’interne afin d’en corréler la valeur sérique dans de multiples échantillons avant d’être utilisé officiellement, puis être calibré périodiquement conformément aux recommandations du fabricant[48]. En cas de biais, appliquer le facteur correctif à chaque mesure de la BTc avant de la consigner sur les graphiques de seuil de photothérapie, afin d’éviter de sous-estimer ou de surestimer les valeurs de BST[53][54].
RECOMMANDATION
- Lorsque la mesure de la BTc est utilisée pour surveiller les nouveau-nés atteints d’hyperbilirubinémie, obtenir un test de confirmation par BST si le taux de BTc se situe dans les 50 µmol/L du seuil de photothérapie en fonction des heures de vie OU si la BTc dépasse 250 µmol/L.
LA PRISE EN CHARGE DE L’HYPERBILIRUBINÉMIE
La photothérapie
L’efficacité de la photothérapie dépend de l’intensité de la source lumineuse, de la distance entre la source de lumière et la peau, de la surface cutanée exposée et de la durée du traitement. La photothérapie intensive est définie par l’utilisation de lampes à spectre étroit d’une longueur d’onde de 460 à 490 nm et d’une irradiance d’au moins 30 µW/cm2/nm [55]. L’approche actuellement recommandée consiste à fournir une photothérapie intensive à tout nourrisson qui atteint le seuil d’après les valeurs de BST en fonction des heures de vie (voir les figures 2 et 3)[12]. Des sources de lumière supplémentaires, y compris une couverture ou un coussin de fibres optiques, peuvent accroître la surface corporelle exposée, sans nécessairement augmenter l’irradiance. Puisque tous les types de lampes de photothérapie utilisées en continu sont associés à une dégradation de l’irradiance, les appareils devraient être vérifiés régulièrement par une mesure de l’irradiance spectrale au moyen d’un radiomètre[56].
Les seuils de photothérapie
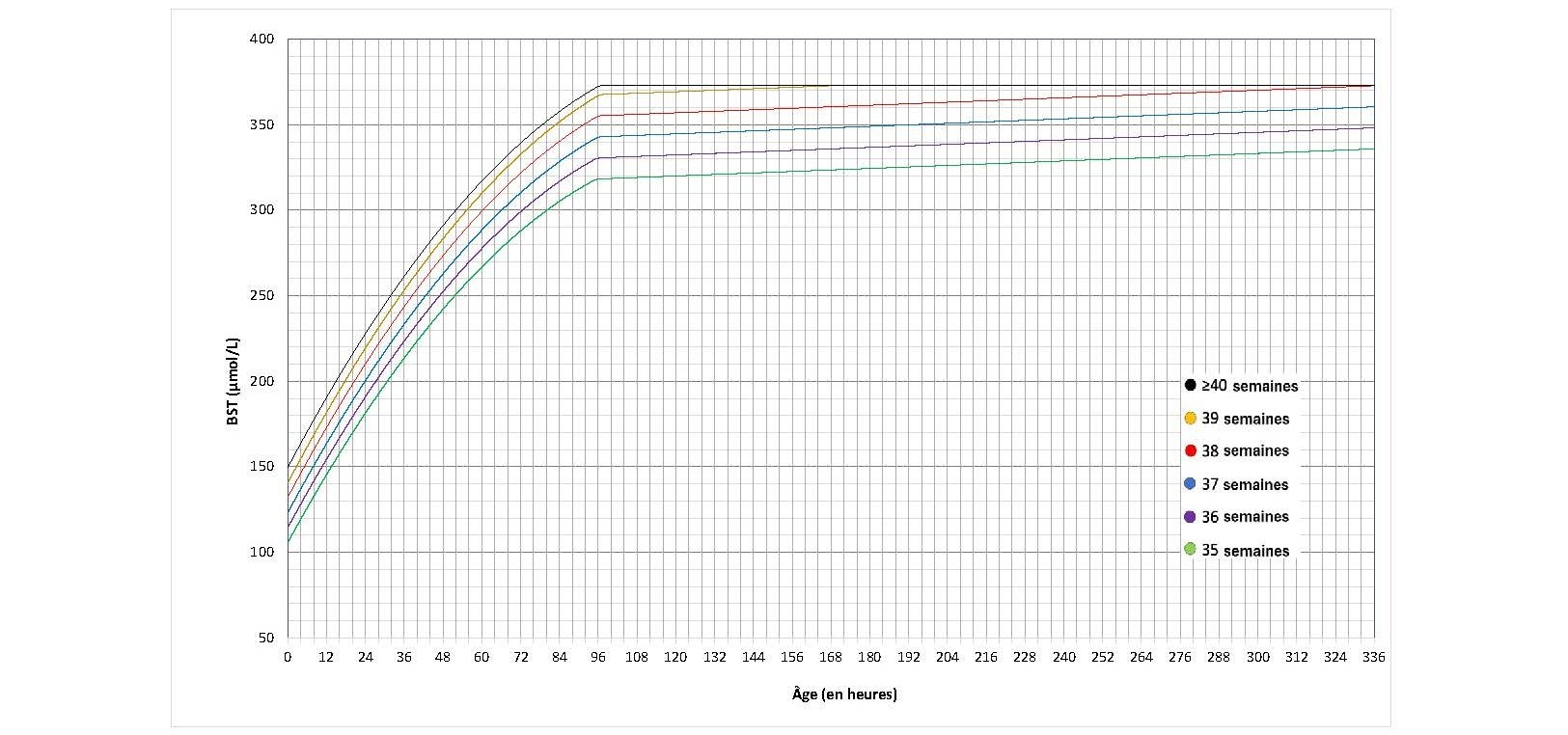
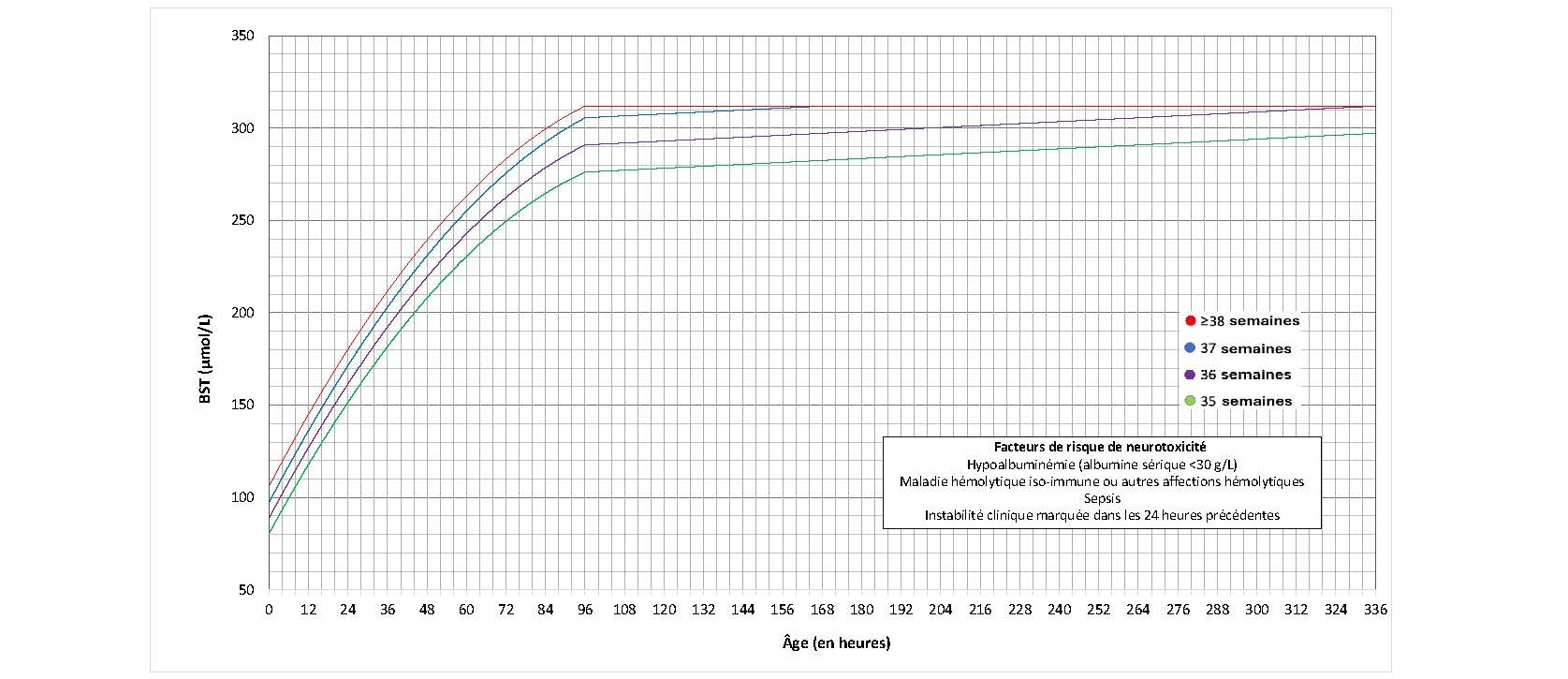
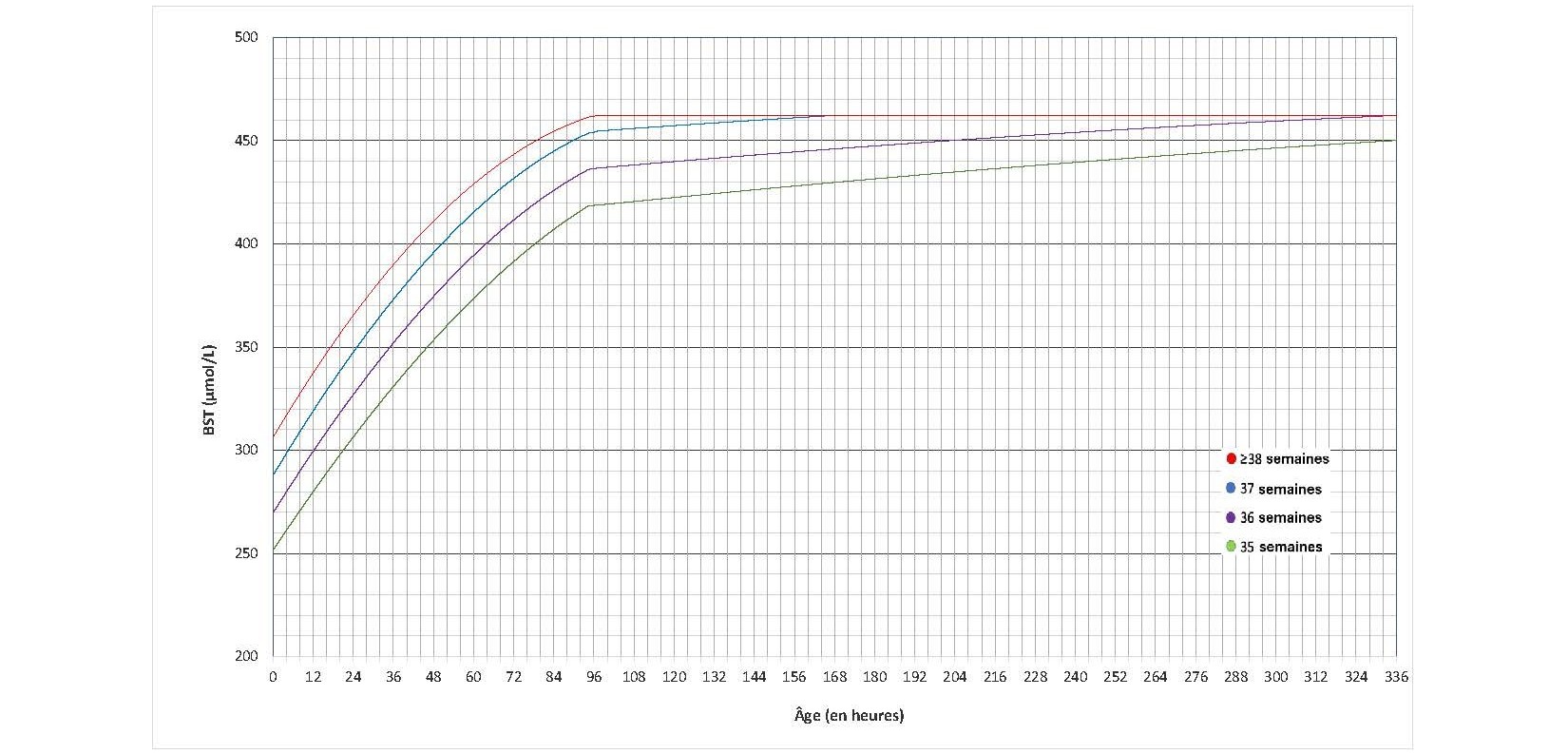
Les directives de l’AAP publiées en 2022 préconisent de nouveaux seuils pour entreprendre la photothérapie[12], légèrement supérieurs à ceux recommandés auparavant[3][6]. Elles tiennent compte des observations selon lesquelles la neurotoxicité bilirubinique et l’ictère nucléaire se produisent à des taux bien supérieurs à ceux recommandés auparavant par rapport aux effets indésirables potentiels de la photothérapie[57]. Des graphiques distincts sont présentés pour les nouveau-nés présentant ou non des facteurs de risque de neurotoxicité, et les seuils de photothérapie ont été établis pour chaque AG entre 35 et 40 semaines d’AG à la naissance (définis comme des semaines complètes aux figures 2, 3, 6 et 7).
Figure 2. Les seuils de photothérapie des nouveau-nés sans facteurs de risque de neurotoxicité (données fournies par l’AAP; utilisation autorisée)
Figure 3. Les seuils de photothérapie des nouveau-nés présentant des facteurs de risque de neurotoxicité (données fournies par l’AAP; utilisation autorisée)
Pour établir clairement jusqu’où ces nouveaux seuils dévient des directives antérieures, voir les figures S1a à c de l’annexe technique, en anglais[58].
Les modifications aux seuils de photothérapie antérieurs sont relativement modestes, mais le clinicien peut décider d’entreprendre la photothérapie chez le nouveau-né présentant des facteurs de risque de neurotoxicité si sa BST ne dépasse pas 30 µmol/L du seuil actuel de neurotoxicité alors mesuré [deuxième règle de30].
Les suppléments de liquides
Les nouveau-nés atteints d’hyperbilirubinémie peuvent également souffrir de déshydratation en raison de problèmes d’alimentation[9][59]. Selon les données probantes, des suppléments de liquide par voie intraveineuse (IV) qui dépassent le taux d’entretien quotidien de 10 % à 25 % peuvent réduire la BST en quatre à huit heures. Les suppléments de liquide par voie orale sont tout aussi efficaces que ceux par voie IV pour réduire les taux de BST[60]. Une augmentation de l’alimentation entérale, incluant le gavage, a l’avantage supplémentaire d’accroître le transit intestinal et de réduire la circulation entérohépatique de bilirubine[61][62]. Les suppléments de liquide IV devraient être réservés aux nouveau-nés présentant une grave déshydratation ou plus à risque d’ESTT (voir le protocole de préexsanguinotransfusion à la figure 5).
Les effets indésirables de la photothérapie
Selon plusieurs études récentes, la photothérapie est liée à un certain risque d’effets indésirables, comme l’asthme, les allergies, les cancers hématopoïétiques et l’épilepsie[57]. Cependant, les variables confusionnelles et la méthodologie des études ont limité toutes ces associations (voir l’annexe technique, en anglais, pour en savoir plus). Puisque la photothérapie est un traitement démontré pour réduire le risque de pronostics neurodéveloppementaux indésirables découlant d’une grave hyperbilirubinémie, le clinicien doit faire preuve de prudence lorsqu’il interprète ces études et des études similaires.
Les soins axés sur la famille pendant la photothérapie
La photothérapie peut entraver l’allaitement et les soins peau-à-peau et déclencher l’anxiété des parents dont le nouveau-né autrement en bonne santé est hospitalisé[63][64]. Il est bon d’encourager la participation de la famille au traitement[64]. Ainsi, la famille peut interrompre brièvement la photothérapie en vue de l’allaitement ou des soins peau-à-peau (on peut envisager des périodes de 20 à 30 minutes de huit à dix fois par jour en présence d’une hyperbilirubinémie légère[65]). L’utilisation d’une couverture ou d’un coussin à fibres optiques pendant la photothérapie assure le maintien de l’allaitement et des soins peau-à-peau[66].
RECOMMANDATIONS
- Offrir une photothérapie intensive à tous les nouveau-nés qui atteignent le seuil de traitement (voir les figures 2 et 3) en fonction de leur âge gestationnel (AG), de la présence de facteurs de risque de neurotoxicité (voir le tableau 1b) et des heures de vie du nouveau-né.
- Chez les nouveau-nés qui présentent des facteurs de risque de neurotoxicité, envisager une photothérapie lorsque la BST ne dépasse pas 30 μmol/L du seuil de photothérapie.
- Selon le tableau clinique et le degré d’hyperbilirubinémie, il est souvent possible de poursuivre l’allaitement et les soins peau-à-peau pendant la photothérapie, avec l’utilisation d’une couverture ou d’un coussin à fibres optiques.
La surveillance des nouveau-nés pendant la photothérapie
Les mesures sérielles sont le seul moyen de surveiller la trajectoire de la BST chez les nouveau-nés soumis à une photothérapie en raison d’une hyperbilirubinémie. La trajectoire de la BST peut être calculée selon le rythme de son augmentation, définie comme la différence entre deux valeurs de BST séquentielles prises à au moins trois heures d’intervalle, divisées par le temps écoulé entre les deux mesures[23][67]. Par exemple, lorsqu’on soupçonne une maladie hémolytique chez un nouveau-né dont la BST était de 120 µmol/L à quatre heures de vie et de 160 µmol/L à huit heures de vie, le rythme d’augmentation correspond à (160 µmol/L – 120 µmol/L)/4 heures = 10 µmol/L/h.
Grâce au calcul de la trajectoire de la BST, le clinicien peut décider de mettre un terme à la photothérapie ou d’intensifier le traitement. La fréquence des mesures de BST pendant la photothérapie dépend de l’âge du nouveau-né, de la présence de facteurs de risque d’hyperbilirubinémie et de neurotoxicité ainsi que de la trajectoire de la BST. Sauf chez les nouveau-nés dont la BST se situe dans la plage du seuil de préexsanguinotransfusion, il est recommandé de reprendre la mesure de la BST dans les 12 à 24 heures.
Chez les nouveau-nés qui ne présentent pas de facteurs de risque d’anémie hémolytique, la BST devrait baisser ou se stabiliser après le début de la photothérapie. Cependant, lorsque le taux de BST continue d’augmenter malgré la photothérapie ou que cette augmentation est d’au moins 5 µmol/L/h (jusqu’à 24 heures de vie) ou 3,5 µmol/L/h (après 24 heures de vie), on peut soupçonner une anémie hémolytique[27]. D’autres examens peuvent également être effectués : l’hémogramme, la numération réticulocytaire, l’examen du frottis sanguin afin de déceler des anomalies des membranes érythrocytaires, un TDA ou d’autres indices d’anémie hémolytique et le dosage du G6PD et de la pyruvate kinase. Compte tenu du tableau clinique, les examens peuvent également inclure une évaluation du sepsis ou de l’infection urinaire (ou des deux) et la détection de rares anticorps érythrocytaires dans une organisation de services transfusionnels.
Les nouveau-nés dont le rythme d’augmentation de la BST est anormal ou chez qui on soupçonne une anémie hémolytique devraient être soumis à une mesure de la BST au moins toutes les quatre à six heures pour évaluer si le traitement doit être intensifié jusqu’à inclure le protocole de préexsanguinotransfusion (voir la figure 5). Le clinicien doit toujours vérifier le taux d’irradiance, la distance entre la source de lumière et le corps du nouveau-né et la surface cutanée exposée pour s’assurer que celui-ci reçoit une photothérapie optimale, sans oublier de limiter les interruptions pendant les séances de photothérapie.
Le déficit en glucose-6-phosphate déshydrogénase
Le déficit en glucose-6-phosphate déshydrogénase est une anomalie enzymatique érythrocytaire récessive liée au chromosome X[68], maintenant reconnue comme l’une des principales causes de l’ictère nucléaire découlant d’une hyperbilirubinémie néonatale grave[4][69][70]. Le clinicien devrait envisager ce diagnostic en cas d’ictère persistant, car la plupart des nouveau-nés atteints n’ont pas d’histoire familiale marquée de déficit en G6PD[71]. Il devrait aussi envisager le dépistage ou le dosage du G6PD chez tous les nouveau-nés dont l’hyperbilirubinémie ne répond pas à la photothérapie ou qui en sont atteints malgré l’absence de facteurs de risque. En cas d’anémie hémolytique active, les taux d’activité du G6PD peuvent être surestimés puisque les globules rouges en circulation peuvent encore contenir assez de G6PD pour supporter le stress oxydatif, ce qui entraîne un résultat faussement négatif. Lorsqu’on soupçonne un déficit en G6PD, mais que ce déficit n’est pas confirmé (activité du G6PD normale ou quasi normale), le dépistage devrait être repris à l’âge de trois mois.
RECOMMANDATIONS
- Chez les nouveau-nés hospitalisés qui sont soumis à une photothérapie, mesurer la BST dans les 12 à 24 heures suivant le début du traitement. La fréquence de la surveillance de la BST par la suite dépend de l’âge, de la présence de facteurs de risque et de la trajectoire de la BST.
- Si la BST du nouveau-né continue d’augmenter ou ne répond pas à la photothérapie intensive, réaliser des examens supplémentaires parmi les suivants : l’hémogramme, la numération réticulocytaire, le frottis sanguin, le TDA, le dosage du G6PD ou de la pyruvate kinase et le dépistage du sepsis si l’état clinique du nouveau-né le justifie. Mesurer la BST au moins toutes les quatre à six heures pour évaluer s’il faut entreprendre le protocole de préexsanguinotransfusion.
Figure 4. La surveillance des nouveau-nés pendant la photothérapie
*S’assurer d’une irradiance appropriée, de la proximité de la source de lumière avec la peau, de la surface d’exposition et du moins d’interruptions possible de la photothérapie.
†Le seuil de préexsanguinotransfusion correspond à une BST qui ne dépasse pas 30 µmol/L du seuil d’exsanguinotransfusion.
AG âge gestationnel; BST bilirubine sérique totale; TDA test direct à l’antiglobuline; G6PD glucose-6-phosphate déshydrogénase; PK pyruvate kinase
Quand mettre un terme à la photothérapie
Lorsque la BST du nouveau-né diminue par rapport au taux précédant le traitement pour se situer sous le seuil de traitement en fonction de l’âge, il est possible de mettre un terme à la photothérapie. Une hyperbilirubinémie de rebond est possible. Elle se définit par une BST qui correspond de nouveau au seuil de photothérapie dans les 72 à 96 heures suivant la fin de la photothérapie.
L’AG (moins de 38 semaines), l’âge au début de la photothérapie (moins de 48 heures de vie) et la △-BST sont les prédicteurs les plus vigoureux d’une hyperbilirubinémie de rebond[72]-[74]. Dans une vaste étude de cohorte, l’arrêt de la photothérapie à une △-BST supérieure à 30 µmol/L limite le taux d’hyperbilirubinémie de rebond à moins de 3 % chez les nouveau-nés d’au moins 38 semaines d’AG et à moins de 11 % chez ceux de 35 à 37 semaines d’AG[73].
Chez le nouveau-né d’au moins 38 semaines d’AG, la poursuite de la photothérapie jusqu’à ce que la BST se situe à plus de 30 µmol/L sous le seuil de photothérapie contribue à limiter le risque d’hyperbilirubinémie de rebond. Chez les nouveau-nés de 35 à 37 semaines d’AG, le recours à une △-BST plus élevée qui se situe à plus de 60 µmol/L (ou à plus de 2 × 30 µmol/L) peut accroître la marge protectrice contre l’hyperbilirubinémie de rebond [troisième règle de 30].
Une nouvelle mesure de la BST effectuée pas moins de 12 à 24 heures après l’arrêt de la photothérapie permettra de détecter toute hyperbilirubinémie de rebond[75]. Chez les nouveau-nés à haut risque (p. ex., ceux qui sont atteints d’une maladie hémolytique), il est recommandé d’assurer un suivi dans les six à 12 heures, puis toutes les 24 heures par la suite, jusqu’à ce que la BST suive une tendance à la baisse et que la △-BST se situe bien au-dessus des 60 µmol/L[76]-[78]. La BTc peut être utilisée pour le suivi si une période d’au moins 18 heures s’est écoulée depuis l’arrêt de la photothérapie[50].
RECOMMANDATIONS
- Mettre un terme à la photothérapie lorsque la △-BST se situe à plus de 30 μmol/L sous le seuil de traitement chez les nouveau-nés d’au moins 38 semaines d’AG et à plus de 60 μmol/L chez les nouveau-nés de 35 à 37 semaines d’AG pour limiter le risque d’hyperbilirubinémie de rebond.
- Mesurer la BST après la fin de la photothérapie pour vérifier la présence d’une hyperbilirubinémie de rebond. La BTc peut être utilisée lors du suivi si la photothérapie est terminée depuis au moins 18 heures.
L’ictère prolongé
Un ictère prolongé est important sur le plan clinique, c’est-à dire que les taux de BST se situant dans les 35 µmol/L du seuil de photothérapie persistent après 14 jours de vie chez un nouveau-né à terme ou peu prématuré[12][79]. Même si l’ictère prolongé peut être causé par des affections découlant d’une bilirubine non conjuguée élevée, telles qu’une maladie hémolytique, une hypothyroïdie congénitale, un syndrome de Crigler-Najjar ou un syndrome de Gilbert[80], il est important d’envisager de vérifier la fraction de bilirubine directe pour écarter le diagnostic d’hyperbilirubinémie conjuguée. Il est important de vite diagnostiquer les maladies cholestatiques du foie comme l’atrésie des voies biliaires, car le traitement n’est efficace que s’il est entrepris rapidement[81][82]. La fraction de bilirubine directe est considérée comme anormale si sa valeur absolue dépasse 17 µmol/L[83]. Les diagnostics différentiels, les examens et le traitement de l’hyperbilirubinémie conjuguée dépassent la portée du présent document de principes.
RECOMMANDATIONS
- Procéder à des examens plus approfondis chez les nouveau-nés atteints d’hyperbilirubinémie persistante et importante sur le plan clinique après 14 jours de vie pour écarter une infection urinaire, une maladie thyroïdienne, une maladie hémolytique et les erreurs innées du métabolisme.
- En cas d’hyperbilirubinémie prolongée, procéder à la mesure de la fraction de bilirubine directe pour écarter une cholostase pathologique.
LE PROTOCOLE DE PRÉEXSANGUINOTRANSFUSION ET L’EXSANGUINOTRANSFUSION DE SANG TOTAL
Le protocole de préexsanguinotransfusion
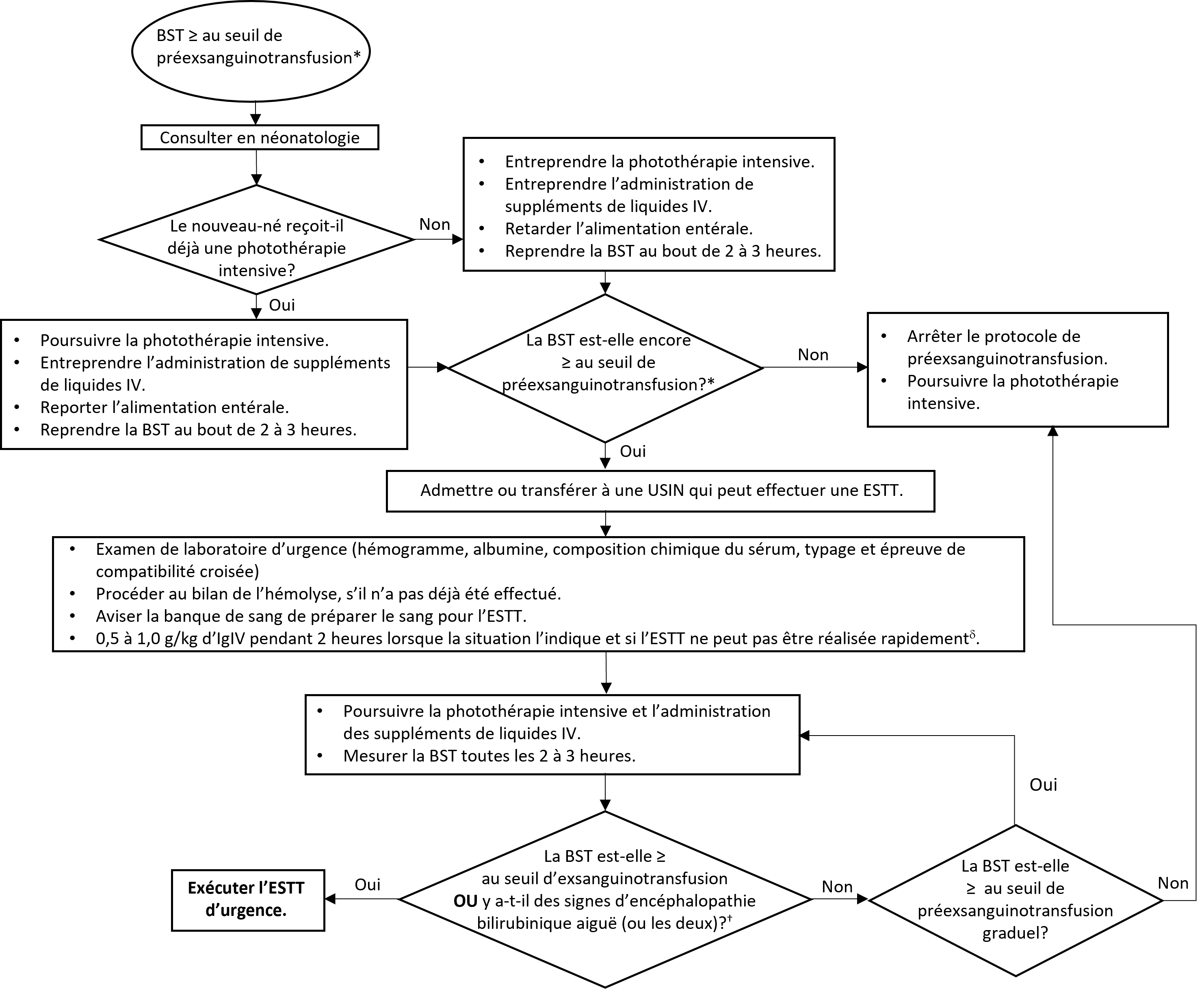
Les nouveau-nés dont la BST augmente rapidement ou qui s’approchent du seuil d’exsanguinotransfusion (voir les figures 6 et 7) en fonction de leur AG à la naissance, de leurs heures de vie et de la présence de facteurs de risque de neurotoxicité peuvent avoir besoin de soins intensifs d’urgence pour éviter l’ESTT ou être soumis à cette intervention. L’intervention peut prévenir les séquelles neurodéveloppementales marquées de l’encéphalopathie bilirubinique chronique attribuable à l’ictère nucléaire.
Le protocole de préexsanguinotransfusion est résumé à la figure 5, qui explique la trajectoire des soins d’urgence lorsqu’un nouveau-né répond aux critères. Le seuil de préexsanguinotransfusion est défini comme une BST se situant à un maximum de 30 µmol/L sous le seuil d’exsanguinotransfusion[12]. L’exécution du protocole de préexsanguinotransfusion est une urgence médicale. Le clinicien doit commencer la photothérapie intensive sans tarder, de préférence à l’aide d’un coussin ou d’une couverture de fibres optiques pour maximiser la surface corporelle exposée. Il doit consulter en néonatologie pour obtenir des conseils sur la prise en charge, y compris l’accès vasculaire, la suspension de l’alimentation en anticipation de l’ESTT et le début de l’administration de liquides IV.
Le bilan sanguin d’urgence à l’exécution du protocole de préexsanguinotransfusion inclut la bilirubine sérique totale et directe, l’hémogramme, l’albumine sérique, la composition chimique du sérum, le typage sanguin et l’épreuve de compatibilité croisée. Le clinicien doit aviser rapidement la banque de sang du centre régional qu’une ESTT pourrait avoir lieu afin d’éviter le report du traitement en attendant la reconstitution du sang total. Il doit mesurer la BST du nouveau-né au moins toutes les deux à trois heures tout au long de la transfusion, jusqu’à ce qu’elle se stabilise à 30 μmol/L sous le seuil d’exsanguinotransfusion. Le nouveau-né devrait être transféré dans une unité de soins intensifs néonatals ou un service de néonatalité en mesure de procéder à une ESTT, sans interrompre la photothérapie et les traitements d’appoint.
RECOMMANDATIONS
- Chez les nouveau-nés ayant une hyperbilirubinémie dont le taux de BST correspond au moins au seuil de préexsanguinotransfusion, défini comme une BST se situant à un maximum de 30 μmol/L sous le seuil d’exsanguinotransfusion (voir les figures 6 et 7), prodiguer des soins d’urgence graduels conformes au protocole de préexsanguinotransfusion (voir la figure 5).
- Au début du protocole, demander un bilan sanguin d’urgence pour connaître la bilirubine sérique totale et directe, l’hémogramme, l’albumine sérique, la composition chimique du sérum, le typage sanguin, l’épreuve de compatibilité croisée et le bilan de l’hémolyse (s’il n’a pas déjà été effectué).
- Mesurer la BST toutes les deux à trois heures, et la consigner par rapport aux seuils d’exsanguinotransfusion de sang total (ESTT) (voir les figures 6 et 7).
- Entreprendre immédiatement la photothérapie intensive et l’administration de liquides IV et consulter en néonatologie le plus rapidement possible. Suspendre l’alimentation entérale et se préparer au transfert en soins intensifs néonatals où il sera possible de procéder à l’ESTT.
Les immunoglobulines intraveineuses
On estime que les immunoglobulines intraveineuses (IgIV) inhibent les anticorps responsables de la destruction des globules rouges en cas d’affections comme l’iso-immunisation Rh ou d’autres maladies hémolytiques iso-immunes. Les résultats des études randomisées contrôlées contre placebo sont contradictoires, ce qui remet en question l’efficacité des IgIV à éviter l’ESTT ou à en limiter le nombre en cas de grave hyperbilirubinémie[84]-[86]. Il ne faut pas utiliser les IgIV systématiquement pour traiter les nouveau-nés atteints d’hyperbilirubinémie grave causée par une maladie hémolytique Rh ou ABO liée aux anticorps. Bien qu’on ne sache pas exactement quel rôle jouent les IgIV pour réduire les besoins en ESTT, leur administration devrait être envisagée lorsqu’il est impossible de réaliser l’ESTT rapidement[87].
RECOMMANDATION
- S’il est impossible de procéder rapidement à une ESTT, le clinicien peut envisager d’administrer de 0,5 g/kg à 1,0 g/kg d’immunoglobulines IV sur une période de deux heures aux nouveau-nés atteints d’une maladie hémolytique iso-immune dont la BST atteint le seuil de préexsanguinotransfusion. La dose peut être administrée de nouveau 12 heures plus tard.
Figure 5. Le protocole de préexsanguinotransfusion : étapes et séquences
L’exsanguinotransfusion de sang total
Lorsque la photothérapie intensive et d’autres traitements d’appoint ne réussissent pas à éviter que la BST du nouveau-né atteigne le seuil d’ESTT en fonction de son AG (voir les figures 6 et 7), une ESTT à double volume s’impose pour abaisser les concentrations de BST et réduire le risque de neurotoxicité bilirubinique. De plus, si le nouveau-né présente des signes d’encéphalopathie bilirubinique aiguë, tels l’hypertonie, l’opisthotonos, le retrocolis, les pleurs aigus, la fièvre, l’irritabilité, la torpeur, le coma ou l’apnée[88], une ESTT d’urgence doit être réalisée. Le premier taux de BST mesuré chez certains nouveau-nés peut atteindre ou dépasser le seuil d’ESTT. Dans un tel cas, le clinicien doit entreprendre une photothérapie intensive et l’administration de suppléments de liquides IV d’urgence, puis mesurer de nouveau la BST deux ou trois heures plus tard pour déterminer si l’ESTT est toujours requise (voir la figure 5).
L’ESTT est une intervention associée à un risque de morbidité marqué qui ne devrait être exécutée que dans les centres dotés des compétences, des ressources et de l’équipement appropriés. Les risques qui y sont associés incluent l’instabilité cardiorespiratoire, les complications liées au cathéter (p. ex., thrombose, infections), l’hypoglycémie, les déséquilibres électrolytiques, la thrombopénie, la coagulopathie et l’entérocolite nécrosante[86][89]. La photothérapie intensive devrait reprendre dès la fin de l’ESTT et les taux de BST devraient être surveillés conformément au protocole de transfusion (voir la figure 5).
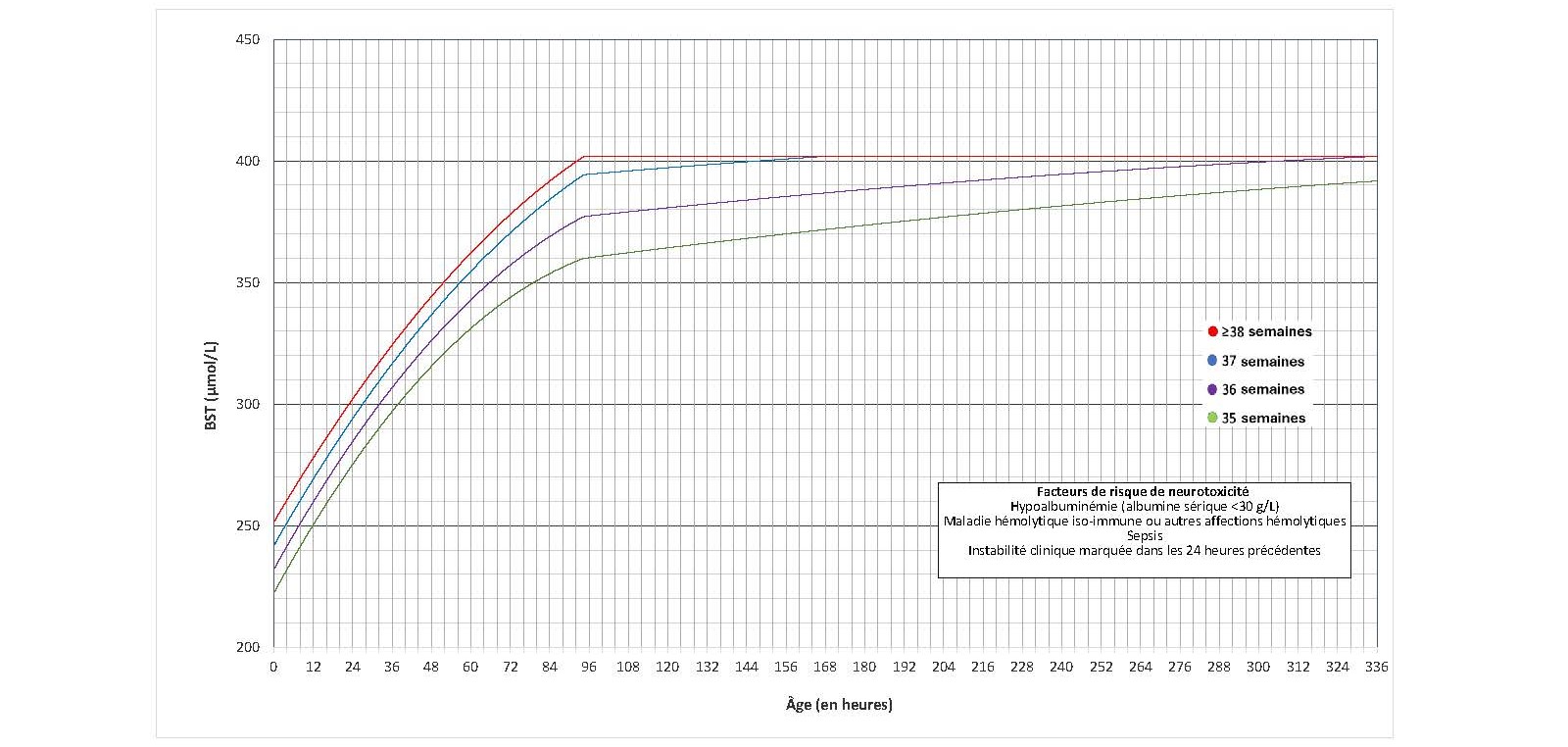
Les seuils d’exsanguinotransfusion de sang total
L’AAP a révisé les seuils d’ESTT[12] conjointement avec les modifications aux seuils de photothérapie (voir les figures 6 et 7). Voir les figures S2a à S2c de l’annexe technique, en anglais, pour obtenir une comparaison visuelle. Bien que les changements soient relativement faibles par rapport aux seuils d’ESTT antérieurs, il ne faut pas perdre de vue cette révision importante. En effet, chez les nouveau-nés qui présentent des facteurs de risque de neurotoxicité, la réduction du seuil de traitement de 30 µmol/L avoisine les seuils d’exsanguinotransfusion auparavant réservés aux nouveau-nés à haut risque. Ces valeurs coïncident avec le seuil de préexsanguinotransfusion défini ci-dessus, ce qui renforce l’importance d’être prêt à exécuter une ESTT lorsque la BST du nouveau-né ayant un ictère atteint ou dépasse le seuil de préexsanguinotransfusion.
Chez le nouveau-né qui présente des facteurs de risque de neurotoxicité dont la BST atteint le seuil de préexsanguinotransfusion (ne dépassant pas 30 µmol/L du seuil d’exsanguinotransfusion), le clinicien peut choisir d’entreprendre une ESTT immédiatement [quatrième règle de 30].
Figure 6. Les seuils d’exsanguinotransfusion chez les nouveau-nés sans facteur de risque de neurotoxicité (données fournies par l’AAP; utilisation autorisée)
Figure 7. Les seuils d’exsanguinotransfusion chez les nouveau-nés présentant des facteurs de risque de neurotoxicité (données fournies par l’AAP; utilisation autorisée)
RECOMMANDATIONS
- Exécuter une ESTT double volume d’urgence chez les nouveau-nés dont le taux de BST atteint le seuil d’exsanguinotransfusion (voir les figures 6 et 7) OU qui présentent des signes évocateurs d’une encéphalopathie bilirubinique aiguë.
- Chez les nouveau-nés présentant des facteurs de risque de neurotoxicité, envisager d’entreprendre une ESTT lorsque la BST atteint le seuil de préexsanguinotransfusion (ne dépasse pas 30 μmol/L du seuil d’exsanguinotransfusion).
|
Encadré 1. Coup d’œil sur les « règles de 30 » |
|
Première règle : Pendant le dépistage universel, lorsque la △-BST du nouveau-né ne dépasse pas 30 µmol/L, retarder le congé et surveiller la BST de près. La photothérapie doit être envisagée (figure 1, recommandation 4). |
|
Deuxième règle : Chez le nouveau-né présentant des facteurs de risque de neurotoxicité, entreprendre la photothérapie lorsque la BST ne dépasse pas 30 µmol/L sous le seuil de photothérapie (recommandation 12). |
|
Troisième règle : Pour limiter le risque d’hyperbilirubinémie de rebond, mettre un terme à la photothérapie lorsque la △-BST se situe à plus de 30 µmol/L sous le seuil de traitement chez le nouveau-né d’au moins 38 semaines d’AG et à plus de 60 µmol/L chez celui de 35 à 37 semaines d’AG (recommandation 16). |
|
Quatrième règle : Chez le nouveau-né qui présente des facteurs de risque de neurotoxicité, envisager d’entreprendre une ESTT dès que la BST atteint le seuil de préexsanguinotransfusion ou ne dépasse pas 30 µmol/L du seuil d’exsanguinotransfusion (recommandation 26). |
|
AG âge gestationnel; BST bilirubine sérique totale; ETT exsanguinotransfusion de sang total |
LA PLANIFICATION DU CONGÉ ET LE SUIVI
Après le traitement de l’hyperbilirubinémie
Tous les nouveau-nés traités contre l’ictère devraient être suivis de près jusqu’à ce que l’alimentation ou la prise de poids soient bien établies et que les taux de BST commencent à baisser. Les évaluations devraient inclure un examen physique approfondi, notamment sur les manifestations neurologiques de la toxicité bilirubinique (particulièrement chez les nouveau-nés dont les interventions ont inclus un protocole de préexsanguinotransfusion graduel ou une ESTT) et garantir un apport approprié de liquides et d’éléments nutritifs. Les nouveau-nés atteints d’un ictère hémolytique peuvent souffrir d’anémie tardive à cause des anticorps passifs persistants, les résultats des taux d’hémoglobuline étant les plus faibles entre quatre et six semaines de vie chez ceux qui n’ont eu pas besoin d’ESTT, et entre huit et dix semaines de vie chez ceux qui en ont eu besoin[90][91].
La bilirubine peut influer sur les noyaux cochléaires du tronc cérébral et sur le nerf auditif[92]. Les études de cohorte démontrent que le risque de déficience auditive augmente considérablement chez les nouveau-nés dont le taux de BST dépasse le seuil de 400 µmol/L à 600 µmol/L[93][94]. Leur risque augmente proportionnellement à la gravité de l’hyperbilirubinémie et à la durée d’exposition à la bilirubine[95][96]. Les nouveau-nés atteints d’hyperbilirubinémie marquée, qui ont reçu une ESTT ou dont la BST de pointe a atteint ou dépassé les seuils préexsanguinotransfusion devraient être dirigés vers une évaluation officielle en audiologie[97].
Les nouveau-nés présentant une histoire d’hyperbilirubinémie marquée peuvent en subir des séquelles développementales importantes à long terme. Ceux dont les taux de BST ont atteint ou dépassé le seuil de préexsanguinotransfusion, qui ont été soumis à une ESTT ou ont présenté des signes neurologiques anormaux avant ou après le traitement devraient être orientés vers un suivi neurodéveloppemental longitudinal[98]-[103].
RECOMMANDATIONS
- Assurer un suivi étroit après le congé des nouveau-nés ayant souffert d’une hyperbilirubinémie attribuable à une maladie hémolytique iso-immune, y compris le dépistage de l’hémoglobine entre quatre et dix semaines de vie pour détecter une anémie tardive.
- Diriger les nouveau-nés qui ont souffert d’une hyperbilirubinémie marquée (dont la BST de pointe était supérieure à 400 μmol/L, qui ont atteint ou dépassé le seuil de préexsanguinotransfusion ou qui ont été soumis à une ESTT) en audiologie en vue d’une évaluation auditive officielle.
- Diriger les nouveau-nés vers un suivi neurodéveloppemental longitudinal s’ils ont atteint ou dépassé le seuil de préexsanguinotransfusion, qu’ils aient ou non reçu une ESTT, ou s’ils ont présenté des signes neurologiques anormaux associés à l’hyperbilirubinémie.
CONCLUSION
L’ictère nucléaire causé par une grave hyperbilirubinémie est évitable chez les nouveau-nés. Le dépistage précoce de l’ictère et des mesures immédiates, des conseils préventifs aux familles sur les signes et symptômes, un suivi postnatal approprié et un soutien à l’allaitement dans la communauté peuvent contribuer à éviter les séquelles neurodéveloppementales indésirables de grave hyperbilirubinémie[104]. Le présent document de principes contient les stratégies clés pour détecter les nouveau-nés à haut risque d’hyperbilirubinémie marquée et pour standardiser le traitement. D’un point de vue systémique, la collaboration avec des professionnels de la santé et des laboratoires communautaires, un soutien à l’allaitement et un partenariat avec les familles sont essentiels pour prévenir l’hyperbilirubinémie néonatale et la prendre en charge.
Outils à l’intention des praticiennes et des praticiens
Les graphiques sur les seuils de photothérapie et d’exsanguinotransfusion de chaque groupe d’âge gestationnel qui sont exposés aux figures 2, 3, 6 et 7 sont créés afin de permettre aux cliniciens de les imprimer et de les utiliser pour suivre la tendance de BST ou de BTc. Suivez les hyperliens pour avoir accès aux graphiques imprimables.
L’outil hyperbili en ligne a été créé à partir de ce document de principes pour aider les professionnels de la santé néonatale à prendre en charge l’hyperbilirubinémie néonatale. Vous pouvez y accéder ici. Nous remercions le docteur Michael Hill de l’avoir préparé.
Remerciements
Les auteurs tiennent à remercier les docteurs Michael Sgro, Douglas Campbell, Lani Lieberman, ainsi que les docteurs Alex Kemper et Thomas Newman de l’American Academy of Pediatrics, pour leurs conseils lors de la préparation du présent document de principes. Le manuscrit a été révisé par le comité de nutrition et de gastroentérologie, le comité de la pédiatrie communautaire et le comité des soins aigus de la Société canadienne de pédiatrie, de même que par des membres du groupe d’intérêt des soins de maternité et de périnatalité du Collège des médecins de famille du Canada.
COMITÉ D’ÉTUDE DU FŒTUS ET DU NOUVEAU-NÉ DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2024-2025)
Membres : Michael Narvey MD (président), Heidi Budden MD (représentante du conseil), Souvik Mitra MD M. Sc., Eugene Ng MD, Gabriel Altit MD, Nicole Radziminski MD, Anne-Sophie Gervais MD (membre résidente)
Représentants : William Ehman (Le Collège des médecins de famille du Canada), Chantal Nelson (Agence de la santé publique du Canada), Eric Eichenwald (comité d’étude du fœtus et du nouveau-né, American Academy of Pediatrics), Douglas Wilson (La Société des obstétriciens et gynécologues du Canada), Isabelle Milette (Association canadienne des infirmières et infirmiers en néonatalogie), Emer Finan MBBCH (section de la médecine néonatale et périnatale de la SCP)
Auteurs : Eugene Ng MD, Gabriel Altit MD, Chloe Joynt MD, Nicole Radziminski MD, Michael Narvey MD
Financement
Aucun financement n’a été accordé pour la préparation du présent manuscrit.
Conflits d’intérêts potentiels
Aucun auteur n’a déclaré de conflits d’intérêts.
Références
- Bhutani VK, Zipursky A, Blencowe H et coll. Neonatal hyperbilirubinemia and rhesus disease of the newborn: Incidence and impairment estimates for 2010 at regional and global levels. Pediatr Res 2013;74 (Suppl 1):86-100. doi : 10.1038/pr.2013.208
- Zhang M, Tang J, He Y et coll. Systematic review of global clinical practice guidelines for neonatal hyperbilirubinemia. BMJ Open 2021;11(1):e040182. doi : 10.1136/bmjopen-2020-040182
- Barrington KJ, Sankaran K; Société canadienne de pédiatrie, comité d’étude du fœtus et du nouveau-né. Lignes directrices pour la détection, la prise en charge et la prévention de l’hyperbilirubinémie chez les nouveau-nés à terme et peu prématurés (35 semaines d’âge gestationnel ou plus) – Résumé. Paediatr Child Health 2007;12(5):411-8. doi : 10.1093/pch/12.5.411
- Sgro M, Campbell D, Shah V. Incidence and causes of severe neonatal hyperbilirubinemia in Canada. CMAJ 2006;175(6):587-90. doi : 10.1503/cmaj.060328
- Sgro M, Kandasamy S, Shah V, Ofner M, Campbell D. Severe neonatal hyperbilirubinemia decreased after the 2007 Canadian guidelines. J Pediatr 2016;171:43-7. doi : 10.1016/j.jpeds.2015.12.067
- American Academy of Pediatrics, sous-comité de l’hyperbilirubinémie. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004;114(1):297-316. doi : 10.1542/peds.114.1.297
- AlOtaibi SF, Blaser S, MacGregor DL. Neurological complications of kernicterus. Can J Neurol Sci 2005;32(3):311-5. doi : 10.1017/s0317167100004182
- Maisels MJ, Newman TB. Kernicterus in otherwise healthy, breast-fed term newborns. Pediatrics 1995;96(4 Pt 1):730-3. doi : 10.1542/peds.96.4.730
- Manning D, Todd P, Maxwell M, Jane Platt M. Prospective surveillance study of severe hyperbilirubinaemia in the newborn in the UK and Ireland. Arch Dis Child Fetal Neonatal Ed 2007;92(5):F342-6. doi : 10.1136/adc.2006.105361
- Newman TB, Maisels MJ. Less aggressive treatment of neonatal jaundice and reports of kernicterus: Lessons about practice guidelines. Pediatrics 2000;105(1 Pt 3):242-5. doi : 10.1542/peds.105.S2.242
- Sgro M, Campbell DM, Kandasamy S, Shah V. Incidence of chronic bilirubin encephalopathy in Canada, 2007-2008. Pediatrics 2012;130(4):e886-90. doi : 10.1542/peds.2012-0253
- Kemper AR, Newman TB, Slaughter JL et coll. Clinical practice guideline revision: Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2022;150(3):e2022058859. doi : 10.1542/peds.2022-058859
- Fung-Kee-Fung K, Wong K, Walsh J, Hamel C, Clarke G. Directive clinique nᵒ 448 : Prévention de l’allo-immunisation Rhésus D. J Obstet Gynaecol Can 2024;46(4):102448. doi : 10.1016/j.jogc.2024.102448
- AlKhater SA, Albalwi RA, Alomar SA et coll. Value of the direct antiglobulin test in predicting the need for phototherapy in newborns. J Blood Med 2021;12:53-61. doi : 10.2147/JBM.S291606
- Dinesh D. Review of positive direct antiglobulin tests found on cord blood sampling. J Paediatr Child Health 2005;41(9-10):504-7. doi : 10.1111/j.1440-754.2005.00692.x
- Herschel M, Karrison T, Wen M, Caldarelli L, Baron B. Evaluation of the direct antiglobulin (Coombs’) test for identifying newborns at risk for hemolysis as determined by end-tidal carbon monoxide concentration (ETCOc); and comparison of the Coombs’ test with ETCOc for detecting significant jaundice. J Perinatol 2002;22(5):341-7. doi : 10.1038/sj.jp.7210702
- Meberg A, Johansen KB. Screening for neonatal hyperbilirubinaemia and ABO alloimmunization at the time of testing for phenylketonuria and congenital hypothyreosis. Acta Paediatr 1998;87(12):1269-74. doi : 10.1080/080352598750030960
- Anderson NB, Calkins KL. Neonatal indirect hyperbilirubinemia. Neoreviews 2020;21(11):e749-60. doi : 10.1542/neo.21-11-e749
- Maayan-Metzger A, Schwartz T, Sulkes J, Merlob P. Maternal anti-D prophylaxis during pregnancy does not cause neonatal haemolysis. Arch Dis Child Fetal Neonatal Ed 2001;84(1):F60-2. doi : 10.1136/fn.84.1.f60
- Keir A, Agpalo M, Lieberman L, Callum J. How to use: The direct antiglobulin test in newborns. Arch Dis Child Educ Pract Ed 2015;100(4):198-203. doi : 10.1136/archdischild-2013-305553
- Sgro M, Campbell D, Shah V. Coombs’ testing and neonatal hyperbilirubinemia. CMAJ 2007;176(7):973-6. doi : 10.1503/cmaj.1060213
- Bhutani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific serum bilirubin for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatrics 1999;103(1):6-14. doi : 10.1542/peds.103.1.6
- Kuzniewicz MW, Park J, Niki H, Walsh EM, McCulloch CE, Newman TB. Predicting the need for phototherapy after discharge. Pediatrics 2021;147(5):e2020019778. doi : 10.1542/peds.2020-019778
- Stevenson DK, Fanaroff AA, Maisels MJ et coll. Prediction of hyperbilirubinemia in near-term and term infants. J Perinatol 2001;21(Suppl 1):S63-72; discussion S83-7. doi : 10.1038/sj.jp.7210638.
- Mallard C, Wang X. Infection-induced vulnerability of perinatal brain injury. Neurol Res Int 2012;2012:102153. doi : 10.1155/2012/102153
- Brito MA, Palmela I, Cardoso FL, Sá-Pereira I, Brites D. Blood-brain barrier and bilirubin: Clinical aspects and experimental data. Arch Med Res 2014;45(8):660-76. doi : 10.1016/j.arcmed.2014.11.015
- Ahlfors CE. The Bilirubin Binding Panel: A Henderson-Hasselbalch approach to neonatal hyperbilirubinemia. Pediatrics 2016;138(4):e20154378. doi : 10.1542/peds.2015-4378
- Maisels MJ, Newman TB. Jaundice in full-term and near-term babies who leave the hospital within 36 hours. The pediatrician’s nemesis. Clin Perinatol 1998;25(2):295-302. doi : 10.1016/S0095-5108(18)30116-7
- McDonald SJ, Middleton P, Dowswell T, Morris PS. Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes. Cochrane Database Syst Rev 2013(7):CD004074. doi : 10.1002/14651858.CD004074.pub3
- Yaşartekin Y, Sarıcı SU, Özcan M et coll. Investigation of the relationship between cord clamping time and risk of hyperbilirubinemia. Turk J Pediatr 2020;62(5):756-62. doi : 10.24953/turkjped.2020.05.006
- Kuzniewicz MW, Escobar GJ, Wi S, Liljestrand P, McCulloch C, Newman TB. Risk factors for severe hyperbilirubinemia among infants with borderline bilirubin levels: A nested case-control study. J Pediatr 2008;153(2):234-40. doi : 10.1016/j.jpeds.2008.01.028
- Maisels MJ, Watchko JF. Improving post-discharge neonatal surveillance for the jaundiced newborn. Acta Paediatr 2020;109(5):872-3. doi : 10.1111/apa.15154
- Flaherman VJ, Maisels MJ; Academy of Breastfeeding Medicine. ABM clinical protocol #22: Guidelines for management of jaundice in the breastfeeding infant 35 weeks or more of gestation—revised 2017. Breastfeed Med 2017;12(5):250-7. doi : 10.1089/bfm.2017.29042.vjf
- Huang A, Tai BC, Wong LY, Lee J, Yong EL. Differential risk for early breastfeeding jaundice in a multi-ethnic Asian cohort. Ann Acad Med Singap 2009;38(3):217-24. doi : 10.47102/annals-acadmedsg.V38N3p217
- Sato H, Uchida T, Toyota K et coll. Association of neonatal hyperbilirubinemia in breast-fed infants with UGT1A1 or SLCOs polymorphisms. J Hum Genet 2015;60(1):35-40. doi : 10.1038/jhg.2014.98
- Johnson LH, Bhutani VK, Brown AK. System-based approach to management of neonatal jaundice and prevention of kernicterus. J Pediatr 2002;140(4):396-403. doi : 10.1067/mpd.2002.123098
- Maisels MJ, Gifford K. Breast-feeding, weight loss, and jaundice. J Pediatr 1983;102(1):117-8. doi : 10.1016/s0022-3476(83)80305-9
- Chen YJ, Yeh TF, Chen CM. Effect of breast‐feeding frequency on hyperbilirubinemia in breast‐fed term neonate. Pediatr Int 2015;57(6):1121-5. doi : 10.1111/ped.12667
- Hassan B, Zakerihamidi M. The correlation between frequency and duration of breastfeeding and the severity of neonatal hyperbilirubinemia. J Mat Fetal Neonat Med 2018;31(4):457-63. doi : 10.1080/14767058.2017.1287897
- Chang RJ, Chou HC, Chang YH et coll. Weight loss percentage prediction of subsequent neonatal hyperbilirubinemia in exclusively breastfed neonates. Pediatr Neonatol 2012;53(1):41-4. doi : 10.1016/j.pedneo.2011.11.008
- Chen YJ, Chen WC, Chen CM. Risk factors for hyperbilirubinemia in breastfed term neonates. Eur J Pediatr 2012;171(1):167-71. doi : 10.1007/s00431-011-1512-8
- Tomlinson C, Haiek LN; Société canadienne de pédiatrie, comité de nutrition et de gastroentérologie. L’allaitement et le lait humain en soins intensifs néonatals : de la naissance jusqu’au congé. Le 6 juin 2023.
- Maisels MJ, Kring EA, Coffey MP. Heme catabolism and bilirubin production in readmitted jaundiced newborns. J Pediatr 2020;226:285-8. doi : 10.1016/j.jpeds.2020.06.012
- Keren R, Tremont K, Luan X, Cnaan A. Visual assessment of jaundice in term and late preterm infants. Arch Dis Child Fetal Neonatal Ed 2009;94(5):F317-22. doi : 10.1136/adc.2008.150714
- Eidelman AI, Schimmel MS, Algur N, Eylath U. Capillary and venous bilirubin values: They are different--and how! Am J Dis Child 1989;143(6):642. doi : 10.1001/archpedi.1989.02150180020007
- Leslie GI, Philips JB, Cassady G. Capillary and venous bilirubin values. Are they really different? Am J Dis Child 1987;141(11):1199-200. doi : 10.1001/archpedi.1987.04460110069024
- Maisels MJ. Capillary vs venous bilirubin values. Am J Dis Child 1990;144(5):521-2. doi : 10.1001/archpedi.1990.02150290015011
- Maisels MJ, Bhutani VK, Bogen D, Newman TB, Stark AR, Watchko JF. Hyperbilirubinemia in the newborn infant > or =35 weeks’ gestation: An update with clarifications. Pediatrics 2009;124(4):1193-8. doi : 10.1542/peds.2009-0329
- Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics 2000;106(2):E17. doi : 10.1542/peds.106.2.e17
- Campbell DM, Danayan KC, McGovern V, Cheema S, Stade B, Sgro M. Transcutaneous bilirubin measurement at the time of hospital discharge in a multiethnic newborn population. Paediatr Child Health 2011;16(3):141-5. doi : 10.1093/pch/16.3.141
- Engle WD, Jackson GL, Stehel EK, Sendelbach DM, Manning MD. Evaluation of a transcutaneous jaundice meter following hospital discharge in term and near-term neonates. J Perinatol 2005;25(7):486-90. doi : 10.1038/sj.jp.7211333
- Dam-Vervloet AJ, van Erk MD, Doorn N et coll. Inter-device reproducibility of transcutaneous bilirubin meters. Pediatr Res 2021;89(4):770-5. doi : 10.1038/s41390-020-01118-6
- Ng Y, Maul T, Viswanathan S, Chua C. The accuracy of transcutaneous bilirubin as a screening test in preterm infants. Cureus 2023;15(8):e42793. doi : 10.7759/cureus.42793
- Rodríguez-Capote K, Kim K, Paes B, Turner D, Grey V. Clinical implication of the difference between transcutaneous bilirubinometry and total serum bilirubin for the classification of newborns at risk of hyperbilirubinemia. Clin Biochem 2009;42(3):176-9. doi : 10.1016/j.clinbiochem.2008.09.108
- Borden AR, Satrom KM, Wratkowski P et coll. Variation in the phototherapy practices and irradiance of devices in a major metropolitan area. Neonatology 2018;113(3):269-74. doi : 10.1159/000485369
- Sampurna MTA, Etika R, Utomo MT et coll. An evaluation of phototherapy device performance in a tertiary health facility. Heliyon 2020;6(9):e04950. doi : 10.1016/j.heliyon.2020.e04950
- Slaughter JL, Kemper AR, Newman TB. Technical report: Diagnosis and management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2022;150(3): e2022058865. doi : 10.1542/peds.2022-058865
- Ng E. Screening for neonatal hyperbilirubinemia: Translating guidelines into practice. Neonatology Today 2010;5(3):1-6.
- Gourley GR. Breast-feeding, neonatal jaundice and kernicterus. Semin Neonatol 2002;7(2):135-41. doi : 10.1053/siny.2002.0101
- Boo NY, Lee HT. Randomized controlled trial of oral versus intravenous fluid supplementation on serum bilirubin level during phototherapy of term infants with severe hyperbilirubinaemia. J Paediatr Child Health 2002;38(2):151-5. doi : 10.1046/j.1440-1754.2002.00746.x
- Lai NM, Ahmad Kamar A, Choo YM, Kong JY, Ngim CF. Fluid supplementation for neonatal unconjugated hyperbilirubinaemia. Cochrane Database Syst Rev 2017;8(8):CD011891. doi : 10.1002/14651858.CD011891.pub2
- Nicoll A, Ginsburg R, Tripp JH. Supplementary feeding and jaundice in newborns. Acta Paediatr Scand 1982;71(5):759-61. doi : 10.1111/j.1651-2227.1982.tb09515.x
- Hannon PR, Willis SK, Scrimshaw SC. Persistence of maternal concerns surrounding neonatal jaundice: An exploratory study. Arch Pediatr Adolesc Med 2001;155(12):1357-63. doi : 10.1001/archpedi.155.12.1357
- Szucs KA, Rosenman MB. Family-centered, evidence-based phototherapy delivery. Pediatrics 2013;131(6):e1982-5. doi : 10.1542/peds.2012-3479
- Wang J, Guo G, Li A, Cai WQ, Wang X. Challenges of phototherapy for neonatal hyperbilirubinemia (Review). Exp Ther Med 2021;21(3):231. doi : 10.3892/etm.2021.9662
- Altit G, Hamilton D, O’Brien K; Société canadienne de pédiatrie, comité d’étude du fœtus et du nouveau-né. Les soins peau-à-peau chez les nourrissons à terme et prématurés. Le 11 janvier 2024.
- Kaplan M, Maisels MJ. Natural history of early neonatal bilirubinemia: A global perspective. J Perinatol 2021;41(4):873-8. doi : 10.1038/s41372-020-00901-x
- Groupe de travail de l’OMS. Glucose-6-phosphate dehydrogenase deficiency. Bull World Health Organ 1989;67(6):601-11.
- Johnson L, Bhutani VK, Karp K, Sivieri EM, Shapiro SM. Clinical report from the pilot USA Kernicterus Registry (1992 to 2004). J Perinatol 2009;29 (Suppl 1):S25-45. doi : 10.1038/jp.2008.211
- Kuzniewicz MW, Wickremasinghe AC, Wu YW et coll. Incidence, etiology, and outcomes of hazardous hyperbilirubinemia in newborns. Pediatrics 2014;134(3):504-9. doi : 10.1542/peds.2014-0987
- Ostfeld-Johns S, Aragona E, Hart L. Removing race from hyperbilirubinemia guidelines is not enough. JAMA Pediatr 2022;176(12):1163-4. doi : 10.1001/jamapediatrics.2022.3865
- Barak M, Berger I, Dollberg S, Mimouni FB, Mandel D. When should phototherapy be stopped? A pilot study comparing two targets of serum bilirubin concentration. Acta Paediatr 2009;98(2):277-81. doi : 10.1111/j.1651-2227.2008.01015.x
- Chang PW, Newman TB. A simpler prediction rule for rebound hyperbilirubinemia. Pediatrics 2019;144(1):e20183712. doi : 10.1542/peds.2018-3712
- Almohammadi H, Nasef N, Al-Harbi A, Saidy K, Nour I. Risk factors and predictors of rebound hyperbilirubinemia in a term and late-preterm infant with hemolysis. Am J Perinatol 2022;39(8):836-43. doi : 10.1055/s-0040-1718946
- Kaplan M, Kaplan E, Hammerman C et coll. Post-phototherapy neonatal bilirubin rebound: A potential cause of significant hyperbilirubinaemia. Arch Dis Child 2006;91(1):31-4. doi : 10.1136/adc.2005.081224
- Maisels MJ, Kring E. Rebound in serum bilirubin level following intensive phototherapy. Arch Pediatr Adolesc Med 2002;156(7):669-72. doi : 10.1001/archpedi.156.7.669
- Tan KL, Dong F. Transcutaneous bilirubinometry during and after phototherapy. Acta Paediatr 2003;92(3):327-31. doi : 10.1111/j.1651-2227.2003.tb00554.x
- Grabenhenrich J, Grabenhenrich L, Bührer C, Berns M. Transcutaneous bilirubin after phototherapy in term and preterm infants. Pediatrics 2014;134(5):e1324-9. doi : 10.1542/peds.2014-1677
- Rennie J, Burman-Roy S, Murphy MS; groupe de développement des directives. Neonatal jaundice: Summary of NICE guidance. BMJ 2010;340:c2409. doi : 10.1136/bmj.c2409
- Pillai A, Pandita A, Osiovich H, Manhas D. Pathogenesis and management of indirect hyperbilirubinemia in preterm neonates less than 35 weeks: Moving toward a standardized approach. Neoreviews 2020;21(5):e298-307. doi : 10.1542/neo.21-5-e298
- Giannattasio A, Ranucci G, Raimondi F. Prolonged neonatal jaundice. Ital J Pediatr 2015;41(Suppl 2):A36. doi : 10.1186/1824-7288-41-S2-A36
- Venigalla S, Gourley GR. Neonatal cholestasis. Semin Perinatol 2004;28(5):348-55. doi : 10.1053/j.semperi.2004.09.008
- Fawaz R, Baumann U, Ekong U et coll. Guideline for the evaluation of cholestatic jaundice in infants: Joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr 2017;64(1):154-68. doi : 10.1097/MPG.0000000000001334
- Santos MC, Sá C, Gomes SC, Camacho LA, Moreira ME. The efficacy of the use of intravenous human immunoglobulin in Brazilian newborns with rhesus hemolytic disease: A randomized double-blind trial. Transfusion 2013;53(4):777-82. doi : 10.1111/j.1537-2995.2012.03827.x
- Smits-Wintjens VE, Walther FJ, Rath ME et coll. Intravenous immunoglobulin in neonates with rhesus hemolytic disease: A randomized controlled trial. Pediatrics 2011;127(4):680-6. doi : 10.1542/peds.2010-3242
- Zwiers C, Scheffer-Rath ME, Lopriore E, de Haas M, Liley HG. Immunoglobulin for alloimmune hemolytic disease in neonates. Cochrane Database Syst Rev 2018;3(3):CD003313. doi : 10.1002/14651858.CD003313.pub2
- Lieberman L, Lopriore E, Baker JM et coll. International guidelines regarding the role of IVIG in the management of Rh- and ABO-mediated haemolytic disease of the newborn. Br J Haematol 2022;198(1):183-95. doi : 10.1111/bjh.18170
- Sgro M, Campbell D, Barozzino T, Shah V. Acute neurological findings in a national cohort of neonates with severe neonatal hyperbilirubinemia. J Perinatol 2011;31(6):392-6. doi : 10.1038/jp.2010.137
- Pace EJ, Brown CM, DeGeorge KC. Neonatal hyperbilirubinemia: An evidence-based approach. J Fam Pract 2019;68(1):E4-E11.
- Mitchell S, James A. Severe late anemia of hemolytic disease of the newborn. Paediatr Child Health 1999;4(3):201-3. doi : 10.1093/pch/4.3.201
- Ebbesen F. Late anaemia in infants with rhesus haemolytic disease treated with intensive phototherapy. Eur J Pediatr 1979;130(4):285-90. doi : 10.1007/BF00441365
- Olds C, Oghalai JS. Bilirubin-induced audiologic injury in preterm infants. Clin Perinatol 2016;43(2):313-23. doi : 10.1016/j.clp.2016.01.006
- Wickremasinghe AC, Kuzniewicz MW, Grimes BA, McCulloch CE, Newman TB. Neonatal phototherapy and infantile cancer. Pediatrics. 2016;137(6). doi :10.1542/peds.2015-1353
- Dey SK, Islam S, Jahan I et coll. Association of hyperbilirubinemia requiring phototherapy or exchange transfusion with hearing impairment among admitted term and late preterm newborn in a NICU. Mymensingh Med J. 2020;29(2):405-13.
- Akinpelu OV, Waissbluth S, Daniel SJ. Auditory risk of hyperbilirubinemia in term newborns: A systematic review. Int J Pediatr Otorhinolaryngol 2013;77(6):898-905. doi : 10.1016/j.ijporl.2013.03.029
- Besli GE, Metin F, Aksit MA, Saltik S. Long-term effects of indirect hyperbilirubinemia on auditory and neurological functions in term newborns. Medeni Med J 2020;35(1):29-39. doi : 10.5222/MMJ.2020.26986
- Patel H, Feldman M; Société canadienne de pédiatrie, comité de la pédiatrie communautaire. Le dépistage universel des troubles de l’audition chez les nouveau-nés. Paediatr Child Health 2011;16(5):306-10. doi : 10.1093/pch/16.5.306
- Lunsing RJ, Pardoen WF, Hadders-Algra M. Neurodevelopment after moderate hyperbilirubinemia at term. Pediatr Res 2013;73(5):655-60. doi : 10.1038/pr.2013.28
- Grimmer I, Berger-Jones K, Bührer C, Brandl U, Obladen M. Late neurological sequelae of non-hemolytic hyperbilirubinemia of healthy term neonates. Acta Paediatr 1999;88(6):661-3. doi : 10.1080/08035259950169341
- Newman TB, Klebanoff MA. Neonatal hyperbilirubinemia and long-term outcome: Another look at the Collaborative Perinatal Project. Pediatrics 1993;92(5):651-7. doi : 10.1542/peds.92.5.651
- Ozmert E, Erdem G, Topçu M et coll. Long-term follow-up of indirect hyperbilirubinemia in full-term Turkish infants. Acta Paediatr 1996;85(12):1440-4. doi : 10.1111/j.1651-2227.1996.tb13949.x
- Soorani-Lunsing I, Woltil HA, Hadders-Algra M. Are moderate degrees of hyperbilirubinemia in healthy term neonates really safe for the brain? Pediatr Res 2001;50(6):701-5. doi : 10.1203/00006450-200112000-00012
- Hokkanen L, Launes J, Michelsson K. Adult neurobehavioral outcome of hyperbilirubinemia in full term neonates—A 30 year prospective follow-up study. Peer J 2014;2:e294. doi : 10.7717/peerj.294
- Manning D. Neonatal jaundice: In the eye of the beholder? Arch Dis Child Fetal Neonatal Ed 2009;94(5):F314-6. doi : 10.1136/adc.2008.156356
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.