Document de principes
Le sommeil, c’est important : favoriser un sommeil sain chez les enfants et les adolescents ayant des troubles neurodéveloppementaux
Affichage : le 19 août 2025
Auteur(s) principal(aux)
Megan Thomas MBChB, Ph. D., Sarah Shea MD; Société canadienne de pédiatrie, Comité de la santé mentale et des troubles du développement
Résumé
Les enfants qui ont des troubles neurodéveloppementaux sont très vulnérables aux problèmes de sommeil, qui peuvent nuire à leur santé et à celle de leur famille. La bonification du sommeil peut être l’un des moyens les plus efficaces d’améliorer le comportement, l’humeur, les interactions sociales positives, l’attention et l’apprentissage, ainsi que de réduire les futurs risques de mauvais état de santé mentale et métabolique. Bien que l’insomnie constitue le problème le plus fréquent, on observe un taux plus élevé d’autres troubles du sommeil au sein de cette population. Il est important détecter les problèmes de sommeil rapidement et d’intervenir tout aussi vite, y compris de reconnaître ou d’exclure les affections qui y contribuent. La plupart des troubles du sommeil peuvent être corrigés grâce à des mesures visant à améliorer les habitudes et l’hygiène de sommeil, de même que des stratégies comportementales respectueuses de la diversité culturelle et des priorités parentales. Si les stratégies comportementales échouent ou ne sont que partiellement efficaces, on peut utiliser de la mélatonine sous supervision médicale. Il faudra peut-être adopter d’autres stratégies pharmacologiques dans les cas difficiles, pourvu qu’elles fassent l’objet d’une évaluation et d’une surveillance étroites, car la plupart risquent de nuire à la qualité du sommeil ou de provoquer des effets secondaires.
Mots-clés : autisme; mélatonine; sommeil; sommeil sain; troubles neurodéveloppementaux
Contexte
Le sommeil est important pour maintenir et optimiser la santé physique et mentale, y compris le fonctionnement immunitaire[1], la perception de la douleur[2][3], la mémoire et l’apprentissage[4], le comportement[5] et l’humeur[6], la santé cardiovasculaire et le fonctionnement métabolique[7]. Un sommeil sain ne désigne pas seulement l’absence de trouble du sommeil. Il se caractérise par une satisfaction subjective, un moment approprié, une durée suffisante, une efficacité élevée et une vigilance soutenue pendant les heures d’éveil[8]. Malgré son importance, le sommeil est trop peu priorisé dans les programmes de santé publique ou d’enseignement clinique[9][10].
Le cycle de sommeil normal se divise en quatre phases différentes qui se répètent environ toutes les 60 à 90 minutes tout au long de la nuit. La première phase est brève et légère; la deuxième occupe la plus grande partie de la nuit; la troisième correspond au sommeil profond, également désigné sommeil lent profond, et la phase finale est celle du sommeil paradoxal (ou sommeil REM) au cours de laquelle se produisent les rêves. Les trois premières phases sont des périodes de sommeil lent (ou sommeil non REM). Après une brève période de réveil, un nouveau cycle de sommeil commence. La durée de chaque cycle varie selon la période de la nuit. Les périodes de sommeil lent profond sont plus longues en début de nuit, lorsque les réveils partiels peuvent entraîner des parasomnies, et les périodes de sommeil paradoxal sont plus longues vers la fin de la nuit, qui correspond généralement à la période des cauchemars. La structure et la proportion des diverses phases de sommeil au sein de chaque cycle forment l’« architecture du sommeil ». Elles sont influencées par les taux d’activité, la consommation d’alcool, la prise de médicaments, l’âge et le développement, l’excitation avant le sommeil, les problèmes respiratoires et d’autres facteurs. Il est plus facile de favoriser un sommeil sain lorsqu’on comprend le sommeil normal.
Les enfants et les adolescents qui ont des troubles neurodéveloppementaux (TND), ce qui inclut désormais les affections génétiques qui touchent le neurodéveloppement et les troubles neurodéveloppementaux définis dans le DSM-5[11], présentent une prévalence de problèmes de sommeil d’au moins 80 %[12]. Les problèmes de sommeil chez les enfants amènent à un manque de sommeil pour les membres de la famille et ont de vastes conséquences pour la santé et le fonctionnement familiaux[13]-[15].
Les principaux problèmes de sommeil chez les enfants et les adolescents ayant un TND se classent dans la catégorie des insomnies comportementales[16] et incluent la résistance au coucher, la latence d’endormissement prolongée, les réveils nocturnes et les réveils trop matinaux. Ce sont les mêmes problèmes de sommeil que chez les enfants au développement typique, et les enfants TND réagissent généralement aux mêmes interventions pour optimiser les habitudes de sommeil (hygiène de sommeil) et les interventions comportementales[16]-[20]. Cependant, chez les enfants qui vivent avec un TND, ces problèmes sont plus fréquents, sont plus souvent chroniques et peuvent nécessiter des étapes supplémentaires et une plus longue période avant d’être corrigés[21].
Les affections connexes sont plus fréquentes chez les enfants ayant un TND. Le sommeil a un lien bidirectionnel avec bon nombre d’entre elles, ce qui rend les interventions d’autant plus importantes.
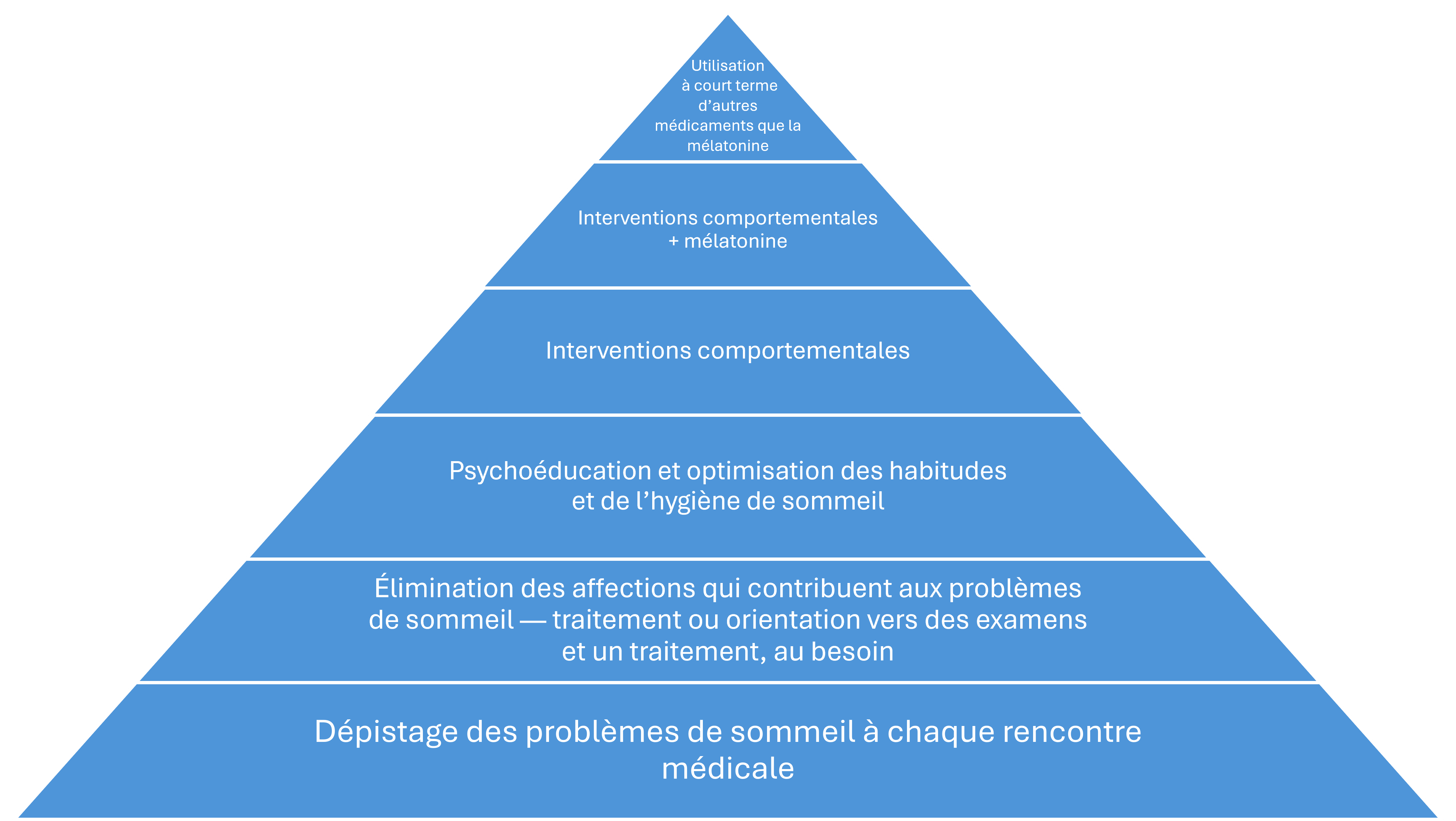
Figure 1. Cadre pour évaluer et prendre en charge les troubles du sommeil
Cadre pour évaluer et prendre en charge les troubles du sommeil (figure 1)
Le dépistage des problèmes de sommeil
La surveillance du sommeil et les conseils préventifs pour optimiser le sommeil devraient faire partie intégrante des soins de tous les enfants ayant un TND. Le recours à des questionnaires de dépistage peut être utile, tels que le questionnaire BEARS (acronyme anglais de problèmes au coucher [Bedtime], somnolence diurne Excessive, réveils [Awakenings] nocturnes, Régularité et durée du sommeil et troubles respiratoires du Sommeil) chez les enfants de deux à 12 ans[22] et l’échelle d’hygiène du sommeil des adolescents[23] pour les jeunes de plus 12 ans.
L’élimination des affections qui contribuent aux problèmes de sommeil
Chez les enfants ayant un TND, la plupart des problèmes de sommeil sont liés au comportement, mais les troubles du sommeil particuliers sont tout de même plus courants dans cette population[24]. De plus, les allergies, le reflux gastro-œsophagien, la constipation, la carie dentaire et d’autres sources de douleur sont courants. Les convulsions nocturnes peuvent généralement être détectées d’après l’histoire clinique, mais il faut tout de même les envisager en raison de la plus grande prévalence d’épilepsie au sein de cette population.
Les médicaments administrés pour traiter les affections physiques et neurodéveloppementales peuvent être responsables d’un retard de l’endormissement, d’un sommeil non réparateur, d’une somnolence diurne et de perturbations du sommeil. Parmi les exemples, soulignons les médicaments pour traiter le trouble de déficit de l’attention/hyperactivité (TDA/H), les inhibiteurs sélectifs du recaptage de la sérotonine (ISRS), certains anticonvulsivants et les corticostéroïdes.
Un journal du sommeil, tenu pendant une période minimale de sept jours, est l’examen le plus utile pour la plupart des enfants. La mesure du taux de ferritine arrive au deuxième rang des examens les plus utiles. Un taux de ferritine de 24 ng/mL à 30 ng/mL (en fonction de l’âge de l’enfant) peut être considéré comme approprié pour la synthèse de l’hémoglobine. Toutefois, un taux de plus de 50 ng/mL est recommandé pour favoriser le sommeil, en raison du rôle du fer pour les neurotransmetteurs que sont la sérotonine, la noradrénaline et la dopamine. De plus, les taux de ferritine périphériques doivent être plus élevés pour atteindre la quantité optimale dans le liquide céphalorachidien[25][26]. Des lignes directrices à l’égard des examens de la teneur en fer et du traitement subséquent sont en cours de préparation.
Pour diagnostiquer certains troubles du sommeil, des études du sommeil s’imposent. L’accès à de telles études est limité au Canada. Il faut prioriser l’augmentation du nombre de spécialistes des troubles du sommeil et de laboratoires d’évaluation du sommeil et en améliorer l’accès dans le milieu de la santé.
La psychoéducation et l’optimisation des habitudes et de l’hygiène de sommeil
La structure normale du sommeil change tout au long de la vie. Le sommeil fait partie du rythme circadien sur 24 heures, et pour l’optimiser, il faut promouvoir des habitudes positives pendant la journée tout autant que pendant la nuit. Si trop d’attention est accordée à la nuit, bon nombre des facteurs qui peuvent compromettre un sommeil sain passeront inaperçus.
Le sommeil est régi par deux grands facteurs : la pression du sommeil, qui s’accroît à mesure que se prolonge la période d’éveil, et le rythme circadien, qui dépend de la lumière et de la régularité des processus biologiques, comme l’heure des repas, du coucher et du lever.
Le sommeil fonctionne par cycles. Les réveils partiels ou même complets sont donc normaux plusieurs fois par nuit chez les enfants. Le soir, il est essentiel que l’enfant s’endorme pour la première fois de la même façon dont il se rendormira lors des réveils normaux, c’est-à-dire dans son propre lit, seul et non pendant un boire ou le visionnement d’un écran. La difficulté à s’endormir est souvent liée à la dépendance envers des associations avec le sommeil, comme une présence parentale. Les réveils nocturnes problématiques découlent souvent du fait que l’enfant n’a jamais appris à s’endormir seul[27]. Le tableau 1 propose des liens vers une série de ressources utiles, dont la plupart sont en anglais.
| Tableau 1. Information et ressources en matière de sommeil | |||
|
Population ciblée |
Caractéristiques supplémentaires |
Origine |
Lien |
|
Toute |
États-Unis |
||
|
Toute |
Jour et nuit |
Canada |
Profitez au maximum de votre journée. Bougez Plus. Soyez moins sédentaire. Dormez bien. |
|
Toute |
23 langues |
Australie |
|
|
Enfants de 0 à 3 ans |
Spécialistes du sommeil en pédiatrie |
Multiple |
|
|
Enfants de 3 à 10 ans |
Plusieurs langues |
Australie |
Sleep relaxation for children: in pictures Better sleep for autistic children 3-8 years: tips |
|
Enfants ayant des invalidités |
Renseignements détaillés |
Royaume-Uni |
|
|
Enfants ayant un TSA |
Royaume-Uni |
||
|
Enfants ayant un TSA |
Horaire visuel Sommaire des stratégies |
États-Unis |
ATN/AIR-P Strategies to Improve Sleep in Children with Autism |
|
Adolescents |
États-Unis |
||
|
Adolescents ayant un TSA |
États-Unis |
||
|
Adultes ayant un TSA |
Royaume-Uni |
||
|
Tout âge ayant un TND |
Troubles du sommeil et examens proposés |
Royaume-Uni |
Paediatric neurodisability and sleep disorders: clinical pathways and management strategies |
TND trouble neurodéveloppemental; TSA trouble du spectre de l’autisme
La correction des problèmes de sommeil chez les enfants ayant des troubles neurodéveloppementaux : l’importance de l’histoire
Les études révèlent qu’il est possible d’obtenir une histoire du sommeil et de négocier un plan de sommeil adapté dans le cadre d’un rendez-vous d’une heure[28][29]. Un suivi téléphonique pour offrir un renforcement continu ou apporter des corrections mineures est d’une efficacité démontrée[28][30].
En présence de problèmes de sommeil, une histoire détaillée s’impose pour orienter l’intervention.
L’histoire du sommeil
Le clinicien doit obtenir l’information appropriée verbalement face à face ou au moyen d’un questionnaire; il peut aussi opter pour les deux démarches. Il doit commencer par s’informer de l’heure du repas du soir, puis progresser tout au long d’une soirée et d’une nuit habituelles, sans oublier l’heure du lever, les siestes et une brève revue de la journée. Il peut être utile de se souvenir de l’ABC du sommeil[31] : 1) la régularité des heures du coucher et du lever adaptées à l’âge, 2) des horaires et des habitudes quotidiennes (routines), 3) le lieu, 4) l’exercice et le régime alimentaire, 5) l’absence d’écrans dans la chambre ou avant le coucher, 6) la positivité 7) l’autonomie pour s’endormir et 8) la réponse aux besoins de l’enfant pendant la journée pour 9) favoriser un excellent sommeil. La prise de médicaments sur ordonnance ou en vente libre, de suppléments, de caféine, de cannabis ou d’alcool doit être consignée au dossier.
L’histoire de l’environnement social et familial
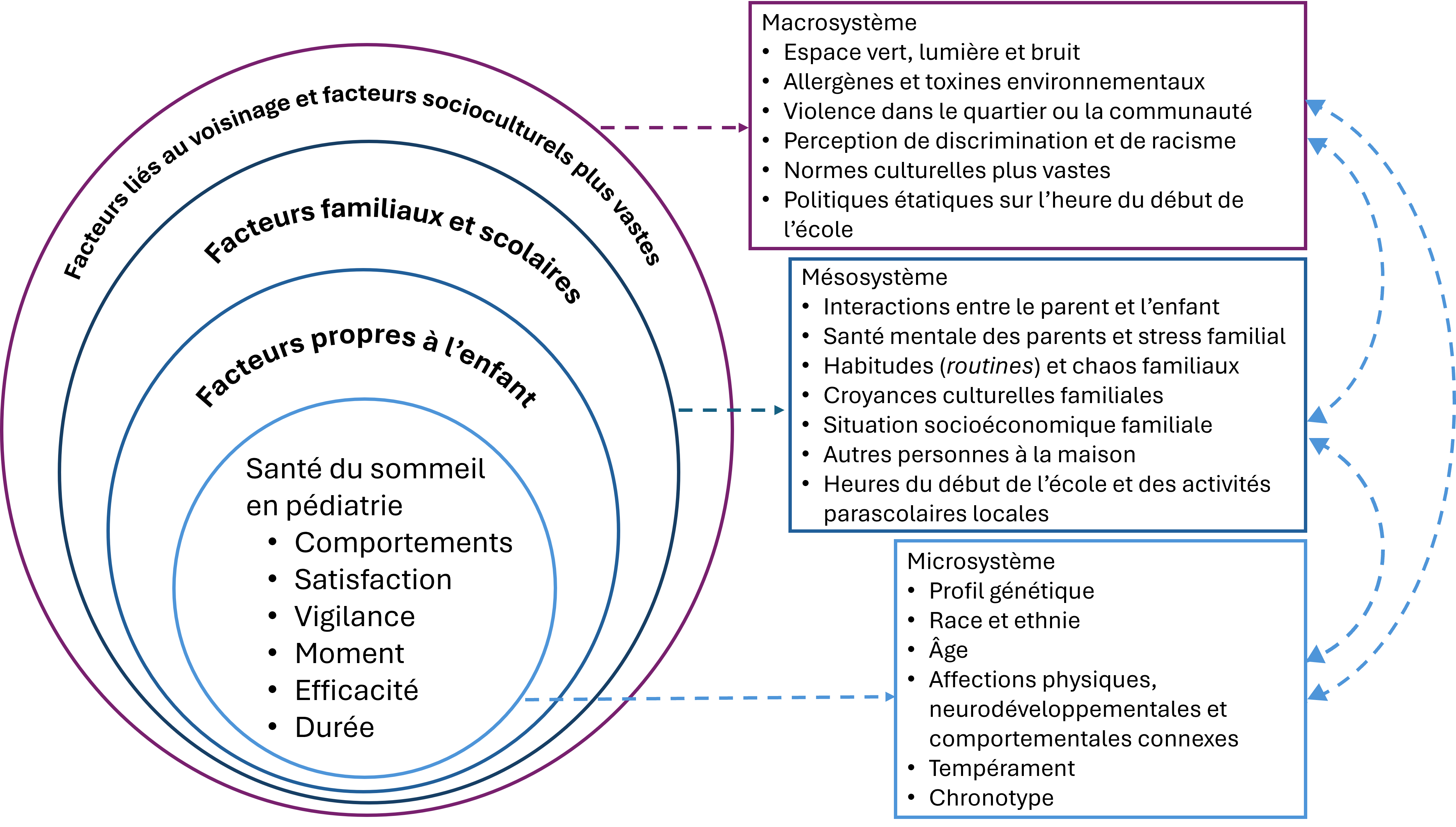
L’incidence de problèmes de sommeil est nettement plus élevée dans les familles qui vivent dans des situations environnementales et sociales difficiles (p. ex., logement sous-optimal, surpeuplement, insécurité alimentaire, peur de la violence, niveau de bruit élevé ou plaintes des voisins au sujet de l’enfant ayant un TND ou d’autres enjeux). Il est important de ne pas présumer que l’enfant est la seule source des problèmes de sommeil, mais de tenir compte du contexte global, y compris s’il dort dans un lit approprié ou a assez à manger. Il peut être plus difficile de recourir à des interventions quand d’autres enfants partagent la chambre ou que les voisins entrent en ligne de compte. Des échanges avec les parents pour connaître leurs priorités, puis l’établissement de moyens pour y répondre et les soutenir, sont des éléments essentiels des soins à cette étape. La figure 2 expose les principaux facteurs qui contribuent à la santé du sommeil[32].
Figure 2. Les facteurs socioécologiques qui sont présumés contribuer aux domaines de la santé du sommeil en pédiatrie
Traduit avec l’autorisation de la référence 32
Les interventions en cas de problèmes de sommeil
Lorsque les problèmes de sommeil sont de courte durée ou que seuls un ou deux facteurs facilement modifiables doivent être corrigés, la transmission d’information aux parents sur les saines pratiques de sommeil suffira peut-être. Dans une étude, 35 % des familles ont affirmé avoir constaté une amélioration marquée après la simple réception d’un livret d’information[33]. Les parents sont généralement les principaux agents de changement lors des interventions, mais dans la mesure du possible, les enfants et les adolescents ayant un TND doivent également contribuer à fixer les priorités et les objectifs. Lorsque les cliniciens comprennent les étapes du changement comportemental, qu’ils en discutent avec les parents[34] et qu’ils privilégient l’entrevue motivationnelle[35], la probabilité de succès s’accentue.
La gestion du comportement
Les données probantes sur l’efficacité de la gestion comportementale des problèmes de sommeil sont bien établies chez les enfants au développement typique[36]. Des données plus récentes sur son efficacité en cas de TND ont donné lieu à la création de directives et de recommandations, selon lesquelles la gestion du comportement est la première ligne d’intervention une fois les raisons médicales envisagées et traitées ou écartées[17][20][28][37]-[43].
La personnalisation des conseils en optimise le succès. Bien que les principes d’un sommeil sain soient universels, des aménagements peuvent s’imposer afin de tenir compte des préférences culturelles ou environnementales ou de celles des parents ou de l’enfant. Par exemple, une chambre entièrement sombre est idéale pour dormir, mais pour certains enfants, c’est une source d’anxiété. Le remplacement des ampoules bleues ou blanches par des ampoules jaunes ou rouges, les plus faibles possibles, représente un compromis efficace. L’enfant peut refuser de renoncer aux écrans avant le coucher, mais peut accepter la stratégie d’arrêter de les utiliser plus tôt dans la soirée. Lorsque les parents optent pour le cododo, cette décision doit être respectée et intégrée au plan.
Le changement comportemental peut être difficile à mettre en œuvre et prend du temps. Les tentatives pour modifier de multiples habitudes ou situations simultanément ou l’adoption d’un trop gros changement en bloc ne permettent pas à l’enfant ou à l’adolescent de s’adapter sur le plan physiologique, affectif et cognitif.
L’insomnie comportementale
Il peut être utile de diviser les problèmes relatifs au sommeil en courtes périodes (habitudes avant le coucher et au coucher, période d’endormissement et d’apparition du sommeil, réveils et comportements nocturnes, moment du réveil et capacité de commencer la journée).
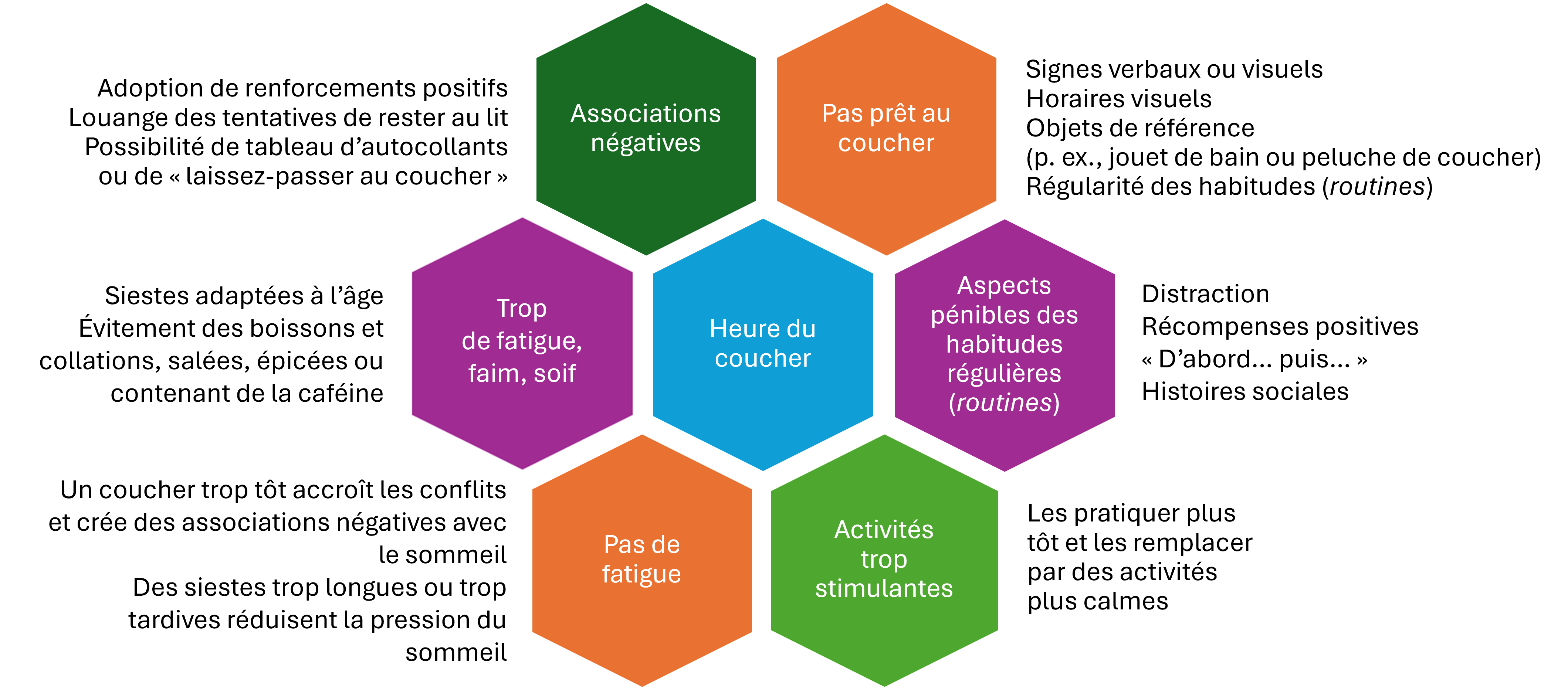
Les habitudes avant le coucher et au coucher
Il faut viser à ce que le sommeil et le coucher soient perçus comme les volets d’un processus calme, agréable et positif. Le clinicien doit explorer et corriger les facteurs qui vont à l’encontre de cet objectif (voir la figure 3). Des ressources de soutien figurent au tableau 1, et les stratégies décrites dans le site ATN/AIR-P Strategies to Improve Sleep in Children with Autism, en anglais, sont particulièrement utiles.
Figure 3. Stratégies en appui à une période de coucher calme et agréable
Les réveils et les comportements nocturnes
Les réveils nocturnes problématiques découlent souvent du fait que l’enfant n’a jamais appris à s’endormir seul. Il est fondamental de s’assurer d’établir cette compétence en début de nuit. D’autres raisons peuvent expliquer les réveils nocturnes. Des facteurs externes en font partie, comme le bruit, mais aussi des facteurs intrinsèques, comme la douleur, le reflux ou la constipation, les problèmes de maintien du sommeil et les parasomnies. Les problèmes de maintien du sommeil peuvent également être attribuables à l’absence d’habitudes régulières, à une surexcitation avant le sommeil, à la prise de médicaments, à des troubles du sommeil comme les troubles respiratoires du sommeil et à des facteurs génétiques qui perturbent l’architecture du sommeil.
Les réveils trop matinaux
Les parents devraient rechercher et retirer les facteurs de renforcement négligés, comme l’accès aux jeux vidéo. Ils peuvent envisager d’intégrer des signes visuels indiquant quand il est acceptable de se lever, comme un réveille-matin annoté ou lumineux. Si l’enfant dort assez longtemps, mais est lève-tôt, il peut être récompensé s’il joue calmement dans sa chambre sans déranger les autres.
Les parasomnies
Les parasomnies sont des expériences indésirables qui se produisent pendant le sommeil. Les parasomnies du sommeil lent profond comprennent les terreurs nocturnes, le somnambulisme et les réveils confusionnels. Les cliniciens doivent conseiller aux parents de ne pas réveiller l’enfant pendant un épisode, mais de simplement s’assurer qu’il est en sécurité et, au besoin, de le ramener au lit. Les parasomnies sont plus fréquentes en cas de manque de sommeil; il est donc important de corriger les raisons précises d’une mauvaise qualité de sommeil. Les terreurs nocturnes prennent la forme d’épisodes de détresse intense, ponctuées de vocalisations et de mouvements en période de sommeil partiel. En général, l’enfant ne se souvient pas de ces événements, mais les parents peuvent les trouver éprouvants. Une terreur nocturne se prolonge d’ordinaire plusieurs minutes, mais peut atteindre de 20 à 40 minutes. Si les terreurs nocturnes sont particulièrement fréquentes ou dérangeantes, il peut être efficace de réveiller l’enfant toutes les nuits de 15 à 30 minutes avant le moment où elles ont généralement lieu, et ce, sur une période d’au moins deux semaines[44]. En revanche, les cauchemars se produisent pendant le sommeil paradoxal et suscitent de vifs souvenirs. Il est bon de réconforter et de rassurer l’enfant qui fait des cauchemars, mais les parents devraient éviter de régler le problème par le cododo. Si un cauchemar donné est récurrent, il peut être utile d’opter pour une imagerie dirigée pendant la journée, c’est-à-dire parler de la séquence du cauchemar avec l’enfant ou l’adolescent, puis l’aider à la transformer en événement amusant ou non menaçant.
L’assistance pharmacologique
Les médicaments ne devraient pas être la première solution ou la seule intervention en cas de problème de sommeil en pédiatrie. Cependant, ils peuvent avoir un rôle à jouer s’ils sont combinés à une prise en charge non pharmacologique ou comportementale[45]-[47]. Il est également important d’optimiser la teneur en fer dans le régime alimentaire ou, si la situation l’indique, par des suppléments de fer[48].
La mélatonine
La mélatonine, qui est facilement disponible au Canada, est largement utilisée par les parents pour régler les problèmes de sommeil de leurs enfants. Les cliniciens devraient comprendre le fonctionnement de la mélatonine et être prêts à échanger avec les familles au sujet de cette option.
La mélatonine est une hormone produite par la glande pinéale en réponse à un faible éclairage, et elle joue un rôle important dans le cycle circadien. Elle a un effet de déphasage lorsqu’elle est administrée près des doses physiologiques (de 0,1 mg à 0,3 mg quelques heures avant le coucher). Lorsqu’elle est administrée aux doses supraphysiologiques généralement prescrites pour promouvoir le sommeil (de 1 mg à 5 mg), la mélatonine a des propriétés à la fois somnifères et anxiolytiques[49]. Les taux de mélatonine augmentent normalement pendant la soirée, mais sont supprimés par la lumière, et particulièrement la lumière bleue. La sécrétion de mélatonine se déclenche chez le nourrisson de trois à six mois de vie, atteint un taux maximal pendant la petite enfance, puis diminue au début de la puberté. Un sommeil irrégulier nuit à la production de mélatonine, tandis que des habitudes de sommeil régulières en favorisent la sécrétion normale. Le stress et des taux élevés de cortisol ont l’effet opposé de la mélatonine : ils retardent l’apparition du sommeil et le fragmentent davantage[50]. Des taux réduits de mélatonine sont associés à diverses maladies. À cet égard, plusieurs études ont démontré des anomalies physiologiques chez les enfants ayant un trouble du spectre de l’autisme par rapport à des sujets témoins[51].
On peut considérer que l’action de la mélatonine induit un état comportemental propice à l’apparition du sommeil[49]. Par conséquent, il est important d’utiliser la mélatonine en plus des stratégies comportementales, plutôt qu’isolément[42]. Il est également important de ne pas en administrer une dose supplémentaire pendant la nuit si l’enfant se réveille, en raison de ses propriétés chronobiotiques. Les préparations à libération lente sont plus efficaces pour imiter la libération endogène de la mélatonine[52].
Plusieurs études randomisées et contrôlées[33][52]-[57], analyses systématiques et méta-analyses sur l’utilisation de la mélatonine en cas de TND, notamment le trouble du spectre de l’autisme, tant pendant qu’après les interventions comportementales[17][40][51][58]-[60], ont établi systématiquement que la mélatonine raccourcit le temps d’endormissement. La fatigue (6,3 %), la somnolence (6,3 %) et les sautes d’humeur (4,2 %)[56] sont les événements indésirables les plus liés au traitement.
L’absence de produit de qualité pharmaceutique sous licence en Amérique du Nord complique l’utilisation sécuritaire de la mélatonine. Une étude canadienne a démontré l’importante variabilité du taux de mélatonine dans les produits de santé naturels étiquetés sous le nom de mélatonine, en plus de la présence d’autres substances[61]. L’absence d’efficacité et les effets secondaires de ces produits peuvent être attribuables à la variation de la dose ou à la présence d’autres substances. Malgré ces préoccupations, les proches se disent satisfaits après l’administration de mélatonine à leur enfant et déclarent que le traitement a des effets positifs sur leur propre qualité de vie[62][63]. Ils expriment également une préférence pour la mélatonine utilisée conjointement avec des interventions comportementales[62]. L’International Paediatric Sleep Association a publié une déclaration consensuelle de spécialistes en 2024[40], laquelle contient des recommandations relatives aux enfants ayant un trouble du spectre de l’autisme ou un autre TND (voir le tableau 2).
| Tableau 2. Les recommandations relatives à la mélatonine | |||||
|
Avertissement |
Indication |
Premiers correctifs |
Dose |
Moment de l’administration |
Contre-indication |
|
Utiliser sous supervision médicale et réévaluer périodiquement |
Insomnie par apparition tardive du sommeil si les stratégies comportementales ne sont pas pleinement efficaces |
Affections coexistantes Médication concomitante Autres raisons expliquant le retard de l’apparition du sommeil |
1 mg à 3 mg Accroître graduellement, au besoin, jusqu’à une dose maximale de 10 mg |
De 30 à 60 minutes avant le moment souhaité de l’endormissement |
Enfant <2 ans sans les conseils d’un spécialiste du sommeil en pédiatrie |
Les autres médicaments
Au Canada, aucun médicament sous licence contre l’insomnie n’est destiné aux enfants et aux adolescents, il n’existe pas de formulations appropriées et les directives au sujet des doses thérapeutiques et sécuritaires en fonction des divers âges sont limitées. Les médicaments considérés comme favorables au sommeil sont souvent sédatifs plutôt que propices à des cycles du sommeil sains, et ils peuvent avoir des effets cognitifs et physiologiques négatifs, même si l’enfant semble dormir plus longtemps. Si le clinicien est d’avis qu’un médicament doit être administré, le choix doit dépendre de la nature du problème de sommeil et des affections cooccurrentes. Le risque d’observer des interactions médicamenteuses indésirables[64] ou d’aggraver un trouble respiratoire obstructif doit être pris en compte[45].
Il est bon d’échanger et de s’entendre sur des objectifs clairs avec les parents, sans oublier d’explorer les attentes de la famille et des proches, dans l’objectif d’atténuer plutôt que d’éliminer les problèmes de sommeil. Les critères qui déterminent le moment d’administrer un médicament (de manière intermittente au besoin ou tous les soirs), le moment de l’administrer et les paliers posologiques, de même qu’une stratégie d’arrêt, doivent tous être expliqués clairement et convenus avant le début du traitement. Une surveillance étroite et fréquente des effets pharmacologiques positifs et négatifs s’impose[39][45][46][65]-[69] (voir le tableau 3).
| Tableau 3. Les médicaments aux propriétés sédatives utilisés dans une indication non conforme à l’étiquette | ||||
|
Médicament |
Effets sur le sommeil |
Données probantes sur ses avantages |
Effets secondaires |
Quand l’envisager |
|
Antihistaminiques |
Peuvent réduire la LE |
Pas d’avantages par rapport à un placebo selon des ÉRC[65] |
Altération de la qualité du sommeil Effet gueule de bois Apparition rapide d’une tolérance Excitabilité paradoxale |
Utilisation à court terme (2 ou 3 jours) |
|
Benzodiazépines et médicaments apparentés |
Réduisent le SLP et le sommeil paradoxal Accroissent le sommeil léger |
Efficacité limitée par rapport à un placebo lors d’études pédiatriques[66][67] |
Contre-indiquées chez les enfants Désinhibition comportementale diurne Ataxie Amnésie antérograde[46] Sédation diurne Atteinte cognitive Insomnie de rebond[64] |
Prise en charge par un spécialiste des symptômes neurologiques particuliers ou des parasomnies extrêmement intrusives |
|
Clonidine |
Réduit la LE Nuit à l’architecture du sommeil (SLP et sommeil paradoxal)[46] |
Données probantes faibles selon une étude ouverte auprès de 19 enfants[68] |
Sécheresse de la bouche Sédation diurne Bradycardie, hypotension Hypertension de rebond Réveils confusionnels Tolérance |
TDA/H SJSR |
|
Guanfacine |
Accroît les réveils après l’endormissement Réduit la LE |
Une ÉRC interrompue avant terme en raison d’effets secondaires et d’une durée de sommeil totale plus courte qu’avec un placebo[69] |
Sédation diurne |
TDA/H |
|
Doxépine (faible dose seulement, de 1 mg à 6 mg) |
Maintien du sommeil |
Analyse rétrospective des dossiers médicaux |
Sédation diurne |
Utilisation à court terme en cas de réveils nocturnes (de 2 à 4 semaines) |
|
Trazodone (faible dose seulement, de 25 mg à 50 mg) |
Réduit la LE Accroît le SLP Réduit le sommeil paradoxal |
Aucune étude chez les enfants. Chez les adultes, aucune amélioration par rapport au moment de référence lors d’une utilisation à long terme |
Étourdissements, vertiges, fatigue Surstimulation du SNC Tolérance Insomnie de rebond |
Utilisation à court terme (1 mois) et stratégie de sortie claire[45] Conjointement avec la prise en charge des troubles de l’humeur |
|
Antipsychotiques atypiques (rispéridone, quétiapine, aripiprazole, olanzapine) |
Accroît la continuité du sommeil Supprime le sommeil paradoxal Accroît l’agitation motrice |
Aucune étude sur l’insomnie chez les enfants |
Effets secondaires métaboliques considérables, qui peuvent contribuer à aggraver les problèmes de sommeil, comme les troubles respiratoires du sommeil[64] Sédation diurne |
Utilisation seulement en présence d’affections connexes (p. ex., agressivité ou comportements d’automutilation) |
|
Gabapentine |
Peut accroître la continuité du sommeil |
Analyse rétrospective des dossiers médicaux |
Sédation diurne Agitation et difficulté à s’endormir |
SJSR Utilisation dans le cadre de la prise en charge de la dystonie ou des douleurs neuropathiques |
|
ÉRC études randomisées et contrôlées; LE latence d’endormissement; mg milligrammes; SJSR syndrome des jambes sans repos; SLP sommeil lent profond; SNC système nerveux central; TDA/H trouble de déficit de l’attention/hyperactivité |
||||
Les traitements parallèles
Les données probantes sont limitées quant à l’efficacité de traitements parallèles comme l’acupuncture, les acides gras essentiels ou les couvertures lestées[58]. Les bruits de fond (bruit blanc ou rose) peuvent être utiles, mais peu d’études se sont intéressées à leur efficacité. Il faut s’assurer de placer l’appareil hors de portée et de régler le son à un niveau sécuritaire[70]. Les parents doivent comprendre que les bruits de fond ou la musique peuvent devenir associés au sommeil et que les réveils nocturnes risquent de s’aggraver si les bruits de fond ne se poursuivent pas toute la nuit.
Recommandations
- Promouvoir un sommeil sain par la surveillance et envisager qu’un trouble du sommeil peut être un facteur contributif chez les enfants qui ont des problèmes physiques ou mentaux ou des problèmes d’apprentissage ou de comportement.
- Admettre que les interventions comportementales visant à promouvoir le sommeil devront peut-être être subdivisées en étapes plus courtes et qu’il faudra plus de temps avant que le sommeil des personnes ayant un trouble neurodéveloppemental s’améliore.
- Comprendre que le sommeil et la sédation ne s’équivalent pas et que de nombreux médicaments prescrits pour dormir nuisent à l’architecture normale du sommeil et ne favorisent pas un sommeil sain et réparateur.
- Revendiquer un meilleur accès à des services spécialisés de gestion du sommeil pour le diagnostic et le traitement des troubles complexes du sommeil.
- Revendiquer pour rendre la mélatonine de qualité pharmaceutique disponible au Canada.
Remerciements
Le comité de la pédiatrie communautaire et le comité directeur de la section de la pédiatrie du développement de la Société canadienne de pédiatrie ont révisé le présent document de principes, de même que des représentants de la Société canadienne du sommeil.
COMITÉ DE LA SANTÉ MENTALE ET DES TROUBLES DU DÉVELOPPEMENT DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2024-2025)
Membres : Scott McLeod MD (président), Amy Ornstein MD (représentante du conseil), Natasha Saunders MD, Megan Thomas Ph. D., MBChB, Ripudaman Minhas MD, Lester Liao MD, Man Ying Bernice Ho B. Sc. (membre résidente)
Représentants : Olivia MacLeod MD (Académie canadienne de psychiatrie de l’enfant et de l’adolescent), Angela Orsino MD (section de la pédiatrie du développement de la SCP), Leigh Wincott MD (section de la santé mentale de la SCP)
Autrices principales : Megan Thomas MBChB, Ph. D., Sarah Shea MD
Financement
Aucun financement n’a été accordé pour la préparation du présent manuscrit.
Conflits d’intérêts potentiels
La docteure Megan Thomas déclare siéger au conseil d’administration des Nova Scotia Early Childhood Development Intervention Services. Aucun autre auteur n’a déclaré de conflits d’intérêts.
Références
- Bryant PA, Trinder J, Curtis N. Sick and tired: Does sleep have a vital role in the immune system? Nat Rev Immunol 2004;4(6):457-67. doi : 10.1038/nri1369
- Finan PH, Goodin BR, Smith MT. The association of sleep and pain: An update and a path forward. J Pain 2013;14(12):1539-52. doi : 10.1016/j.jpain.2013.08.007
- Lautenbacher S, Kundermann B, Krieg JC. Sleep deprivation and pain perception. Sleep Med Rev 2006;10(5):357-69. doi : 10.1016/j.smrv.2005.08.001
- Hill CM, Hogan AM, Karmiloff-Smith A. To sleep, perchance to enrich learning? Arch Dis Child 2007;92(7):637-43. doi : 10.1136/adc.2006.096156
- Beebe DW. Cognitive, behavioral, and functional consequences of inadequate sleep in children and adolescents. Pediatr Clin North Am 2011;58(3):649-65. doi : 10.1016/j.pcl.2011.03.002
- Triantafillou S, Saeb S, Lattie EG, Mohr DC, Kording KP. Relationship between sleep quality and mood: Ecological momentary assessment study. JMIR Ment Health 2019;6(3):e12613. doi : 10.2196/12613
- Quist JS, Sjödin A, Chaput JP, Hjorth MF. Sleep and cardiometabolic risk in children and adolescents. Sleep Med Rev 2016;29:76-100. doi : 10.1016/j.smrv.2015.09.001
- Buysse DJ. Sleep health: Can we define it? Does it matter? Sleep 2014;37(1):9-17. doi : 10.5665/sleep.3298
- Lim DC, Najafi A, Afifi L et coll. The need to promote sleep health in public health agendas across the globe. Lancet Public Health 2023;8(10):e820-6. doi : 10.1016/s2468-2667(23)00182-2
- Ramar K, Malhotra RK, Carden KA et coll. Sleep is essential to health: An American Academy of Sleep Medicine position statement. J Clin Sleep Med 2021;17(10):2115-9. doi : 10.5664/jcsm.9476
- American Psychiatric Association. Manuel diagnostique et statistique des troubles mentaux (DSM-5), 5ᵉ édition. Elsevier Masson SAS, Issy-les-Moulineaux : APA, 2015.
- Didden R, Sigafoos J. A review of the nature and treatment of sleep disorders in individuals with developmental disabilities. Res Dev Disabil 2001;22(4):255-72. doi : 10.1016/s0891-4222(01)00071-3
- Chu J, Richdale AL. Sleep quality and psychological wellbeing in mothers of children with developmental disabilities. Res Dev Disabil 2009;30(6):1512-22. doi : 10.1016/j.ridd.2009.07.007
- Martin CA, Papadopoulos N, Chellew T, Rinehart NJ, Sciberras E. Associations between parenting stress, parent mental health and child sleep problems for children with ADHD and ASD: Systematic review. Res Dev Disabil 2019;93:103463. doi : 10.1016/j.ridd.2019.103463
- Esbensen AJ, Schworer EK, Hoffman EK, Wiley S. Child sleep linked to child and family functioning in children with Down syndrome. Brain Sci 2021;11(9):1170. doi : 10.3390/brainsci11091170
- Corkum P, Davidson FD, Tan-MacNeill K, Weiss SK. Sleep in Children with Neurodevelopmental Disorders: A focus on insomnia in children with ADHD and ASD. Sleep Med Clin 2014;9(2):149-68. doi : 10.1016/j.jsmc.2014.02.006
- Cuomo BM, Vaz S, Lee EAL, Thompson C, Rogerson JM, Falkmer T. Effectiveness of sleep-based interventions for children with autism spectrum disorder: A meta-synthesis. Pharmacotherapy 2017;37(5):555-78. doi : 10.1002/phar.1920
- Scantlebury A, McDaid C, Dawson V et coll. Non-pharmacological interventions for non-respiratory sleep disturbance in children with neurodisabilities: A systematic review. Dev Med Child Neurol 2018;60(11):1076-92. doi : 10.1111/dmcn.13972
- Zhou ES, Owens J. Behavioral treatments for pediatric insomnia. Curr Sleep Med Rep 2016;2(3):127-35. doi : 10.1007/s40675-016-0053-0
- Rigney G, Ali NS, Corkum PV et coll. A systematic review to explore the feasibility of a behavioural sleep intervention for insomnia in children with neurodevelopmental disorders: A transdiagnostic approach. Sleep Med Rev 2018;41:244-54. doi : 10.1016/j.smrv.2018.03.008
- Meltzer LJ, Wainer A, Engstrom E, Pepa L, Mindell JA. Seeing the whole elephant: A scoping review of behavioral treatments for pediatric insomnia. Sleep Med Rev 2021;56:101410. doi : 10.1016/j.smrv.2020.101410
- Owens JA, Dalzell V. Use of the ‘BEARS’ sleep screening tool in a pediatric residents’ continuity clinic: A pilot study. Sleep Med 2005;6(1):63-9. doi : 10.1016/j.sleep.2004.07.015
- Storfer-Isser A, Lebourgeois MK, Harsh J, Tompsett CJ, Redline S. Psychometric properties of the Adolescent Sleep Hygiene Scale. J Sleep Res 2013;22(6):707-16. doi : 10.1111/jsr.12059
- McDonald A, Joseph D. Paediatric neurodisability and sleep disorders: Clinical pathways and management strategies. BMJ Paediatr Open 2019;3(1):e000290. doi : 10.1136/bmjpo-2018-000290
- Cameli N, Beatrice A, Colacino Cinnante EM et coll. Restless sleep disorder and the role of iron in other sleep-related movement disorders and ADHD. Clin Transl Neurosci 2023;7(3):18. doi :10.3390/ctn7030018
- Dosman C, Witmans M, Zwaigenbaum L. Iron’s role in paediatric restless legs syndrome – A review. Paediatr Child Health 2012;17(4):193-7. doi : 10.1093/pch/17.4.193
- Cook G, Carter B, Wiggs L, Southam S. Parental sleep-related practices and sleep in children aged 1-3 years: A systematic review. J Sleep Res 2024;33(4):e14120. doi : 10.1111/jsr.14120
- Pattison E, Papadopoulos N, Marks D, McGillivray J, Rinehart N. Behavioural treatments for sleep problems in children with autism spectrum disorder: A review of the recent literature. Curr Psychiatry Rep 2020;22(9):46. doi : 10.1007/s11920-020-01172-1
- Papadopoulos N, Sciberras E, Hiscock H et coll. Sleeping sound autism spectrum disorder (ASD): A randomised controlled trial of a brief behavioural sleep intervention in primary school-aged autistic children. J Child Psychol Psychiatry 2022;63(11):1423-33. doi : 10.1111/jcpp.13590
- Stuttard L, Clarke S, Thomas M, Beresford B. Replacing home visits with telephone calls to support parents implementing a sleep management intervention: Findings from a pilot study and implications for future research. Child Care Health Dev 2015;41(6):1074-81. doi : 10.1111/cch.12250
- Allen SL, Howlett MD, Coulombe JA, Corkum PV. ABCs of SLEEPING: A review of the evidence behind pediatric sleep practice recommendations. Sleep Med Rev 2016;29:1-14. doi : 10.1016/j.smrv.2015.08.006
- Meltzer LJ, Williamson AA, Mindell JA. Pediatric sleep health: It matters, and so does how we define it. Sleep Med Rev 2021;57:101425. doi : 10.1016/j.smrv.2021.101425
- Gringras P, Gamble C, Jones AP et coll. Melatonin for sleep problems in children with neurodevelopmental disorders: Randomised double masked placebo controlled trial. BMJ 2012;345:e6664. doi : 10.1136/bmj.e6664
- Prochaska JO, Velicer WF. The transtheoretical model of health behavior change. Am J Health Promot 1997;12(1):38-48. doi : 10.4278/0890-1171-12.1.38
- Bischof G, Bischof A, Rumpf HJ. Motivational interviewing: An evidence-based approach for use in medical practice. Dtsch Arztebl Int 2021;118(7):109-15. doi : 10.3238/arztebl.m2021.0014
- Morgenthaler TI, Owens J, Alessi C et coll. Practice parameters for behavioral treatment of bedtime problems and night wakings in infants and young children. Sleep 2006;29(10):1277-81
- Galion AW, Farmer JG, Connolly HV et coll. A practice pathway for the treatment of night wakings in children with autism spectrum disorder. J Autism Dev Disord 2024;54(8):2926-45. doi : 10.1007/s10803-023-06026-2
- Gruber R, Carrey N, Weiss SK et coll. Position statement on pediatric sleep for psychiatrists. J Can Acad Child Adolesc Psychiatry 2014;23(3):174-95
- Williams Buckley A, Hirtz D, Oskoui M et coll. Practice guideline: Treatment for insomnia and disrupted sleep behavior in children and adolescents with autism spectrum disorder: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology 2020;94(9):392-404. doi : 10.1212/wnl.0000000000009033
- Kotagal S, Malow B, Spruyt K et coll. Melatonin use in managing insomnia in children with autism and other neurogenetic disorders – An assessment by the International Pediatric Sleep Association (IPSA). Sleep Med 2024;119:222-8. doi : 10.1016/j.sleep.2024.04.008
- Rosen CL, Aurora RN, Kapur VK et coll. Supporting American Academy of Neurology’s new clinical practice guideline on evaluation and management of insomnia in children with autism. J Clin Sleep Med 2020;16(6):989-90. doi : 10.5664/jcsm.8426
- Malow BA, Byars K, Johnson K et coll. A practice pathway for the identification, evaluation, and management of insomnia in children and adolescents with autism spectrum disorders. Pediatrics 2012;130 Suppl 2(Suppl 2):S106-24. doi : 10.1542/peds.2012-0900I
- Keogh S, Bridle C, Siriwardena NA et coll. Effectiveness of non-pharmacological interventions for insomnia in children with autism spectrum disorder: A systematic review and meta-analysis. PLoS One 2019;14(8):e0221428. doi : 10.1371/journal.pone.0221428
- Mason TBA, Pack AI. Pediatric parasomnias. Sleep 2007;30(2):141-51. doi : 10.1093/sleep/30.2.141
- Ekambaram V, Owens J. Medications used for pediatric insomnia. Psychiatr Clin North Am 2024;47(1):87-101. doi : 10.1016/j.psc.2023.06.006
- Gringras P. When to use drugs to help sleep. Arch Dis Child 2008;93(11):976-81. doi : 10.1136/adc.2007.128728
- Wilson S, Anderson K, Baldwin D et coll. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An update. J Psychopharmacol 2019;33(8):923-47. doi : 10.1177/0269881119855343
- Leung W, Singh I, McWilliams S, Stockler S, Ipsiroglu OS. Iron deficiency and sleep – A scoping review. Sleep Med Rev 2020;51:101274. doi : 10.1016/j.smrv.2020.101274
- Cruz-Sanabria F, Carmassi C, Bruno S et coll. Melatonin as a chronobiotic with sleep-promoting properties. Curr Neuropharmacol 2023;21(4):951-87. doi : 10.2174/1570159x20666220217152617
- Hirotsu C, Tufik S, Andersen ML. Interactions between sleep, stress, and metabolism: From physiological to pathological conditions. Sleep Sci 2015;8(3):143-52. doi : 10.1016/j.slsci.2015.09.002
- Rossignol DA, Frye RE. Melatonin in autism spectrum disorders: A systematic review and meta-analysis. Dev Med Child Neurol 2011;53(9):783-92. doi : 10.1111/j.1469-8749.2011.03980.x
- Gringras P, Nir T, Breddy J, Frydman-Marom A, Findling RL. Efficacy and safety of pediatric prolonged-release melatonin for insomnia in children with autism spectrum disorder. J Am Acad Child Adolesc Psychiatry 2017;56(11):948-57.e4. doi : 10.1016/j.jaac.2017.09.414
- Appleton RE, Jones AP, Gamble C et coll. The use of melatonin in children with neurodevelopmental disorders and impaired sleep: A randomised, double-blind, placebo-controlled, parallel study (MENDS). Health Technol Assess 2012;16(40):i-239. doi : 10.3310/hta16400
- Maras A, Schroder CM, Malow BA et coll. Long-term efficacy and safety of pediatric prolonged-release melatonin for insomnia in children with autism spectrum disorder. J Child Adolesc Psychopharmacol 2018;28(10):699-710. doi : 10.1089/cap.2018.0020
- Cortesi F, Giannotti F, Sebastiani T, Panunzi S, Valente D. Controlled-release melatonin, singly and combined with cognitive behavioural therapy, for persistent insomnia in children with autism spectrum disorders: A randomized placebo-controlled trial. J Sleep Res 2012;21(6):700-9. doi : 10.1111/j.1365-2869.2012.01021.x
- Malow BA, Findling RL, Schroder CM et coll. Sleep, growth, and puberty after 2 years of prolonged-release melatonin in children with autism spectrum disorder. J Am Acad Child Adolesc Psychiatry 2021;60(2):252-61.e3. doi : 10.1016/j.jaac.2019.12.007
- Hayashi M, Mishima K, Fukumizu M et coll. Melatonin treatment and adequate sleep hygiene interventions in children with autism spectrum disorder: A randomized controlled trial. J Autism Dev Disord 2022;52(6):2784-93. doi : 10.1007/s10803-021-05139-w
- Beresford B, McDaid C, Parker A et coll. Pharmacological and non-pharmacological interventions for non-respiratory sleep disturbance in children with neurodisabilities: A systematic review. Health Technol Assess 2018;22(60):1-296. doi : 10.3310/hta22600
- Parker A, Beresford B, Dawson V et coll. Oral melatonin for non-respiratory sleep disturbance in children with neurodisabilities: Systematic review and meta-analyses. Dev Med Child Neurol 2019;61(8):880-90. doi : 10.1111/dmcn.14157
- Abdelgadir IS, Gordon MA, Akobeng AK. Melatonin for the management of sleep problems in children with neurodevelopmental disorders: A systematic review and meta-analysis. Arch Dis Child 2018;103(12):1155-62. doi : 10.1136/archdischild-2017-314181
- Erland LA, Saxena PK. Melatonin natural health products and supplements: Presence of serotonin and significant variability of melatonin content. J Clin Sleep Med 2017;13(2):275-81. doi : 10.5664/jcsm.6462
- Lee SKM, Smith L, Tan ECK et coll. Melatonin use in children and adolescents: A scoping review of caregiver perspectives. Sleep Med Rev 2023;70:101808. doi : 10.1016/j.smrv.2023.101808
- Schroder CM, Malow BA, Maras A et coll. Pediatric prolonged-release melatonin for sleep in children with autism spectrum disorder: Impact on child behavior and caregiver’s quality of life. J Autism Dev Disord 2019;49(8):3218-20. doi : 10.1007/s10803-019-04046-5
- Bruni O, Angriman M, Melegari MG, Ferri R. Pharmacotherapeutic management of sleep disorders in children with neurodevelopmental disorders. Expert Opin Pharmacother 2019;20(18):2257-71. doi : 10.1080/14656566.2019.1674283
- Merenstein D, Diener-West M, Halbower AC, Krist A, Rubin HR. The trial of infant response to diphenhydramine: The TIRED study – A randomized, controlled, patient-oriented trial. Arch Pediatr Adolesc Med 2006;160(7):707-12. doi : 10.1001/archpedi.160.7.707
- Blumer JL, Findling RL, Shih WJ, Soubrane C, Reed MD. Controlled clinical trial of zolpidem for the treatment of insomnia associated with attention-deficit/hyperactivity disorder in children 6 to 17 years of age. Pediatrics 2009;123(5):e770-6. doi : 10.1542/peds.2008-2945
- Sangal RB, Blumer JL, Lankford DA, Grinnell TA, Huang H. Eszopiclone for insomnia associated with attention-deficit/hyperactivity disorder. Pediatrics 2014;134(4):e1095-103. doi : 10.1542/peds.2013-4221
- Ming X, Gordon E, Kang N, Wagner GC. Use of clonidine in children with autism spectrum disorders. Brain Dev 2008;30(7):454-60. doi : 10.1016/j.braindev.2007.12.007
- Rugino TA. Effect on primary sleep disorders when children with ADHD are administered guanfacine extended release. J Atten Disord 2018;22(1):14-24. doi : 10.1177/1087054714554932
- Hugh SC, Wolter NE, Propst EJ et coll. Infant sleep machines and hazardous sound pressure levels. Pediatrics 2014;133(4):677-81. doi : 10.1542/peds.2013-3617
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.