Document de principes
Les pratiques exemplaires pour l’évaluation et le traitement de la douleur chez les enfants
Affichage : le 4 novembre 2022
Auteur(s) principal(aux)
Evelyne D. Trottier MD, Samina Ali MD, Marie-Joëlle Doré-Bergeron MD, Laurel Chauvin-Kimoff MD; Société canadienne de pédiatrie, Comité des soins aigus, Section de la pédiatrie hospitalière, Section de la médecine d’urgence pédiatrique
Paediatr Child Health 2022 27(7):438–448. 
Résumé
L’évaluation et le traitement de la douleur sont des aspects essentiels des soins pédiatriques. L’évaluation de la douleur adaptée au développement représente une première étape importante pour en optimiser la prise en charge. L’autoévaluation de la douleur est à prioriser. Si c’est impossible, des outils appropriés d’évaluation du comportement, adaptés au développement, doivent être utilisés. Des directives et stratégies de prise en charge et de prévention de la douleur aiguë, qui combinent des approches physiques, psychologiques et pharmacologiques, doivent être accessibles dans tous les milieux de soins. Le meilleur traitement de la douleur chronique fait appel à une combinaison de modalités thérapeutiques et de counseling, dans l’objectif premier d’obtenir une amélioration fonctionnelle. La planification et la mise en œuvre de stratégies de prise en charge de la douleur chez les enfants doivent toujours être personnalisées et axées sur la famille.
Mots-clés : analgésie; douleur; évaluation; pédiatrie; traitement
La douleur chez les enfants a toujours été trop peu reconnue [1] et traitée [2], et même si des progrès ont été réalisés en matière d’évaluation et de traitement ces dernières années, il reste des lacunes entre les connaissances et la pratique. La douleur est sous-évaluée dans bien des milieux [3]; les enfants les plus jeunes [4] et les personnes qui ont des atteintes cognitives sont les plus désavantagés [5][6]. De multiples raisons sont invoquées pour expliquer le traitement sous-optimal de la douleur, y compris la difficulté à évaluer la douleur chez les enfants [7], le manque de temps et de ressources et les facteurs d’ordre éducatif, culturel et juridique [8].
La prise en charge sous-optimale de la douleur peut avoir des conséquences négatives à court et à long terme [8], y compris la progression de son intensité et de la détresse aiguë, une crainte et une douleur accrues lors des rendez-vous médicaux subséquents, l’apparition d’une douleur chronique et le futur évitement des soins [9]. En revanche, la prise en charge appropriée de la douleur est associée à une guérison plus rapide et à une moins grande utilisation des ressources de santé [10]. Le traitement de la douleur ne retarde pas le diagnostic ni la prise de décision [11][12] et il facilite souvent l’évaluation et le traitement de l’affection dont souffre l’enfant par le professionnel de la santé [9].
Le présent document de principes traite des stratégies opportunes d’évaluation et de traitement de la douleur adaptées au développement des enfants, dans le respect des soins axés sur la famille. Il complète celui que la Société canadienne de pédiatrie a publié en 2019 sur la douleur causée par une intervention douloureuse [13].
L’évaluation de la douleur
L’évaluation est une étape essentielle de la prise en charge optimale de la douleur [14]. Pour qu’elle soit appropriée, il faut établir la zone, la qualité, la durée et l’intensité de la douleur, et utiliser un outil adapté au développement (tableau 1), puis reprendre les évaluations après être intervenu pour la soulager. En cas de douleur chronique, notamment, il faut également évaluer le contexte psychosocial de l’enfant et les effets de la douleur au quotidien (p. ex., sur la famille, le sommeil, le jeu, l’école) [15].
Les échelles d’autoévaluation de la douleur
La douleur est une expérience subjective qui peut être modulée par les émotions, le développement, la culture, le contexte et les expériences de douleur antérieures [14][15]. Dans la mesure du possible, il est préférable de demander à l’enfant d’évaluer lui-même sa douleur plutôt que de demander à un substitut de le faire pour lui. Les échelles de douleur doivent être utilisées conformément aux directives, au moyen de descripteurs gradués standardisés et constants pour faciliter la comparaison.
Parmi les plus de 60 outils de mesure disponibles, les plus recommandés sont l’échelle d’évaluation numérique-11 (Numeric Rating Scale-11, NRS-11), l'échelle des visages modifiée (Faces Pain Scale-Revised, FPS-R) (figure 1) et l’échelle analogique des couleurs (Color Analogue Scale, CAS) [16]. Ces échelles sont plus efficaces pour mesurer la douleur aiguë lors d’une consultation, mais sont également utilisées en milieu postopératoire. Aucune échelle d’autoévaluation n’est largement approuvée pour évaluer la douleur chez les enfants de moins de six ans ou pour évaluer la douleur chronique dans la population pédiatrique [16][17].
L’échelle NRS-11 classe la gravité de la douleur de 0 (aucune douleur) à 10 (pire douleur possible ou imaginable). Elle peut être utilisée chez les enfants de six ans et plus qui éprouvent une douleur aiguë [16][18], de même que pour évaluer la douleur postopératoire et la douleur chronique, mais elle s’appuie alors sur moins de données probantes. Son principal avantage, c’est qu’il s’agit d’un outil verbal.
L’échelle FPS-R repose sur six images de visages, numérotées de 0 (aucune douleur) à 10 (pire douleur). Les enfants préfèrent parfois cette échelle à l’échelle NRS-11 et à l’échelle visuelle analogique (EVA) [14][15]. L’échelle FPS-R peut être utilisée chez les enfants de quatre à sept ans [14][15] pour évaluer la douleur aiguë et, selon moins de données probantes, la douleur postopératoire [16]. Elle n’est pas recommandée pour évaluer la douleur chronique.
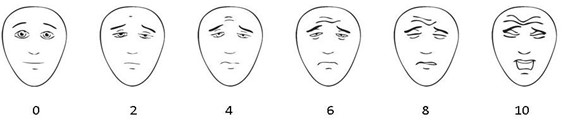
Figure 1. L’échelle des visages modifiée
Note : Consulter le site Web de l’International Association for the Study of Pain pour en savoir plus.
Avec l’échelle CAS, les enfants sont invités à déplacer un curseur pour indiquer l’intensité de leur douleur (de aucune douleur à pire douleur), qui correspond à une échelle de 0 à 10 dessinée au verso du curseur. L’échelle CAS est utilisée chez les enfants de huit ans et plus, surtout pour évaluer la douleur aiguë et, d’après moins de données probantes, la douleur postopératoire. Les données probantes qui portent sur l’utilisation de l’échelle CAS pour évaluer la douleur chronique ne sont pas concluantes [16].
Pour connaître l’intensité de la douleur chronique, il est nécessaire d’en évaluer les multiples dimensions et d’en examiner tout particulièrement les effets sur le fonctionnement global de l’enfant (p. ex., fréquentation scolaire, activités, socialisation, sommeil) [19]. Il existe plusieurs outils d’évaluation de la douleur chronique validés et faciles à obtenir, y compris le questionnaire Bath d’évaluation de la douleur chez les adolescents (Bath Adolescent Pain Questionnaire, BAPQ), l’échelle d’interférence de la douleur pédiatrique (Pediatric Pain Interference Scale, PPIS) du système d’information sur les mesures de résultats cliniques déclarés par les patients (Patient Reported Outcome Measurement Information System, PROMIS) et le questionnaire sur la douleur pédiatrique (Pediatric Pain Questionnaire, PPQ) [15]. Pour en savoir plus, voir la trousse pour les enfants handicapés du Holland Bloorview Kids Rehabilitation Hospital, en anglais [20]. L’évaluation est complète lorsqu’elle intègre des mesures du fonctionnement affectif qui déterminent l’anxiété, les symptômes dépressifs et la catastrophisation de la douleur (c’est-à-dire qu’une personne amplifie la douleur, s’y appesantit, se sent pessimiste à cet égard ou la craint), de même que des mesures de la qualité du sommeil [19].
Les mesures d’observation de la douleur
L’évaluation de signes comportementaux comme l’expression faciale, les pleurs (ou cris), l’irritabilité, l’alimentation insuffisante, les troubles du sommeil et l’inactivité peuvent contribuer à décoder le taux d’inconfort de l’enfant qui est au stade préverbal ou qui est non verbal [21]. Des fluctuations des signes vitaux peuvent être corrélées avec la douleur chez le nourrisson, mais ne constituent pas des indicateurs fiables chez les enfants plus âgés [4][21][22]. Notamment, l’absence de fluctuations des signes vitaux n’est pas indicatrice de l’absence de douleur chez l’enfant.
Lorsque l’enfant ne peut pas autoévaluer sa douleur (p. ex., en raison de son jeune âge, d’une atteinte cognitive ou d’une ventilation mécanique), une échelle ou une liste d’évaluation des comportements liés à la douleur est à privilégier [23]. Il ne faut jamais présumer que l’enfant ayant une atteinte cognitive n’est pas en mesure d’autoévaluer sa douleur [4]. Si l’ampleur de la déficience intellectuelle empêche réellement l’enfant d’autoévaluer sa douleur, il faut utiliser une échelle d’observation, conjuguée à l’évaluation d’un parent ou d’un proche. Un proche ou un professionnel de la santé peut utiliser un outil d’autoévaluation pour obtenir une évaluation estimative, mais il est conseillé de faire preuve de prudence, particulièrement lorsque l’évaluateur ne connaît pas l’enfant [23].
Seuls quelques-uns [24] des plus de 55 outils d’observation de la douleur actuellement en circulation [4][24][25] sont recommandés. Chez les nourrissons, l’échelle d’évaluation de la douleur néonatale (Neonatal Infant Pain Scale, NIPS) et l’échelle du visage, des jambes, de l’activité, des cris et de la consolabilité (Face, Legs, Activity, Cry, Consolability, FLACC) sont les plus recommandées [4], même si une récente analyse systématique indique que l’échelle EValuation ENfant DOuLeur (EVENDOL), l’échelle COMFORT et l’échelle du système de codage des expressions faciales du nouveau-né (Neonatal Facial Coding System, NFCS) sont associées à un risque de biais plus faible que les autres outils [24]. D’autres échelles peuvent également être envisagées pour évaluer la douleur du nourrisson, soit l’échelle de douleur et d’inconfort du nouveau-né (EDIN), pour déterminer la présence d’une douleur prolongée chez le nourrisson prématuré, l’échelle d’évaluation de la douleur, de l’agitation et de la sédation chez le nouveau-né (Neonatal Pain, Agitation, and Sedation Scale, N-PASS) en cas de douleur aiguë et prolongée, et le profil d’évaluation de la douleur chez le nouveau-né prématuré (Premature Infant Pain Profile, PIPP) pour mesurer la douleur causée par une intervention chez les nouveau-nés prématurés et à terme [24].
Chez les tout-petits et les enfants plus âgés, les échelles FLACC et CHEOPS (échelle d’évaluation de la douleur du Centre hospitalier pour enfants de l’est de l’Ontario, ou Children’s Hospital of Eastern Ontario Pain Scale) sont également considérées comme des outils fiables et validés [23]. Cependant, selon certaines recherches, les échelles EVENDOL, COMFORT et NFCS constituent de meilleurs choix puisqu’elles comportent un risque de biais plus faible [24].
L’échelle NIPS, de 0 à 7 points, qui contient des indicateurs physiologiques, comportementaux et contextuels, a été mise au point pour évaluer la douleur causée par une intervention chez les nouveau-nés et les nourrissons [25][26].
L’échelle NFCS fait appel à l’évaluation des indices faciaux pour mesurer la douleur aiguë, la douleur causée par une intervention ou la douleur prolongée (24). Pour en savoir plus sur l’évaluation et le traitement de la douleur chez le nouveau-né, voir le document conjoint de la Société canadienne de pédiatrie et de l’American Academy of Pediatrics [27].
L’échelle FLACC de 0 à 10 est recommandée pour évaluer la douleur postopératoire chez les enfants de deux mois à sept ans. Elle n’est pas optimale pour l’évaluation de la douleur causée par une intervention ni chez les enfants qui présentent peu de manifestations physiques ou vocales de la douleur [28][29]. Par ailleurs, pendant l’intervention, le positionnement adapté au développement peut compromettre l’évaluation par l’échelle FLACC (p. ex., l’emmaillotage limite l’évaluation de l’activité) [7][29]. Une échelle modifiée (FLACC modifiée) contient des mesures pour évaluer les enfants de quatre à 19 ans qui ont une atteinte cognitive ou sont non verbaux [4][29][30] (figure 2).
Figure 2. Les échelles FLACC et FLACC modifiée
Adapté de l’équipe Robert Debré et MC Grégoire 2008 (30), qui combine l’échelle FLACC originale (en caractères gras) et l’échelle FLACC modifiée (en italiques), et traduit du document intitulé The revised FLACC observational pain tool: improved reliability and validity for pain assessment in children with cognitive impairment, de Malviya S, Voepel-Lewis T, Burke C, Merkel S, Tait AR (Paediatr Anaesth 2006;16:258-65)
L’échelle EVENDOL, en 15 points, est validée proposés dans le texte pour les enfants de zéro à sept ans qui consultent à l’urgence et peut être utilisée pour évaluer la douleur à la consultation, la douleur prolongée et la douleur causée par une intervention [24][31] (figure 3). Elle est particulièrement utile pour les enfants qui présentent moins de manifestations physiques ou vocales de la douleur et est validée en contexte préhospitalier [32].
L’échelle CHEOPS, en 14 points, mesure la douleur postopératoire. La principale difficulté provient du fait qu’un score de 4 à 6 ne représente aucune douleur, ce qui semble contre-intuitif. De plus, selon certaines études, l’échelle CHEOPs ne convient pas pour évaluer la douleur causée par une intervention [28]. Cependant, l’échelle modifiée d’évaluation des comportements liés à la douleur (Modified Behavioral Pain Scale, MBPS), une version modifiée de l’échelle CHEOPS, est validée pour mesurer la douleur liée à la vaccination chez les enfants de deux à 22 mois, même si elle n’est pas recommandée pour d’autres interventions ou d’autres groupes d’âge [33]-[34].
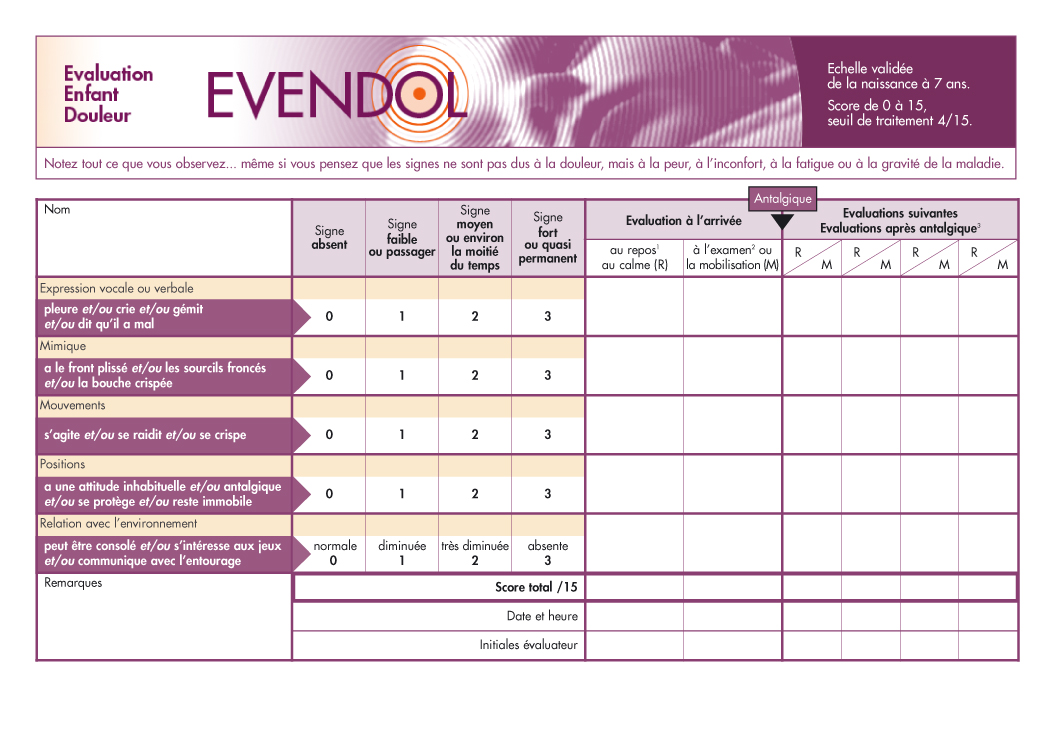
Extrait de la référence 31. Reproduction autorisée.
L’échelle COMFORT exige plus de temps, mais est validée et adaptée pour les enfants de tout âge sous ventilation mécanique [23][24][26].
Il n’existe toujours pas d’échelle d’évaluation des comportements liés à la douleur chronique validée pour les enfants [23].
Le moment des évaluations
Il est recommandé d’évaluer la douleur de l’enfant lors de la première rencontre, puis de la réévaluer régulièrement tout au long du suivi. Il est également essentiel de la réévaluer pendant chaque intervention diagnostique ou thérapeutique et après chaque geste clinique visant à soulager le patient, afin de déterminer l’efficacité du soulagement ainsi obtenu. Afin d’optimiser la comparaison, il est bon de toujours utiliser la même échelle (tableau 1) [21]. Les outils de mesure de la douleur ont le double objectif de soulager l’enfant et d’évaluer sa réponse au traitement.
Tableau 1. Les échelles d’évaluation de la douleur recommandées
*Recommandé pour les enfants de ≥7 ans par certains auteurs [16]
†Voir aussi les outils validés pour évaluer la douleur chronique
CAS échelle analogique des couleurs; CHEOPS échelle d’évaluation de la douleur du Centre hospitalier pour enfants de l’est de l’Ontario; EVENDOL Evaluation Enfant, DOuLeur; FLACC échelle du visage, des jambes, de l’activité, des cris et de la consolabilité; FPS-R échelle des visages modifiée; NFCS échelle du système de codage des expressions faciales du nouveau-né; NIPS échelle d’évaluation de la douleur néonatale; NRS-11 échelle d’évaluation numérique-11; FLACC modifiée échelle du visage, des jambes, de l’activité, des cris et de la consolabilité (modifiée) pour les enfants qui ont une atteinte cognitive
La prise en charge de la douleur aiguë
La douleur est la raison la plus fréquente de consulter en milieu de soins aigus au Canada [21]. Selon de solides données probantes, elle peut être traitée d’emblée sans nuire à la précision diagnostique [4][11][12]. En fait, le soulagement de la douleur facilite souvent l’examen, les tests, et donc le diagnostic. Les données probantes s’accumulent our appuyer de nombreuses stratégies efficaces de prise en charge de la douleur. Le traitement général de la douleur comprend des produits pharmacologiques, mais parallèlement et à importance égale, des traitements physiques et psychologiques. Dans le milieu de la santé, il doit inclure la prévention et la prise en charge de la douleur causée par une intervention. À la prévention s’ajoute l’approche des « trois P » décrite dans un document de principes antérieur de la Société canadienne de pédiatrie [13] et l’outil de douleur aiguë de Santé des enfants Canada [35].
Les directives et les protocoles de prise en charge de la douleur
L’évaluation et le traitement précoces de la douleur devraient être des aspects essentiels de toute rencontre médicale. La promotion de directives médicales lancées par les infirmières et les professionnels paramédicaux peut habiliter ces professionnels de la santé à soulager rapidement la douleur chez les enfants. Par exemple, les ordonnances collectives, grâce auxquelles il est possible d’administrer un analgésique ou d’appliquer un anesthésique topique avant une ponction veineuse en milieu de soins aigus, permettent un soulagement rapide de la douleur et peuvent améliorer l’expérience de l’enfant. L’accès aux outils de distraction dans l’attente d’une consultation médicale ou d’un traitement peut aussi améliorer l’expérience médicale globale.
Les médicaments de première ligne
Combinés aux stratégies physiques et psychologiques, les analgésiques en vente libre peuvent être utilisés en monothérapie pour soulager une douleur légère à modérée (entre 1 à 3 et 4 à 6 sur 10) ou conjointement à un autre traitement pour soulager une douleur modérée à grave (entre 4 à 6 et 7 à 10 sur 10). Les analgésiques en vente libre incluent l’acétaminophène et les anti-inflammatoires non stéroïdiens, comme l’ibuprofène (tableau 2).
L’ibuprofène est plus efficace que l’acétaminophène pour le traitement de la douleur chez les enfants [36], notamment en cas de douleur aiguë, de traumatisme musculosquelettique, de céphalée et de douleur causée par une extraction dentaire [21][37][38], et elle a un profil d’innocuité semblable [36][39]. De plus, l’ibuprofène est comparable à la morphine par voie orale pour le soulagement des entorses, des fractures simples et de la douleur causée par une intervention orthopédique mineure ou une amygdalectomie, et elle comporte un risque d’événements indésirables plus faible [40]-[43]. La combinaison d’acétaminophène et d’ibuprofène pour le traitement de la douleur causée par une extraction dentaire ou une amygdalectomie est plus efficace que l’acétaminophène utilisé seul [21].
Tableau 2. La posologie des analgésiques pour les enfants et les adolescents
Les analgésiques opioïdes
Les patients qui ressentent une douleur aiguë modérée à grave peu susceptible d’être soulagée par des stratégies physiques et psychologiques et des analgésiques de première ligne devraient se faire offrir des interventions pharmacologiques à doses croissantes. Il faut utiliser les opioïdes de manière judicieuse, bien évaluer la dose pour éviter les événements indésirables et assurer une surveillance appropriée (tableau 2). En plus de ce traitement, des analgésiques en vente libre doivent être administrés en continu en raison des effets d’épargne morphinique et pour limiter les événements indésirables [21][39][44][45]. La codéine est à éviter en tout temps chez les enfants de moins de 18 ans, conformément aux directives de Santé Canada [46][47].
En raison de la crise internationale des opioïdes, des inquiétudes ont été soulevées sur son mésusage et sur la dépendance qu’elle peut entraîner, même après une courte utilisation thérapeutique chez les jeunes [48]-[50]. Cependant, ces inquiétudes ne doivent pas en décourager l’utilisation appropriée chez les enfants et les adolescents qui éprouvent une douleur aiguë et marquée ou qui ne répondent pas aux traitements de première ligne. En milieu médical, l’administration d’opioïdes doit être la plus rapide et la moins douloureuse possible. Lorsqu’elle doit être maintenue après le congé [3], il est conseillé de ne pas prescrire plus de cinq à dix doses à administrer sur une période de deux à trois jours (50). Cette ordonnance doit être accompagnée de directives de suivi si le soulagement de la douleur est insuffisant et de conseils sur l’entreposage sécuritaire à la maison et l’élimination sécuritaire des médicaments non utilisés (retour en pharmacie) [48][51]. Voir les ressources sur la douleur du site Solutions pour la douleur chez les enfants [51].
Le fentanyl par voie intranasale est un analgésique efficace pour traiter une douleur aiguë modérée à grave chez les enfants, et son administration provoque peu de détresse [52][53]. Il est administré plus rapidement et provoque moins de douleur que par voies intraveineuse ou intramusculaire et agit plus rapidement que par voie orale. Également sécuritaire et efficace en milieu préhospitalier [54], il est privilégié en première ligne dans les urgences pédiatriques du Canada pour soulager la douleur modérée à grave [55]. Par ailleurs, cet opioïde est considéré comme un traitement initial sécuritaire et efficace lors d’épisodes vaso-occlusifs douloureux liés à l’anémie falciforme, car il réduit le délai jusqu’à la première dose d’opioïde par voie parentérale et limite le nombre d’insertions de cathéters intraveineux [56]-[58].
En milieu de soins aigus, après l’établissement d’un accès vasculaire [21], les opioïdes par voie intraveineuse sont souvent les analgésiques privilégiés, et la morphine est l’opioïde le plus utilisé [59]. Les opioïdes par voie intraveineuse et par voie intranasale doivent être surveillés de manière appropriée et titrés en fonction de l’effet voulu, en tenant toujours compte de la gravité de la douleur du patient et du fait qu’il a déjà pris ou non des opioïdes.
Les adjuvants analgésiques et les autres possibilités
De nombreux produits et de nombreuses voies d’administration sont envisagés en soins aigus. Récemment, il a été démontré qu’une faible dose de kétamine, inférieure à la dose dissociative et administrée par voie intranasale, a une efficacité comparable au fentanyl par voie intranasale pour soulager les blessures aux membres, mais qu’elle est associée à un risque d’effets indésirables plus élevé [60]-[62]. Le kétorolac par voie intraveineuse semble avoir des effets d’épargne morphinique, mais son rôle en monothérapie n’est toujours pas établi [21]. D’autres options émergent au Canada, y compris l’acétaminophène par voie intraveineuse. Une étude rétrospective a rendu compte de résultats prometteurs sur l’effet de l’acétaminophène par voie intraveineuse pour réduire la douleur causée par des épisodes vaso-occlusifs chez les enfants atteints d’anémie falciforme [63], mais d’autres études devront être réalisées sur le sujet (tableau 2).
La douleur chronique
Même si elle est courante, la douleur chronique (définie comme persistante ou récurrente depuis plus de trois mois) peut avoir d’importantes conséquences sur le plan social et économique, de même que sur la santé des enfants, des adolescents et des familles. La douleur peut découler d’une affection sous-jacente comme l’anémie falciforme ou une maladie inflammatoire de l’intestin, ou faire partie d’un trouble douloureux primaire, comme le syndrome du côlon irritable ou le syndrome de douleur régionale complexe [64]-[66]. Les céphalées et les douleurs abdominales et musculosquelettiques sont les principales formes de douleur chronique en pédiatrie [67]. La prévalence de douleur chronique se situe entre 11 % et 38 % chez les enfants [67], est généralement plus élevée chez les filles et augmente avec l’âge (sauf la douleur abdominale, qui a tendance à se manifester chez les enfants plus jeunes). Les facteurs connexes incluent une situation socioéconomique défavorisée, l’anxiété, la dépression et le peu d’estime de soi [67]. Chez les enfants, la fréquence de la douleur chronique augmente lorsque les parents ont eux-mêmes des antécédents de douleurs chroniques [68].
À cause de leurs douleurs chroniques, environ 5 % des enfants et des adolescents sont incommodés par des incapacités fonctionnelles (absentéisme scolaire et incapacité de participer à certaines activités sociales) [64][69]. La catastrophisation de la douleur [70] peut influer encore davantage sur les comportements liés à la douleur, tels que l’évitement des activités ou l’hypervigilance physique.
La douleur neuropathique peut être causée par plusieurs affections, telles qu’un traumatisme, une opération, un cancer (ou son traitement), des troubles auto-immuns (p. ex., le syndrome de Guillain-Barré) ou une maladie rare (p. ex., des maladies mitochondriales) [71][72]. Peu d’études ont été publiées sur la prise en charge de la douleur neuropathique chez les enfants, et les conseils actuels reposent largement sur l’expérience chez les adultes.
La prise en charge de la douleur chronique
La meilleure prise en charge de la douleur chronique consiste à combiner les modalités thérapeutiques, y compris les traitements psychologiques, physiques, ergothérapiques et pharmacologiques. Il est primordial d’opter pour des approches personnalisées, qui tiennent compte de la gravité des symptômes, de l’autonomie fonctionnelle, des autres problèmes de santé (y compris l’anxiété ou la dépression) et de la capacité de l’enfant et de la famille à participer activement au traitement. L’amélioration de l’autonomie fonctionnelle demeure la priorité plutôt que la réduction de la douleur en soi [70]. Dans les cas de graves incapacités fonctionnelles ou lorsque l’intensité des symptômes ne diminue pas malgré un traitement ambulatoire multimodal, il convient de diriger le patient vers un programme interdisciplinaire de traitement de la douleur chronique [69][70].
Les traitements psychologiques comprennent la psychoéducation, l’entraînement à l’autorégulation physiologique (p. ex., rétroaction biologique, hypnose), la formation aux aptitudes cognitives et la thérapie d’exposition comportementale. La participation des parents et des proches aux stratégies d’éducation sur la douleur et l’adaptation est la clé du succès [73]. La physiothérapie vise à évaluer et à traiter les atteintes musculosquelettiques secondaires et à utiliser des stratégies d’habituation à la douleur chronique fondée sur des données probantes, telles que l’exposition graduelle au mouvement, la stimulation et l’imagerie motrice progressive pour accroître la tolérance à l’activité physique et optimiser la participation. L’ergothérapie contribue à promouvoir la réadaptation sensorielle pour réduire la sensibilité aux stimuli perçus comme douloureux. Elle aide l’enfant à reprendre ses activités et ses soins personnels au quotidien [70]. La pharmacothérapie peut inclure des antidépresseurs (p. ex., l’amitriptyline) ou des antiepileptiques (p. ex., la gabapentine, la prégabaline). Aucune donnée de qualité ne traite de la pharmacothérapie de la douleur non cancéreuse chez les enfants [74]. Pour en savoir plus sur les stratégies de prise en charge de la douleur chronique, voir la trousse sur la douleur chronique de Santé des enfants Canada [35].
L’autonomisation des patients, des parents et des proches
Les soins axés sur le patient et la famille sont essentiels à la prise en charge de la douleur, et les parents, les enfants et les adolescents ont tous des rôles actifs à jouer pour traiter la douleur et planifier les soins [75]. Dans la mesure du possible, à la maison, l’enfant qui souffre d’une douleur aiguë doit l’autoévaluer, et lorsqu’un substitut doit le faire en son nom, les parents ou les proches doivent apprendre à évaluer cette douleur régulièrement au moyen d’outils adaptés à son développement [23][76]. Pour faciliter le traitement de la douleur aiguë tout autant que de la douleur chronique à la maison, la mobilisation des parents et des proches aux rencontres cliniques leur apprend et les habilite à assurer une prise en charge optimale de la douleur par la suite. Des stratégies psychologiques comme la distraction peuvent être tout aussi utiles à la maison, et des stratégies de soins physiques, comme la pose appropriée d’un pansement ou l’encouragement de l’activité physique, représentent des habiletés importantes qui peuvent être enseignées et ramenées à la maison. Il faut prescrire les analgésiques appropriés et fournir des conseils détaillés sur le meilleur moyen de prévenir la douleur et le risque d’événements indésirables. Des directives écrites claires sur la dose, la fréquence et la durée d’utilisation des médicaments doivent compléter le tout [35][77].
Recommandations
- Il est primordial de commencer par offrir de la formation sur l’utilisation des outils d’évaluation de la douleur adaptés au développement pour assurer une prise en charge optimale de la douleur en pédiatrie.
- Dans la mesure du possible, les enfants doivent autoévaluer leur douleur. Lorsque cette autoévaluation n’est pas possible ou appropriée, il faut opter pour un outil d’évaluation adapté.
- En contexte médical, il est possible d’améliorer la prise en charge de la douleur comme suit :
- Une évaluation obligatoire de la douleur lors de la première rencontre de l’enfant ou de l’adolescent
- Une réévaluation opportune (suivie d’une consignation au dossier) pendant et après chaque intervention diagnostique ou thérapeutique, selon la situation, et après chaque geste clinique visant à soulager le patient
- L’intégration des étapes d’évaluation et de traitement de la douleur aux algorithmes thérapeutiques, aux dossiers médicaux électroniques, aux directives hospitalières et aux directives régionales, provinciales et territoriales
- Les directives sur la prévention et le traitement de la douleur doivent inclure des stratégies psychologiques, physiques et pharmacologiques pour soulager la douleur aiguë et chronique. Les directives de soins et de pratiques doivent combiner des stratégies et des approches en contexte médical et à la maison.
- Lors de la prise en charge de la douleur chronique en pédiatrie, les objectifs primaires demeurent le soulagement des symptômes et une amélioration de l’autonomie fonctionnelle.
Remerciements
Les auteures remercient les docteurs Krista Baerg et Naveen Poonai qui ont révisé le présent document de principes et donné leurs commentaires avisés. Le comité de la pédiatrie communautaire et le comité de la pharmacologie et des substances dangereuses de la Société canadienne de pédiatrie l’ont également révisé.
COMITÉ DES SOINS AIGUS DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2020-2021)
Membres : Carolyn Beck MD, Kevin Chan MD (président), Kimberly Dow MD (représentante du conseil), Karen Gripp MD, Kristina Krmpotic MD, Marie-Pier Lirette MD (membre résidente), Evelyne D. Trottier MD
Représentants : Laurel Chauvin-Kimoff MD (présidente sortante 2012-2019), section de la médecine d’urgence pédiatrique de la SCP; Sidd Thakore MD, section de la pédiatrie hospitalière de la SCP
SECTION DE LA PÉDIATRIE HOSPITALIÈRE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2020-2021)
Membre du comité directeur : Melanie Buba MD (présidente désignée), Marie-Joëlle Doré-Bergeron MD (présidente sortante), Jessica Foulds MD (membre), Smita Roychoudhury (représentante des résidents), Sepideh Taheri MD (membre), Sidd Thakore MD (président), Kevin Weingarten MD (secrétaire-trésorier)
SOCIÉTÉ DE LA MÉDECINE D’URGENCE PÉDIATRIQUE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2020-2021)
Membres du comité directeur : Kevin Chan MD (président sortant), Carolyn Cashin MD (secrétaire-trésorière), Laurel Chauvin-Kimoff MD (présidente), Dayae Jeong MD (membre résidente), April Kam MD (membre), Michelle Long MD (vice-présidente), Andrea Robb MD (membre)
Références
- Bulloch B, Garcia-Filion P, Notracia D, Bryson M, McConahay T. Reliability of the color analog scale: Repeatability of scores in traumatic and nontraumatic injuries. Acad Emerg Med 2009:16(5):465-9.
- Birnie KA, Chambers CT, Fernandez CV et coll. Hospitalized children continue to report undertreated and preventable pain. Pain Res Manag 2014;19(4):198-204.
- Paquin H, Trottier ED, Robitaille N, Pastore Y, Bergeron MJ, Bailey B. Oral morphine protocol evaluation for the treatment of vaso-occlusive crisis in paediatric sickle cell patients. Paediatr Child Health 2019;24(1):e45-50.
- Drendel AL, Kelly BT, Ali S. Pain assessment for children: Overcoming challenges and optimizing care. Pediatr Emerg Care 2011;27(8):773-81.
- Malviya S, Voepel-Lewis T, Merkel S, Tait AR. Difficult pain assessment and lack of clinician knowledge are ongoing barriers to effective pain management in children with cognitive impairment. Acute Pain 2005;7(1):27-32.
- Hauer J, Houtrow AJ; section sur la médecine palliative, conseil sur les enfants ayant des incapacités. Pain assessment and treatment in children with significant impairment of the central nervous system. Pediatrics 2017;139(6):e20171002.
- Crellin DJ, Harrison D, Santamaria N, Huque H, Babl FE. The psychometric properties of the FLACC scale used to assess procedural pain. J Pain 2018;19(8):862-72.
- Brennan F, Carr DB, Cousins M. Pain management: A fundamental human right. Anesth Analg 2007;105(1):205-21.
- Ali S, McGrath T, Drendel AL. An evidence-based approach to minimizing acute procedural pain in the emergency department and beyond. Pediatr Emerg Care 2016;32(1):36-42.
- Stinson JN, McGrath P. No pain – all gain: Advocating for improved paediatric pain management. Paediatr Child Health 2007;12(2):93-4.
- Bailey B, Bergeron S, Gravel J, Bussières JF, Bensoussan A. Efficacy and impact of intravenous morphine before surgical consultation in children with right lower quadrant pain suggestive of appendicitis: A randomized controlled trial. Ann Emerg Med 2007;50(4):371-8.
- Poonai N, Paskar D, Konrad SL et coll. Opioid analgesia for acute abdominal pain in children: A systematic review and meta-analysis. Acad Emerg Med 2014;21(11):1183-92.
- Trottier ED, Bergeron MJ, Chauvin-Kimoff L, Baerg K, Ali S; Société canadienne de pédiatrie, comité des soins aigus, section de la pédiatrie hospitalière, section de la pédiatrie communautaire, section de la médecine d’urgence pédiatrique. La gestion de la douleur et de l’anxiété chez les enfants lors de brèves interventions diagnostiques et thérapeutiques. Paediatr Child Health 2019;24(8):522-35.
- Huguet A, Stinson JN, McGrath PJ. Measurement of self-reported pain intensity in children and adolescents. J Psychosom Res 2010;68(4):329-36.
- Manworren RC, Stinson J. Pediatric pain measurement, assessment, and evaluation. Semin Pediatr Neurol 2016;23(3):189-200.
- Birnie KA, Hundert AS, Lalloo C, Nguyen C, Stinson JN. Recommendations for selection of self-report pain intensity measures in children and adolescents: A systematic review and quality assessment of measurement properties. Pain 2019;160(1):5-18.
- Tomlinson D, von Baeyer CL, Stinson JN, Sung L. A systematic review of faces scales for the self-report of pain intensity in children. Pediatrics 2010;126(5):e1168-98.
- Bailey B, Daoust R, Trottier ED, Dauphin-Pierre S, Gravel J. Validation and properties of the verbal numeric scale in children with acute pain. Pain 2010;149(2):216-21.
- Palermo TM. Assessment of chronic pain in children: Current status and emerging topics. Pain Res Manag 2009;14(1):21-6.
- Kingsnorth S, Townley A, Provvidenza C et coll. Chronic Pain Assessment Toolbox for Children with Disabilities: Section 3.0; Chronic pain assessment tools. Version 2. Toronto, Ont.: Holland Bloorview Kids Rehabilitation Hospital, 2018. (consulté le 25 novembre 2021).
- Bailey B, Trottier ED. Managing pediatric pain in the emergency department. Paediatr Drugs 2016;18(4):287-301.
- Krauss BS, Calligaris L, Green SM, Barbi E. Current concepts in management of pain in children in the emergency department. Lancet 2016;387(10013):83-92.
- von Baeyer CL, Spagrud LJ. Systematic review of observational (behavioral) measures of pain for children and adolescents aged 3 to 18 years. Pain 2007;127(1-2):140-50.
- Giordano V, Edobor J, Deindl P et coll. Pain and sedation scales for neonatal and pediatric patients in a preverbal stage of development: A systematic review. JAMA Pediatr 2019;173(12):1186-97.
- Cong X, McGrath JM, Cusson RM, Zhang D. Pain assessment and measurement in neonates: An updated review. Adv Neonatal Care 2013;13(6):379-95.
- Beltramini A, Milojevic K, Pateron D. Pain assessment in newborns, infants, and children. Pediatr Ann 2017;46(10):e387-95.
- Barrington KJ, Batton DG, Finley GA, Wallman C; Société canadienne de pédiatrie, comité d’étude du fœtus et du nouveau-né. Document conjoint avec l’American Academy of Pediatrics. La prévention et la prise en charge de la douleur chez le nouveau-né : Une mise à jour. Version abrégée. Paediatr Child Health 2007;12(2):139-41.
- Crellin D, Sullivan TP, Babl FE, O’Sullivan R, Hutchinson A. Analysis of the validation of existing behavioral pain and distress scales for use in the procedural setting. Paediatr Anaesth 2007; 17(8):720-33.
- Crellin DJ, Harrison D, Santamaria N, Babl FE. Systematic review of the Face, Legs, Activity, Cry and Consolability scale for assessing pain in infants and children: Is it reliable, valid, and feasible for use? Pain 2015;156(11):2132-51.
- Équipe Robert Debré Paris et MC Grégoire. Échelle FLACC (Face Legs Activity Cry Consolability) révisée pour la personne avec handicap. Pédiadol. 2008, Paris et Canada. (consulté le 8 mars 2022).
- Fournier-Charrière E, Tourniaire B, Carbajal R et coll. EVENDOL : a new behavioral pain scale for children ages 0 to 7 years in the emergency department: Design and validation. Pain 2012;153(8):1573-82 (consulté le 8 novembre 2021).
- Beltramini A, Galinski M, Chabernaud JL et coll. Pain assessment in children younger than 8 years in out-of-hospital emergency medicine: Reliability and validity of EVENDOL score. Pediatr Emerg Care 2019;35(2):125-31.
- Taddio A, Hogan ML, Moyer P et coll. Evaluation of the reliability, validity and practicality of 3 measures of acute pain in infants undergoing immunization injections. Vaccine 2011;29(7):1390-4.
- Crellin DJ, Babl FE, Santamaria N, Harrison D. A systematic review of the psychometric properties of the Modified Behavioral Pain Scale (MBPS). J Pediatr Nurs 2018;40:14-26.
- Knowledge Exchange Network (KEN)/Children’s Healthcare Canada (CHS). Pediatric Pain, toolkits and resources.(consulté le 8 novembre 2021).
- Pierce CA, Voss B. Efficacy and safety of ibuprofen and acetaminophen in children and adults: A meta-analysis and qualitative review. Ann Pharmacother 2010;44(3):489-506.
- Le May S, Ali S, Khadra C et coll. Pain management of pediatric musculoskeletal injury in the emergency department: A systematic review. Pain Res Manag 2016;2016:4809394.
- Tan F, Braithwaite I, McKinlay C, Dalziel SR. Comparison of acetaminophen (paracetamol) with ibuprofen for treatment of fever or pain in children younger than 2 years: A systematic review and meta-analysis. JAMA Netw Open 2020;3(10):e2022398.
- Hartling L, Ali S, Dryden DM et coll. How safe are common analgesics for the treatment of acute pain for children? A systematic review. Pain Res Manag 2016;2016:5346819.
- Poonai N, Bhullar G, Lin K et coll. Oral administration of morphine versus ibuprofen to manage postfracture pain in children: A randomized trial. CMAJ 2014;186(18):1358-63.
- Poonai N, Datoo N, Ali S et coll. Oral morphine versus ibuprofen administered at home for postoperative orthopedic pain in children: A randomized controlled trial. CMAJ 2017;189(40):E1252-8.
- Le May S, Ali S, Plint AC et coll. Oral analgesics utilization for children with musculoskeletal injury (OUCH Trial): An RCT. Pediatrics 2017:140(5):e20170186.
- Kelly LE, Sommer DD, Ramakrishna J et coll. Morphine or ibuprofen for post-tonsillectomy analgesia: A randomized trial. Pediatrics 2015;135(2):307-13.
- Ferland CE, Vega E, Ingelmo PM. Acute pain management in children: Challenges and recent improvements. Curr Opin Anaesthesiol 2018;31(3):327-32.
- American College of Emergency Physicians. Optimizing the treatment of acute pain in the emergency department. 2017. (consulté le 27 octobre 2021).
- Gouvernement du Canada. Après examen, Santé Canada recommande que la codéine soit administrée seulement à deschez (sic) les patients âgés de 12 ans et plus. 2013. (consulté le 27 octobre 2021).
- Gouvernement du Canada. Rappels et avis de sécurité : Les produits analgésiques vendus sans ordonnance et contenant de la codéine ne sont pas recommandés pour les personnes de moins de 18 ans. 2020. (consulté le 27 octobre 2021).
- Ahrari M, Ali S, Hartling L et coll. Nonmedical opioid use after short-term therapeutic exposure in children: A systematic review. Pediatrics 2021;148(6):e2021051927.
- Institut pour l’utilisation sécuritaire des médicaments du Canada. Les décisions judicieuses sauvent des vies : messages clés pour les praticiens communautaires sur la prescription des opiacés. Bulletin de l’ISMP Canada 2016;16 (8). (consulté le 27 octobre 2021).
- Qualité des services de santé Ontario. Améliorer les soins grâce aux données probantes; Prescription d’opioïdes pour soulager la douleur aiguë. 2018. (consulté le 27 octobre 2021).
- Reiter E, Ali; Solutions pour la douleur chez les enfants. On vous a prescrit un opioïde? (consulté le 8 novembre 2021).
- Mudd S. Intranasal fentanyl for pain management in children: A systematic review of the literature. J Pediatr Health Care 2011;25(5):316-22.
- Murphy A, O’Sullivan R, Wakai A et coll. Intranasal fentanyl for the management of acute pain in children. Cochrane Database Syst Rev 2014(10):CD009942.
- Murphy AP, Hughes M, McCoy S, Crispino G, Wakai A, O’Sullivan R. Intranasal fentanyl for the prehospital management of acute pain in children. Eur J Emerg Med 2017;24(6):450-4.
- Fowler M, Ali S, Gouin S et coll. Knowledge, attitudes and practices of Canadian pediatric emergency physicians regarding short-term opioid use: A descriptive, cross-sectional survey. CMAJ Open 2020;8(1):E148-55.
- Kavanagh PL, Sprinz PG, Wolfgang TL et coll. Improving the management of vaso-occlusive episodes in the pediatric emergency department. Pediatrics 2015;136(4):e1016-25.
- Akinsola B, Hagbom R, Zmitrovich A et coll. Impact of intranasal fentanyl in nurse initiated protocols for sickle cell vaso-occlusive pain episodes in a pediatric emergency department. Am J Hematol 2018. doi : 10.1002/ajh.25144.
- Paquin H, Trottier ED, Pastore Y, Robitaille N, Doré-Bergeron MJ, Bailey B. Evaluation of a clinical protocol using intranasal fentanyl for treatment of vaso-occlusive crisis in sickle cell patients in the emergency department. Paediatr Child Health 2020;25(5):293-9.
- Poonai N, Zhu R. Analgesia for children in acute pain in the post-codeine era. Curr Pediatr Rev 2018;14(1):34-40.
- Graudins A, Meek R, Egerton-Warburon D, Oakley E, Seith R. The PICHFORK (Pain in Children Fentanyl or Ketamine) trial: A randomized controlled trial comparing intranasal ketamine and fentanyl for the relief of moderate to severe pain in children with limb injuries. Ann Emerg Med 2015;65(3):248-54.e1.
- Frey TM, Florin TA, Caruso M, Zhang N, Zhang Y, Mittiga MR. Effect of intranasal ketamine vs fentanyl on pain reduction for extremity injuries in children: The PRIME randomized clinical trial. JAMA Pediatr 2019;173(2):140-6.
- Reynolds SL, Bryant KK, Studnek JR et coll. Randomized controlled feasibility trial of intranasal ketamine compared to intranasal fentanyl for analgesia in children with suspected extremity fractures. Acad Emerg Med 2017;24(12):1430-40.
- Baichoo P, Asuncion A, El-Chaar G. Intravenous acetaminophen for the management of pain during vaso-occlusive crises in pediatric patients. P T 2019;44(1):5-8.
- Friedrichsdorf SJ, Giordano J, Dakoji KD, Warmuth A, Daughtry C, Schulz CA. Chronic pain in children and adolescents: Diagnosis and treatment of primary pain disorders in head, abdomen, muscles and joints. Children (Basel) 2016;3(4):42.
- Schechter NL. Functional pain: Time for a new name. JAMA Pediatr 2014;168(8): 693-4.
- Treede RD, Rief W, Barke A et coll. A classification of chronic pain for ICD-11. Pain 2015;156(6):1003-7.
- King S, Chambers CT, Huguet A et coll. The epidemiology of chronic pain in children and adolescents revisited: A systematic review. Pain 2011;152(12):2729-38.
- McKillop HN, Banez GA. A broad consideration of risk factors in pediatric chronic pain: Where to go from here? Children (Basel) 2016;3(4):38.
- Miró J, Huguet A, Nieto R. Predictive factors of chronic pediatric pain and disability: A Delphi poll. J Pain 2007;8(10):774-92.
- Harrison LE, Pate JW, Richardson PA, Ickmans K, Wicksell RK, Simons LE. Best-evidence for the rehabilitation of chronic pain. Part 1: Pediatric pain. J Clin Med 2019;8(9):1267.
- Walco GA, Dworkin RH, Krane EJ, LeBel AA, Treede RD. Neuropathic pain in children: Special considerations. Mayo Clin Proc 2010;85(3 Suppl):S33-41.
- Verriotis MA, Walker SM. Neuropathic pain in children. In: McGrath PJ, Stevens BJ, Walker SM, Zempsky WT, éd. Oxford Textbook of Paediatric Pain. Oxford, R.-U.: Oxford University Press, 2021.
- Simons LE, Basch MC. State of the art in biobehavioral approaches to the management of chronic pain in childhood. Pain Manag 2016;6(1):49-61.
- Eccleston C, Fisher E, Cooper TE et coll. Pharmacological interventions for chronic pain in children: An overview of systematic reviews. Pain 2019;160(8):1698-707.
- Whiston C, Ali S, Wright B et coll. Is caregiver refusal of analgesics a barrier to pediatric emergency pain management? A cross-sectional study in two Canadian centres. CJEM 2018;20(6):892-902.
- Drendel A. Spotlight Pain Scale. 2014. www.stoplightpainscale.com (consulté le 25 novembre 2021)
- Institut pour l’utilisation sécuritaire des médicaments du Canada. 5 questions à poser à propos de vos médicaments. 2021. (consulté le 27 octobre 2021).
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


