Document de principes
La gestion de la douleur et de l’anxiété chez les enfants lors de brèves interventions diagnostiques et thérapeutiques
Affichage : le 1 novembre 2019 | Mise à jour : le 20 mars 2025
Auteur(s) principal(aux)
Evelyne D. Trottier, Marie-Joëlle Doré-Bergeron, Laurel Chauvin-Kimoff, Krista Baerg, Samina Ali, Comité des soins aigus, Section de la pédiatrie hospitalière, Section de la pédiatrie communautaire, Section de la médecine d’urgence pédiatrique
Résumé
Les interventions médicales courantes utilisées pour évaluer et traiter les patients peuvent causer une douleur et une anxiété marquées. Les cliniciens devraient adopter une approche de base pour limiter la douleur et l’anxiété chez les enfants, notamment à l’égard des interventions diagnostiques et thérapeutiques fréquentes. Le présent document de principes est axé sur les nourrissons, les enfants et les adolescents qui subissent des interventions médicales courantes mineures, mais douloureuses. Il n’aborde pas les soins prodigués à l’unité de soins intensifs néonatale. Les auteurs examinent des stratégies simples et fondées sur des données probantes pour gérer la douleur et l’anxiété et donnent des conseils pour en faire un volet essentiel de la pratique clinique. Les professionnels de la santé sont invités à utiliser des façons de procéder peu invasives et, lorsque les interventions douloureuses sont inévitables, à combiner des stratégies simples de réduction de la douleur et de l’anxiété pour améliorer l’expérience du patient, du parent et du professionnel de la santé. Les administrateurs de la santé sont encouragés à créer des politiques pour leurs établissements, à améliorer la formation et l’accès aux lignes directrices, à créer des environnements propices aux enfants et aux adolescents, à s’assurer de la disponibilité du personnel, de l’équipement et des agents pharmacologiques appropriés et à effectuer des contrôles de qualité pour garantir une gestion de la douleur optimale.
Mots-clés : détresse; douleur; intervention; pédiatrie; traitement
HISTORIQUE
Les interventions médicales courantes utilisées pour évaluer et traiter les patients peuvent causer une douleur et une anxiété marquées, particulièrement chez les enfants[1][2]. Les canulations intraveineuses (IV), les prises de sang, les ponctions au talon, les ponctions lombaires, les cathétérismes urétraux, les réparations des plaies et l’imagerie médicale des fractures et des luxations en sont des exemples. Selon les enfants, et surtout les plus jeunes, les douleurs liées aux piqûres d’aiguille sont les pires qui leur sont imposées lorsqu’ils sont à l’hôpital[3][4]. Le traitement insuffisant de la douleur a des conséquences négatives à court et à long terme à la fois pour les enfants et pour leur famille et peut les inciter à éviter les soins médicaux[4][5].
Malgré de nombreuses stratégies exemplaires pour gérer la douleur et de multiples données probantes sur leur efficacité, on signale encore souvent des soins sous-optimaux[1][2][5]-[11]. Le manque de temps, de ressources matérielles, de personnel ou de connaissances et les préoccupations en matière de sécurité sont souvent invoqués pour expliquer le recours limité à des stratégies efficaces[1][6][9][12][13]. À la fois pour les infirmières et les médecins, l’accès à des lignes directrices synthétisées et à jour et l’appui des établissements contribueraient à l’adoption de pratiques visant à mieux gérer la douleur[6][8][13].
Le soulagement de la douleur et de l’anxiété associées aux interventions médicales mineures courantes fait partie intégrante de soins de qualité. De plus, pour que la gestion de la douleur soit efficace, il est essentiel que la famille et l’enfant puissent y jouer un rôle actif. Les professionnels de la santé sont invités à privilégier des approches peu invasives et, lorsqu’une intervention douloureuse est inévitable, à recourir à une combinaison de stratégies simples pour améliorer l’expérience du patient, du parent et du professionnel de la santé[1]. Il est souvent plus efficace de combiner des stratégies que d’en utiliser une seule, ce qui peut également favoriser la réussite de l’intervention[14]-[18]. De toute évidence, la prévention de la douleur par évitement de toute intervention inutile est la première étape vers les meilleurs soins aux enfants. C’est la première des quatre « P » des soins de la douleur. Dans le présent document de principes, il est recommandé d’associer les trois autres « P » (physiques, psychologiques et pharmacologiques) pour limiter la douleur et l’anxiété. Il faut évaluer l’efficacité de cette approche multimodale en quartre « P »[18] et la modifier en fonction des besoins, à l’aide d’outils d’évaluation de la douleur adaptés à l’âge (https://pediadol.org/evaluation et https://www.aboutkidshealth.ca/search?text=Pain/PainAssessment/MeasurementofPain/Pages/Tools-For-Measuring-Pain.&language=Fr).
Les conseils pratiques sur la gestion de la douleur et de l’anxiété, exposés dans le présent document de principes à l’intention des cliniciens, résument les données probantes à jour relatives aux aux stratégies multimodales, y compris la prévention et les interventions physiques, psychologiques et pharmacologiques[15]-[21]. Ils sont axés sur les interventions mineures. Les interventions plus invasives, telles que la circoncision[21], les affections douloureuses, la gestion de la douleur dans les unités néonatales[22], la sédation et l’analgésie IV, dépassent la portée du présent document de principes. Le document de principes complète également celui de la Société canadienne de pédiatrie (SCP) sur l’évaluation et la prise en charge de la douleur en 2022. Les cliniciens peuvent également consulter le site Web de Solutions pour la douleur chez les enfants pour consulter d’autres ressources, à https://kidsinpain.ca/fr/.
Les stratégies physiques
Une position confortable
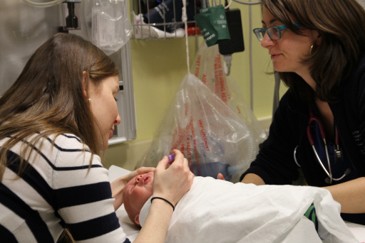
Il est démontré que la position assise, plutôt que la position couchée traditionnelle en contention sur un lit, accroît le confort de l’enfant pendant des interventions comme l’installation d’une intraveineuse ou l’administration d’un vaccin[23]-[26]. La position assise réduit l’anxiété, parce qu’elle accroît le sentiment de contrôle. Un enfant plus jeune peut s’asseoir sur les genoux de son accompagnateur (figures 1 et 2)[24]. Le fait d’étreindre l’enfant d’une manière sécuritaire et réconfortante vise à le calmer plutôt qu’à le contenir[27]. Les accompagnateurs de l’enfant peuvent également l’apaiser par des mesures de distraction et des paroles réconfortantes, tout en l’aidant à demeurer en position confortable[28]. Il faut toujours encourager la présence de membres la famille, mais aussi tenir compte de leurs préférences[1][29].
 |
 |
| Figure 1. Enfant en position assise sur les genoux de l’accompagnateur, face au phlébotomiste | Figure 2. Enfant en position assise sur les genoux de l’accompagnateur et face à celui-ci |
Les stratégies axées sur le nourrisson
L’allaitement peut être une stratégie de réconfort multimodale, car il fournit à la fois un contact peau-à-peau, le réconfort de la tétée et du bercement ainsi que (selon toute probabilité) le transfert des opiacés endogènes contenus dans le lait maternel[30]. Chez le nouveau-né, l’allaitement réduit la douleur causée par une ponction au talon ou une ponction veineuse et limite la durée des pleurs et les scores de douleur pendant la vaccination[30][31].
Le saccharose (sucrose) a fait l’objet d’études à diverses doses et diverses concentrations[9][14][32]. Lors d’interventions douloureuses (p. ex., ponction au talon, ponction veineuse, injection intramusculaire, vaccination), son utilité est clairement démontrée, tant chez le nouveau-né prématuré que chez le nouveau-né à terme[14]. Dans ce groupe d’âge, il est aussi efficace que l’allaitement pour réduire la douleur d’une piqûre d’aiguille[31]. Il peut également raccourcir la durée des pleurs chez les nourrissons âgés de un à 12 mois[33][34], mais les données sont insuffisantes pour en soutenir l’utilisation chez les enfants plus âgés[35]. La dose recommandée se situe entre 0,5 mL et 2 mL de saccharose 24 % à 33 %. Pour en maximiser l’efficacité, il faut administrer une partie de la dose deux minutes avant l’intervention, puis donner le reste pendant l’intervention (figure 3)[9][36]. Pour préparer une solution maison, il suffit de diluer 5 g de sucre (sachet utilisé dans les restaurants) dans 10 mL d’eau[37]. Le saccharose réduit d’environ 20 % le score de douleur composite et est particulièrement efficace en combinaison avec d’autres stratégies[14].
Des stratégies physiques simples, comme la tétée non nutritive (p. ex., utilisation de la suce), le bercement et l’étreinte du nourrisson, peuvent également réduire la douleur et l’anxiété[38][40]. Le contact peau-à-peau, ou technique kangourou, réduit les scores de douleur chez les nourrissons prématurés et à terme qui subissent des interventions douloureuses (figure 4)[41]. L’emmaillotage et le maintien en position fœtale sont également efficaces chez les nourrissons prématurés (figure 5)[36]. Chez les nourrissons, ces stratégies physiques simples atténuent l’expérience de la douleur, et ce, à faible coût et pratiquement sans risque. Puisqu’elles ne peuvent pas éliminer complètement la douleur causée par les interventions, il est recommandé de les combiner à la pharmacothérapie, dans la mesure du possible.
 |
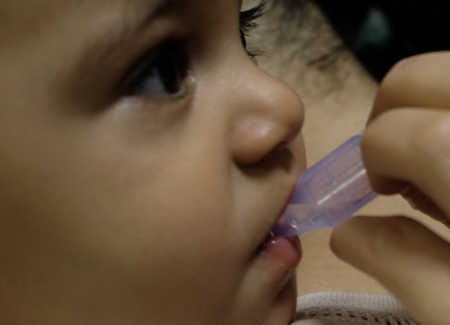 |
| Figure 3. L’administration de saccharose (sucrose) | |
 |
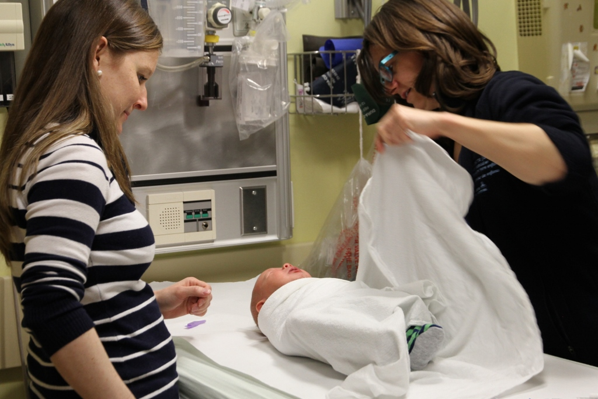 |
| Figure 4. La technique kangourou | Figure 5. L’emmaillotage |
Le choix d’approches moins douloureuses
Lorsqu’il est possible de privilégier une intervention moins douloureuse, il est recommandé d’éviter celles qui le sont davantage, telles que la ponction au talon et les injections intramusculaires[1][5]. Puisque la ponction au talon est plus douloureuse que la ponction veineuse, avec ou sans saccharose, elle est à éviter[1][5]. Lorsque la ponction veineuse exécutée par un phlébotomiste expérimenté est comparée à la ponction au talon, le nombre de sujets à traiter afin de prévenir une nouvelle ponction est de trois[42]. De plus, lorsque l’installation d’une intraveineuse et des prises de sang s’imposent, il faut les effectuer au même moment, dans la mesure du possible. La prescription automatique et systématique de prises de sang quotidiennes est à proscrire. Si ces prises de sang sont nécessaires dans des situations particulières ou critiques, il faut les limiter à une courte période et en réévaluer la nécessité tous les jours. Il est également important de les regrouper.
Les stratégies psychologiques
La préparation
Il y a un lien indéniable entre l’anxiété et la perception de la douleur[1]. En effet, la gestion de l’anxiété peut avoir des effets directs sur la perception de la douleur (voir les vidéos en médecine clinique sur la gestion de l’anxiété liée aux interventions chez les enfants, en anglais, à www.nejm.org/doi/full/10.1056/NEJMvcm1411127[43]). Les enfants qui ont un âge développemental de plus de quatre ans bénéficieront d’information simple sur ce à quoi ils doivent s’attendre. Les explications sur les étapes de l’intervention, sur ce qu’ils pourraient ressentir (p. ex., une sensation de froid et de mouillé), la vue des fournitures médicales qui seront utilisées et la proposition de choix ou de rôles réalistes liés à l’intervention contribuent à accroître le sentiment de contrôle de l’enfant[1].
Les parents ont également besoin d’être préparés à ce qui va se passer, à ce qu’ils peuvent faire pour contribuer à positionner et distraire l’enfant et à ce qu’il est préférable de dire pendant l’intervention. Il faut conseiller aux parents d’éviter des paroles de réconfort erronées ou prématurées comme « Ça ne va pas faire mal », « C’est déjà fini » ou « C’est le dernier point de suture ». Il n’est pas toujours possible de prédire la fin d’une intervention en toute fiabilité ou de garantir l’efficacité d’une analgésie. De plus, il faut éviter de dire « Je m’excuse » à un enfant dans le cadre d’interventions douloureuses, car ces paroles risquent de créer un sentiment de confusion.
Les professionnels de la santé doivent également être bien préparés avant une intervention, utiliser la bonne technique et posséder une formation et des connaissances appropriées pour l’effectuer. Ils doivent donner des explications attentives et détaillées afin d’obtenir le consentement parental le plus éclairé possible. Ils devraient déléguer les techniques invasives aux stagiaires en médecine en fonction de leur niveau de formation, et les superviser en conséquence. Des vidéos à visée pédagogique sur diverses interventions figurent à l’adresse www.nejm.org/multimedia/medical-videos[44].
La distraction
Les stratégies de distraction (p. ex., faire des bulles, lire une histoire, regarder une émission ou un jeu interactif) sont efficaces pour réduire la douleur et l’anxiété liées à diverses interventions par piqûre d’aiguille (figure 6)[23][45]-[48]. La distraction est la stratégie cognitive la plus étudiée pour soulager la douleur causée par une piqûre d’aiguille chez les enfants de deux ans ou plus[45][46]. Des données suffisantes démontrent aussi que la distraction peut être efficace pendant la réparation de lacérations[49][50].
Un milieu propice aux enfants, où il y a des jouets adaptés à leur développement, des murs colorés et des images au plafond[1][4], contribue à soulager le stress, et les images peuvent faire office de jeu « Cherche et trouve » géant pour distraire l’enfant avant et pendant une intervention effectuée en position couchée (figure 7)[51]. Les cliniciens peuvent consulter des outils Web pour créer leurs propres trousses de distraction : Prise en charge de la douleur procédurale chez les enfants et les jeunes, de SKIP : une trousse pour les professionnels de la santé[52], voir cette feuille de conseils à la page 22[53] : https://www.childrenshealthcarecanada.ca/en/networks-and-hubs/Pediatric-Pain/Prise-en-charge-de-la-douleur-proce%CC%81durale-chez-les-enfants-et-les-jeunes-Mar-2023.pdf et aussi celle-ci : Tout doux : Pour des soins en douceur.
Chez les enfants plus âgés, les stratégies de distraction les plus efficaces rendent l'enfant autonome. Il faut d’abord s’informer de leurs préférences, puis les respecter (en leur offrant une distraction active adaptée à leur âge (p. ex., jeu électronique) ou une activité plus passive (p. ex., vidéo))[54]. Une conversation avec l’enfant, sur un sujet qui n’a rien à voir avec l’intervention, contribue également à détourner son attention des stimuli douloureux[4]. Lorsque la situation le permet, l’humour peut aussi dissiper la tension. Les accompagnateurs de l’enfant peuvent contribuer aux choix et apporter des objets de la maison pour le distraire (p. ex., tablette ou téléphone intelligent, doudou ou jouet favori)[53].
 |
 |
| Figure 6. La distraction | Figure 7. Des affiches « Cherche et trouve » apposées au plafond |
La respiration profonde
La respiration profonde peut être une stratégie de relaxation[46] pour réduire la perception de la douleur. Par exemple, le professionnel de la santé peut demander à l’enfant de « prendre une grande respiration et d’expirer lentement (par le ventre) », répéter la technique avec lui, puis lui répéter les instructions pendant l’intervention. Des objets courants peuvent promouvoir la respiration profonde et distraire l’enfant, y compris un vire-vent ou des bulles (figure 8).
L’hypnose
Les techniques d’hypnose, telles que le « gant magique »[55], réduisent également la douleur et l’anxiété causées par les piqûres d’aiguille[45][46][56]. Cependant, cette technique exige une formation spécialisée et n’est peut-être pas adaptée aux milieux achalandés ou bruyants (p. ex., les services d’urgence).
La musicothérapie
La musicothérapie semble réduire l’anxiété et la douleur chez certains enfants qui subissent des interventions douloureuses réalisées dans un contexte aigu[48][57][58]. Il faudra réaliser d’autres études pour déterminer quelles interventions sont les plus bénéfiques, quels groupes d’âge sont les plus susceptibles d’en profiter et s’il est préférable de proposer la musique qu’a choisie le patient ou le musicothérapeute.
 |
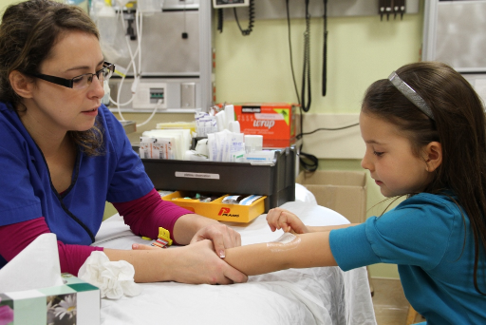 |
| Figure 8. Faire des bulles | Figure 9. L’application de crème |
Les interventions pharmacologiques
Les piqûres d’aiguille
Les crèmes anesthésiantes locales topiques sont efficaces pour les ponctions veineuses, les canulations IV, les ponctions lombaires et la vaccination (figure 9)[5][9][22][59]-[62], mais ne semblent pas l’être pour les ponctions au talon[59]. Il est démontré que la lidocaïne liposomique (Maxilene) est un anesthésique topique efficace pour les ponctions veineuses ou les canulations IV[63]-[65]. Elle raccourcit la durée des canulations IV, qui obtiennent un meilleur taux de succès dès la première tentative[66]. L’améthocaïne (Ametop) réduit la douleur avec plus d’efficacité que la lidocaïne-prilocaïne (EMLA) en cas de ponctions veineuses et de canulations, mais ces deux produits sont tous deux efficaces[67]. L’améthocaïne et les crèmes de lidocaïne liposomique ont comme principal avantage d’agir plus rapidement que la lidocaïne-prilocaïne (tableau 1)[60][63]-[72]. De plus, les cas déclarés de méthémoglobinémie chez les nourrissons à qui on avait appliqué de la crème de lidocaïne-prilocaïne semblent être principalement reliés au composant de prilocaïne, qui est absent des crèmes à action plus rapide[68]. Par ailleurs, d’après les directives du fabricant, il n’est pas nécessaire de recouvrir la lidocaïne liposomique d’un pansement occlusif. Lorsque les patients sont dans un état assez stable pour pouvoir attendre 30 minutes, il est recommandé d’appliquer de l’améthocaïne ou de la lidocaïne liposomique avant la piqûre d’aiguille, surtout si on combine cette mesure à d’autres stratégies physiques et psychologiques[16][18][20][46]. Des médicaments plus récents, tels que la crème anesthésique topique Zensa (lidocaïne 5 %), indiquent ne nécessiter qu’une durée d’application de 15 à 20 minutes pour agir, mais pour l’instant, les données probantes sont limitées.
| Tableau 1. Anesthésiques topiques à appliquer sur la peau intacte avant une piqûre d’aiguille | ||||
|
Ingrédient actif (marque de commerce) |
Anesthésique amide | Anesthésique ester |
Pentafluoropropane |
|
| Lidocaïne-prilocaïne 5 % (EMLA) |
Lidocaïne liposomique 4 % (Maxilene) |
Améthocaïne 4 % et tétracaïne (Ametop) |
Pulvérisateur de froid (Pain Ease) | |
| Début d’action | 60 minutes (analgésie dermique accrue avec une occlusion maximale de 2 heures) | 30 minutes | 30 minutes | Immédiat |
| Durée d’application |
Maximum de 4 heures chez les enfants Maximum d’1 heure chez les nourrissons de moins de 3 mois ou (zone d’application maximale de 10 cm2) |
Maximum de 2 heures (Zone d’application maximale de 100 cm2 chez les moins de 10 kg) |
Étudiée jusqu’à 60 minutes (dose maximale de 50 mg) |
Vaporiser 10 secondes ou jusqu’au blanchiment ou vaporiser sur un linge, puis appliquer sur la surface (jusqu’à concurrence de 2 fois au même endroit) |
| Durée d’efficacité après le retrait | Jusqu’à 1 à 2 heures (l’efficacité augmente jusqu’à 15 à 60 minutes après le retrait) |
Plus longue que l’EMLA (augmentation de l’efficacité jusqu’à 30 minutes après le retrait) |
3 heures | 45 à 60 secondes |
| Avantages | Aucune sensibilité croisée à l’Ametop |
Action rapide Occlusion superflue Aucune sensibilité croisée à l’Ametop |
Action rapide Supérieure à l’EMLA Aucune sensibilité croisée à la lidocaïne |
Action immédiate |
| Effets secondaires |
Vasoconstriction Méthémoglobinémie (plus élevée chez les moins d’1 an) Hypersensibilité (rare) |
Méthémoglobinémie (rare) | Hypersensibilité |
Sensation de brûlure Engelure |
| Contre-indications |
Allergie, application sur les muqueuses, une plaie ouverte ou dans les yeux, méthémoglobinémie, déficit en G6PD. Utiliser avec prudence en cas de bloc cardiaque ou de trouble hépatique grave. |
Allergie, application sur les muqueuses, une plaie ouverte ou dans les yeux. Utiliser avec prudence en cas de bloc cardiaque ou de trouble hépatique grave. |
Allergie (y compris au PABA et aux sulfamidés), application sur les muqueuses, une plaie ouverte ou dans les yeux |
Moins de 4 ans, hypersensibilité, application sur les muqueuses ou une plaie ouverte, froid à éviter chez les enfants atteints d’anémie falciforme |
|
Données tirées des références[67]-[72] |
||||
D’autres nouvelles interventions à effet immédiat, telles que les dispositifs vibratoires et de refroidissement (p. ex., Buzzy) ou l’injection sans aiguille de lidocaïne tamponnée 1 % (J-Tip) sont des options prometteuses pour soulager la douleur pendant les ponctions veineuses et les canulations IV[73]-[77] ou les ponctions lombaires[78][79]. Le J-Tip n’est pas disponible à l’heure actuelle au Canada. Le dispositif Buzzy l’est, et une analyse systématique a établi qu’il soulageait la douleur davantage que l’absence d’intervention. C’est une solution prometteuse pour remplacer les crèmes anesthésiques topiques, lorsque le moment de l’injection IV ne permet pas à l’anesthésique topique de faire effet, car c’est un moyen rapide, peu coûteux et facile à utiliser[80]-[84]. Les pulvérisateurs de froid (p. ex., Pain Ease) peuvent remplacer la crème anesthésiante. Il est démontré qu’ils réduisent la douleur pendant une canulation IV, sans pour autant rendre l’intervention plus laborieuse[87][88]. Leur principal avantage provient de leur effet immédiat, mais leur durée d’action est limitée (tableau 1). Ils peuvent provoquer un léger inconfort à l’application (sensation de froid)[85], qui en limite l’utilité chez les enfants plus jeunes, car ils ne peuvent pas comprendre la sensation ni à quoi s’attendre[1].
Chez les patients qui demeurent anxieux après une combinaison de stratégies décrites dans le présent document, des agents comme le protoxyde d’azote, dans une formulation prémélangée de 50 % de protoxyde d’azote pour 50 % d’oxygène, peuvent assurer une axiolyse (figures 10 et 11)[74][75]. Le protoxyde d’azote est facile à administrer et sécuritaire chez les enfants qui collaborent (généralement ceux de trois ans ou plus), a un effet rapide et arrête d’agir tout aussi rapidement[89]-[95]. Il est démontré que l’ajout de protoxyde d’azote à l’EMLA assure une meilleure analgésie chez les enfants que chaque stratégie utilisée seule[87][96][97], particulièrement lors de la canulation veineuse[98].
Toutefois, le protoxyde d’azote doit être réservé aux situations où les autres stratégies multimodales sont considérées comme insuffisantes, et à de courtes périodes à l’aide d’un système portable sur demande, car c’est un gaz à effet de serre (p. ex., pour des clients particuliers, tels que les enfants et les adolescents neuro-atypiques qui ont besoin d’une piqûre d’aiguille).
La sédation lors des interventions médicales, malgré son innocuité lorsqu’elle est effectuée par du personnel formé, ne doit être exécutée que par des cliniciens qui, en plus de posséder la formation nécessaire, sont accompagnés de personnel suffisant et dotés du bon équipement, ont accès aux médicaments et agents déactivateurs appropriés et peuvent recourir à un équipement de monitorage approprié. Les cliniciens peuvent également consulter le document de principes de la SCP sur la sédation lors d’une intervention.
 |
 |
| Figure 10. La distraction et le protoxyde d’azote | Figure 11. L’administration de protoxyde d’azote |
La ponction lombaire
Les crèmes anesthésiantes topiques appliquées localement (p. ex., EMLA, Maxilene) et la lidocaïne par injection ont été utilisées avec succès pour gérer la douleur causée par les ponctions lombaires[99][100] et accroître la réussite de l’intervention[101][102]. Une analyse systématique a établi que les données probantes en faveur des anesthésiques topiques étaient considérées comme incertaines chez les nouveau-nés[103]. Néanmoins, l’oligoanalgésie (traitement insuffisant de la douleur) est souvent signalée lors des ponctions lombaires chez les nourrissons et les enfants[99]-[104]. En cas de ponction lombaire non urgente, un anesthésique local topique doit d’abord être administré, suivi d’une injection de lidocaïne, pour obtenir une anesthésie plus profonde des tissus. Lorsque l’urgence ne permet pas d’appliquer la crème, on doit tout de même injecter environ 1 mL de lidocaïne 1 % tamponnée de bicarbonate (ratio de bicarbonate:lidocaïne de 1:10) sans adrénaline. On peut ajouter du saccharose par voie orale pour les nourrissons, et le protoxyde d’azote peut être utile pour les patients plus âgés (> 1 an)[105][106]. Certains enfants doivent être mis sous sédation avant l’intervention.
Le prélèvement d’urine chez le nourrisson
De nouvelles méthodes de prélèvement d’urine propre (clean catch) sont de plus en plus utilisées pour éviter la douleur causée par le cathétérisme urétral chez les enfants qui sont aux couches[107][111]. Des conseils techniques supplémentaires figurent à l’adresse suivante https://www.urgencehsj.ca/savoirs/prelevement-durine-clean-catch-chez-la-fille-inf/[112]. Des méthodes de stimulation de la vessie par tapotements légers ou application de froid, accompagnées ou non d’un massage paravertébral, ont obtenu un taux de succès élevé chez les nourrissons, le taux de contamination avoisinant les 15 %[108].
Parmi les techniques plus invasives pour prélever de l’urine stérile, soulignons le cathétérisme urétral et la ponction suspubienne. L’utilisation simultanée de gel de lidocaïne 2 % par voie topique et intra-urétrale ne semble pas améliorer systématiquement la gestion de la douleur causée par le cathétérisme urétral chez les enfants de moins de deux ans[113]-[115].
Le saccharose semble avoir un certain effet analgésique chez les nouveau-nés, mais pas toujours chez les nourrissons plus âgés[116]. Intuitivement, on peut penser que la lidocaïne est efficace pour réduire la douleur causée par le cathétérisme urétral, mais il faudra réaliser d’autres études pour en déterminer l’utilité, car elle ne semble pas être plus bénéfique que des lubrifiants non anesthésiques[113][117].
La ponction suspubienne, qui est considérée comme la norme pour prélever de l’urine stérile, semble être la méthode la plus douloureuse[118]-[120], même après l’application d’un anesthésique topique[100]. Il est démontré que les crèmes anesthésiantes topiques réduisent la douleur associée à ce type de ponction, mais puisque la plupart des nourrissons ressentent tout de même de la douleur, il est recommandé d’associer l’analgésie à d’autres stratégies avant de procéder à l’intervention[121]. On peut également effectuer une échographie ciblée avant la ponction sus-pubienne pour confirmer la présence d’urine et éviter une intervention inutile ou « à sec ».
L’insertion d’une sonde nasogastrique
Des données probantes confirment l’efficacité des solutions sucrées par voie orale afin de réduire la douleur avant l’insertion d’une sonde gastrique chez les nouveau-nés[122]. Chez les adultes, cette manœuvre est souvent effectuée en position assise, pendant que le patient boit de l’eau à la paille. Ces deux stratégies peuvent être utiles pour les enfants[123]. Les publications médicales sur les adultes recommandent également l’administration de lidocaïne topique avant l’insertion d’une sonde nasogastrique[124]-[126]. On a étudié plusieurs modes d’administration, y compris la nébulisation, l’atomisation (vaporisateur) et le gel de lidocaïne topique, seuls ou en association[124]-[126]. Chez les enfants de moins de cinq ans, la lidocaïne 2 % en nébulisation ou le vaporisateur nasal de lidocaïne-phényléphrine ne reduisaient pas la douleur ou la détresse à l'insertion du tube nasogastrique mais l'administration en nébulisation accroissait l’anxiété[127][128]. Cependant, extrapolant à partir des publications chez les adultes, certains cliniciens ont décidé d’utiliser la lidocaïne 4 % en atomisation ou un gel de lidocaïne 1 % et 2 % chez les enfants[28][125].
La réparation des lacérations
Des anesthésiques topiques comme le gel de LAT (lidocaïne 4 %, adrénaline 0,1 %, tétracaïne 0,5 %) sont recommandés pour atténuer la douleur d’une lacération mineure avant la suture de la plaie. Il faut également en envisager l’application avant l’utilisation d’un adhésif tissulaire, parce qu’il est plus facile de nettoyer, d’examiner et de fermer la plaie si la douleur est mieux gérée. Le LAT est efficace au bout de 30 minutes[1][9][129] et peut contribuer à l’hémostase de la plaie[129], mais il est contre-indiqué chez les nourrissons de moins de trois mois, sur les muqueuses et sur les plaies larges, profondes ou contaminées.
Les adhésifs tissulaires (colles) sont la solution favorisée pour remplacer les sutures afin de réparer des lacérations traumatiques simples et propres sur des surfaces non tendues[130]. Ils réduisent à la fois la douleur et la durée de l’intervention. Des bandes adhésives stériles peuvent renforcer l’effet de l’adhésif tissulaire et atténuer le taux légèrement plus élevé de déhiscence des plaies. Le résultat esthétique à court ou à long terme n’est pas différent de celui des sutures[131].
Lorsqu’il est nécessaire de suturer la plaie, il faut prioriser le fil résorbable pour éviter l’anxiété causée par le retrait des points[1][9][131]. Les résultats esthétiques et le taux d’infections liés à ce type de suture sont au moins tout aussi satisfaisants que ceux des sutures non résorbables sur des zones sans tension[1][132][133].
Lorsque le gel de LAT ne suffit pas pour gérer la douleur ou que la réparation est urgente, une infiltration locale de lidocaïne ou un bloc nerveux doit être effectué avant la suture.
Pour réduire la douleur causée par l’injection, on peut ajouter du bicarbonate à la lidocaïne, dans un rapport volumique de 1:10. On peut réchauffer la solution injectable pour qu’elle atteigne la température corporelle, et on doit l’injecter lentement, à l’aide d’une aiguille de petit calibre (27 G à 30 G)[1][134][135].
En plus d’une combinaison de stratégies de gestion de la douleur, certains enfants ont aussi besoin d’une anxiolyse à courte durée d’action ou d’une sédation pour atténuer leur anxiété et limiter leurs mouvements (p. ex., midazolam par voie intranasale[136], protoxyde d’azote[137][138]). Certaines études ont porté sur l’efficacité de la sédation par voie intranasale pour réparer des lacérations[139]-[145]. Il faudra mener d’autres études afin de déterminer les doses optimales de midazolam, de kétamine et de dexmédétomidine par voie intranasale pour limiter l’anxiété pendant diverses interventions mineures.
La radiographie en cas de présomption de fracture ou de luxation
Lorsqu’on craint une fracture ou une luxation, il faut combiner à l’analgésie, l’immobilisation et l’application de glace avant la radiographie qui, on le sait, provoque des douleurs importantes[146]. L’ibuprofène semble supérieur à l’acétaminophène pour soulager la douleur associée à des blessures musculosquelettiques; il semble équivaloir à la morphine par voie orale[147][148]. En cas de douleur modérée à grave, le fentanyl par voie intranasale semble prometteur parce qu’on peut l’administrer rapidement et qu’il agit vite (figure 12). Ce produit a fait l’objet d’études en cas de blessures chez les enfants[149][150]. Des doses de 1 mcg/kg à 2 mcg/kg sont recommandées (jusqu’à concurrence de 100 mcg). La surveillance après son utilisation doit respecter les directives sur les opioïdes par voie IV, puisque les effets systémiques sont semblables[149].
 |
| Figure 12. Fentanyl par voie intranasale en atomisation |
LES RECOMMANDATIONS POUR LES MÉDECINS
Au tableau 2 sont résumées les stratégies fondées sur des données probantes pour soulager des interventions courantes et mineures, mais douloureuses. Il faut combiner ces stratégies pour optimiser les résultats et l’expérience des soins.
LES RECOMMANDATIONS POUR LES ADMINISTRATEURS DE LA SANTÉ
L’accès à une gestion de la douleur équitable et de qualité est un droit de la personne fondamentale. Créée en 2023, la Norme sur la gestion de la douleur pédiatrique de l’Organisation des normes en santé (CAN/HSO 13200:2023) est la première norme nationale à orienter la gestion de la douleur dans le monde. Elle oriente les hôpitaux généraux ou régionaux et les hôpitaux de réadaptation à améliorer les soins de la douleur chez les enfants et les adolescents. Cette norme nationale peut servir de modèle pour s’assurer de prodiguer des soins de la douleur équitables, de qualité et centrés sur le patient aux enfants et aux adolescents dans tous les contextes.
Pour une adoption pleine et entière de stratégies de gestion de la douleur fondées sur des données probantes, il faut adopter de multiples stratégies d’application du savoir. Ces stratégies doivent être soutenues par les politiques de l’établissement et par l’éducation, l’élaboration de directives, des milieux propices à l’enfant et à la famille, du personnel formé, le leadership au sein des unités et des contrôles de la qualité[151].
Il est également essentiel de disposer des effectifs suffisants, de l’équipement approprié et des agents pharmacologiques recommandés. Lorsqu’un établissement souhaite standardiser la gestion de la douleur, des associations comme ChildKind International (http://childkindinternational.org) peuvent lui venir en aide, conjointement avec la consultation des Normes sur la gestion de la douleur pédiatrique de l’Organisation des normes en santé.
L’élaboration de politiques en matière de santé devrait refléter un engagement envers la prévention et le soulagement de la douleur dans tous les secteurs. De plus, des ordonnances collectives devraient permettre aux infirmières d’utiliser du saccharose (par exemple) dans tous les milieux cliniques[1] et d’appliquer un anesthésique topique à certains patients de l’urgence[1][5][9][60]. Solutions pour la douleur chez les enfants a créé une trousse de gestion de la douleur causée par une intervention chez les enfants et les adolescents, qui peut être consultée à https://kidsinpain.ca/fr/skip-resources.
Les patients, les personnes qui s’occupent habituellement d’eux et le personnel doivent pouvoir accéder rapidement à des ressources d’éducation sur les stratégies de gestion de la douleur. On peut trouver des feuilles sommaires pratiques et fondées sur des données probantes sur la douleur liée aux interventions, en anglais, dans le site TREKK.ca.
La dotation en personnel et la formation doivent être suffisantes pour assurer une gestion appropriée de la douleur. Un spécialiste des services éducatifs en milieu pédiatrique (child life specialist) peut aider les personnes qui s’occupent habituellement de l’enfant et les professionnels de la santé à établir des plans d’adaptation par le jeu thérapeutique et le soutien familial[1][152][153]. Lorsque les enfants ne répondent pas aux stratégies de première ligne, il faut recourir à des équipes spécialisées et envisager une sédation. Les mesures d’affectation des ressources doivent prévoir l’utilisation d’une combinaison de stratégies au sein d’un centre de soins ou d’un département à la fois, ou peut-être même de plusieurs, afin de limiter les coûts[36][53][131].
Enfin, le non-respect des interventions standards de gestion de la douleur doit être considéré comme un événement compromettant la sécurité du patient. Si les cas de douleur non traitée ou traitée de manière insuffisante étaient signalés parmi les réactions indésirables et perçus comme des problèmes de qualité, ces signalements orienteraient et favoriseraient le changement au sein des établissements.
Remerciements
Le comité de la pédiatrie communautaire et le comité de la pharmacologie et des substances dangereuses de la Société canadienne de pédiatrie ont révisé le présent document de principes. Les auteurs remercient la section de la pédiatrie de l’Association canadienne des médecins d’urgence qui l’a également révisé. Toutes les images ont été autorisées par le CHU Sainte-Justine (www.urgencehsj.ca); les parents, les professionnels de la santé et la docteure G. Larose ont consenti explicitement et par écrit à leur publication dans le présent document.
COMITÉ DES SOINS AIGUS DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres : Carolyn Beck MD, Laurel Chauvin-Kimoff MD (présidente), Kimberly Dow MD (représentante du conseil), Catherine Farrell MD (membre sortante), Evelyne D. Trottier MD, Kristina Krmpotic MD, Kyle McKenzie MD
Représentants : Kevin Chan MD, section de la médecine d’urgence en pédiatrie de la SCP; Marie-Joëlle Doré-Bergeron MD, section de la pédiatrie hospitalière de la SCP
SECTION DE LA PÉDIATRIE HOSPITALIÈRE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres du comité directeur : Marie-Joëlle Doré-Bergeron MD (présidente), Jessica Foulds MD (administratrice), Gemma Vomiero MD (administratrice), Jennifer Walton MD (présidente sortante), Kevin Weingarten MD (secrétaire-trésorier)
SECTION DE LA MÉDECINE D’URGENCE EN PÉDIATRIE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres du comité directeur : Dominic Allain MD (président sortant), Carolyn Cashin MD (secrétaire-trésorière), Kevin Chan MD (président), Laurel Chauvin-Kimoff MD (vice-présidente), Michelle Long MD (administratrice), Rachel MacIntosh MD (représentante des résidents), Laura Weingarten MD (administratrice)
SECTION DE LA PÉDIATRIE COMMUNAUTAIRE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres du comité directeur : Anierhe E. Joan Abohweyere MD (secrétaire-trésorière), Krista Baerg MD (présidente sortante), Karen Cozens MD (administratrice), Carl Cummings MD (représentant sortant du comité de la pédiatrie communautaire de la SCP), Sarah Gander MD (administratrice), Jane Gloor MD (administratrice), Jennifer O’Dea MD (administratrice), Julia Orkin MD (représentante, comité de la pédiatrie communautaire de la SCP), Liga Stare MD (présidente), Peter Wong MD (président désigné)
Mise à jour (mars 2025) par Evelyne D. Trottier MD, Marie-Joëlle Doré-Bergeron MD, Laurel Chauvin-Kimoff MD, Krista Baerg MD, Samina Ali MD
Références
- Fein JA, Zempsky WT, Cravero JP; comité de la médecine d’urgence en pédiatrie et section de l’anesthésiologie et de la médecine de la douleur; American Academy of Pediatrics. Relief of pain and anxiety in pediatric patients in emergency medical systems. Pediatrics 2012;130(5):e1391-1405.
- Stevens BJ, Abbott LK, Yamada J et coll.; CIHR Team in Children’s Pain. Epidemiology and management of painful procedures in children in Canadian hospitals. CMAJ 2011;183(7):E403-10.
- Friedrichsdorf SJ, Postier A, Eull D et coll. Pain outcomes in a US children’s hospital: A prospective cross-sectional survey. Hosp Pediatr 2015;5(1):18–26.
- Young KD. Pediatric procedural pain. Ann Emerg Med 2005;45(2):160–71.
- Ali S, McGrath T, Drendel AL. An evidence-based approach to minimizing acute procedural pain in the emergency department and beyond. Pediatr Emerg Care 2016;32(1):36–42; quiz 43–4.
- Ali S, Chambers A, Johnson DW et coll. Reported practice variation in pediatric pain management: A survey of Canadian pediatric emergency physicians. CJEM 2014;16(5):352–60.
- Trottier ED, Ali S, Le May S, Gravel J. Treating and reducing anxiety and pain in the paediatric emergency department: The TRAPPED survey. Paediatr Child Health 2015;20(5):239–44.
- Ali S, Chambers AL, Johnson DW et coll. Paediatric pain management practice and policies across Alberta emergency departments. Paediatr Child Health 2014;19(4):190–4.
- Bailey B, Trottier ED. Managing pediatric pain in the emergency department. Paediatr Drugs 2016;18(4):287–301.
- Krauss BS, Calligaris L, Green SM, Barbi E. Current concepts in management of pain in children in the emergency department. Lancet 2016;387(10013):83–92.
- Senger A, Bryce R, McMahon C, Baerg K. Cross-sectional study of pediatric pain prevalence, assessment, and treatment at a Canadian tertiary hospital. Can J Pain 2021;5(1):172-82. doi : 10.1080/24740527.2021.1961081
- Stevens BJ, Yamada J, Estabrooks CA et coll.; CIHR Team in Children’s Pain. Pain in hospitalized children: Effect of a multidimensional knowledge translation strategy on pain process and clinical outcomes. Pain 2014;155(1):60–8.
- Thomas D, Kircher J, Plint AC et coll. Pediatric pain management in the emergency department: The triage nurses’ perspective. J Emerg Nurs 2015;41(5):407–13.
- Stevens B, Yamada J, Ohlsson A, Haliburton S, Shorkey A. Sucrose for analgesia in newborn infants undergoing painful procedures. Cochrane Database Syst Rev 2016;7:CD001069.
- Leahy S, Kennedy RM, Hesselgrave J, Gurwitch K, Barkey M, Millar TF. On the front lines: Lessons learned in implementing multidisciplinary peripheral venous access pain-management programs in pediatric hospitals. Pediatrics 2008;122 Suppl 3:S161-70.
- IWKHealthcentre IHC: It Doesn’t Have to Hurt. www.youtube.com/watch?v=KgBwVSYqfps (consulté le 18 octobre 2018).
- Taddio A, Appleton M, Bortolussi R et coll. Reducing the pain of childhood vaccination: An evidence-based clinical practice guideline (summary). CMAJ 2010;182(18):1989–95.
- Friedrichsdorf SJ.; Australian Pain Society. Reducing and Eliminating Procedural Pain Related to Needles, 2014: The Four Essential (non-negotiable) Components. https://blog.apsoc.org.au/2014/08/21/reducing-and-eliminating-procedural-pain-related-toneedles-the-four-essential-non-negotiable-components/ (consulté le 18 octobre 2018).
- Organisation des normes en santé. CAN/HSO 13200:2023 – Gestion de la douleur pédiatrique. https://healthstandards.org/fr/standard/gestion-de-la-douleur-pediatrique-can-hso-13200-2023-f/ (consulté le 31 mars 2025).
- American Academy of Pediatrics; comité des aspects psychosociaux de la santé familiale; groupe de travail sur la douleur chez les nourrissons, les enfants et les adolescents. The assessment and management of acute pain in infants, children, and adolescents. Pediatrics 2001;108(3):793–7.
- Sorokan ST, Finlay JC, Jefferies AL; Société canadienne de pédiatrie, comité d’étude du fœtus et du nouveau-né, comité des maladies infectieuses et d’immunisation. La circoncision néonatale. Paediatr Child Health 2015;20(6):316–20.
- Batton DG, Barrington KJ, Wallman C; American Academy of Pediatrics, comité d’étude du fœtus et du nouveau-né, section de la chirurgie; Société canadienne de pédiatrie, comité d’étude du fœtus et du nouveau-né; Batton DG, Barrington KJ, Wallman C. La prévention et la prise en charge de la douleur chez le nouveau-né : une mise à jour. Pediatrics 2006;118(5):2231–41.
- Wente SJ. Nonpharmacologic pediatric pain management in emergency departments: A systematic review of the literature. J Emerg Nurs 2013;39(2):140–50.
- Sparks LA, Setlik J, Luhman J. Parental holding and positioning to decrease IV distress in young children: A randomized controlled trial. J Pediatr Nurs 2007;22(6):440–7.
- Lacey CM, Finkelstein M, Thygeson MV. The impact of positioning on fear during immunizations: Supine versus sitting up. J Pediatr Nurs 2008;23(3):195–200.
- Taddio A, Shah V, McMurtry CM et coll.; HELPinKids&Adults Team. Procedural and physical interventions for vaccine injections: Systematic review of randomized controlled trials and quasi-randomized controlled trials. Clin J Pain 2015;31(10 Suppl):S20-37.
- Children’s Mercy Kansas City Child Life: Comfort Positions, 2017. www.childrensmercy.org/Patients_and_Families/Support_and_Services/Child_Life/Comfort_Positions/ (consulté le 18 octobre 2018).
- TREKK (Translating Emergency Knowledge for Kids). Bottom line recommendations: Procedural Pain. 2016. https://trekk.ca/system/assets/assets/attachments/164/original/procedural-pain-blr-final-reformatted-aug-2017.pdf?1505225147 (consulté le 31 octobre 2019).
- Ali S, Weingarten LE, Kircher J et coll. A survey of caregiver perspectives on children’s pain management in the emergency department. CJEM 2016;18(2):98–105.
- Harrison D, Reszel J, Bueno M et coll. Breastfeeding for procedural pain in infants beyond the neonatal period. Cochrane Database Syst Rev 2016;10:CD011248.
- Shah PS, Torgalkar R, Shah VS. Breastfeeding or breast milk for procedural pain in neonates. Cochrane Database Syst Rev 2023;8(8):CD004950. doi : 10.1002/14651858.CD004950.pub4
- Taddio A, Yiu A, Smith RW, Katz J, McNair C, Shah V. Variability in clinical practice guidelines for sweetening agents in newborn infants undergoing painful procedures. Clin J Pain 2009;25(2):153–5.
- Kassab M, Foster JP, Foureur M, Fowler C. Sweet-tasting solutions for needle-related procedural pain in infants one month to one year of age. Cochrane Database Syst Rev 2012;12:CD008411.
- Gouin S, Gaucher N, Lebel D, Desjardins MP. A randomized double-blind trial comparing the effect on pain of an oral sucrose solution vs. placebo in children 1 to 3 months old undergoing simple venipuncture. J Emerg Med 2018;54(1):33–9.
- Harrison D, Yamada J, Adams-Webber T, Ohlsson A, Beyene J, Stevens B. Sweet tasting solutions for reduction of needle-related procedural pain in children aged one to 16 years. Cochrane Database Syst Rev 2015;5:CD008408.
- Urgence CHU Sainte-Justine. Sucrose 0-6 mois. Révisé janvier 2020. https://www.urgencehsj.ca/protocoles/sucrose-0-12-mois (consulté le 31 mars 2025)
- Immunisation Canada. Gestion de la douleur lors de la vaccination (pour cliniciens). 2015. https://immunize.ca/fr/gestion-de-la-douleur-vaccination-cliniciens (consulté le 18 octobre 2018).
- Pillai Riddell RR, Racine NM, Gennis HG et coll. Non-pharmacological management of infant and young child procedural pain. Cochrane Database Syst Rev 2015;12:CD006275.
- Pillai Riddell RR, Bucsea O, Shiff I et coll. Non-pharmacological management of infant and young child procedural pain. Cochrane Database Syst Rev 2023;6(6):CD006275. doi : 10.1002/14651858.CD006275.pub4
- Harrison D, Bueno M. Translating evidence: Pain treatment in newborns, infants, and toddlers during needle-related procedures. Pain Rep. 16 février 2023;8(2):e1064. doi : 10.1097/PR9.0000000000001064
- Johnston C, Campbell-Yeo M, Disher T et coll. Skin-to-skin care for procedural pain in neonates. Cochrane Database Syst Rev 2017;2:CD008435.
- Shah VS, Ohlsson A. Venepuncture versus heel lance for blood sampling in term neonates. Cochrane Database Syst Rev 2011;10:CD001452.
- Krauss BS, Krauss BA, Green SM. Videos in clinical medicine. Managing procedural anxiety in children. N Engl J Med 2016;374(16):e19. www.nejm.org/doi/full/10.1056/NEJMvcm1411127 (consulté le 18 octobre 2018).
- New England Journal of Medicine. Browse Figures and Multimedia. www.nejm.org/multimedia/medical-videos (consulté le 18 octobre 2018).
- Uman LS, Birnie KA, Noel M et coll. Psychological interventions for needle-related procedural pain and distress in children and adolescents. Cochrane Database Syst Rev 2013;10:CD005179.
- Birnie KA, Noel M, Chambers CT, Uman LS, Parker JA. Psychological interventions for needle-related procedural pain and distress in children and adolescents. Cochrane Database Syst Rev 2018;10:CD005179.
- Chambers CT, Taddio A, Uman LS, McMurtry CM, HELPinKIDS Team. Psychological interventions for reducing pain and distress during routine childhood immunizations: A systematic review. Clin Ther 2009;31 Suppl 2:S77-S103.
- Klassen JA, Liang Y, Tjosvold L, Klassen TP, Hartling L. Music for pain and anxiety in children undergoing medical procedures: A systematic review of randomized controlled trials. Ambul Pediatr 2008;8(2):117–28.
- Sinha M, Christopher NC, Fenn R, Reeves L. Evaluation of nonpharmacologic methods of pain and anxiety management for laceration repair in the pediatric emergency department. Pediatrics 2006;117(4):1162–8.
- Ha YO, Kim HS. The effects of audiovisual distraction on children’s pain during laceration repair. Int J Nurs Pract 2013;19 Suppl 3:20–7.
- Équipe analgésie à l’urgence, CHU Sainte-Justine. Procédures mineures sans blessure : Eau. 2016. www.urgencehsj.ca/protocoles/analgesie-procedures-mineures/ (consulté le 18 octobre 2018).
- Solutions pour la douleur chez les enfants (SKIP), Santé des enfants Canada, Agence de la santé publique du Canada. Prise en charge de la douleur procédurale chez les enfants et les jeunes : trousse d’outils pour le personnel de la santé. Mars 2024. https://www.childrenshealthcarecanada.ca/en/networks-and-hubs/Pediatric-Pain/Prise-en-charge-de-la-douleur-proce%CC%81durale-chez-les-enfants-et-les-jeunes-Mar-2023.pdf (consulté le 1er avril 2024).
- Association canadienne des centres de santé pédiatriques (ACCSP). Coping Strategies for Painful Procedures. https://www.childrenshealthcarecanada.ca/en/networks-and-hubs/Pediatric-Pain/FINAL_Tip-Sheet---Coping-Strategies-for-Painful-Procedures.pdf (consulté le 1ᵉʳ avril 2024).
- Koller D, Goldman RD. Distraction techniques for children undergoing procedures: A critical review of pediatric research. J Pediatr Nurs 2012;27(6):652–81.
- Kuttner L. Pediatric hypnosis: Pre-, peri-, and post-anesthesia. Paediatr Anaesth 2012;22(6):573–7.
- Geagea D, Tyack Z, Kimble R et coll. Clinical hypnosis for procedural pain and distress in children: A scoping review. Pain Med 2023;24(6):661-702. doi : 10.1093/pm/pnac186
- Yinger OS, Gooding LF. A systematic review of music-based interventions for procedural support. J Music Ther 2015;52(1):1–77.
- Goren K, Cen Y, Montemurri V et coll. The impact of music, play, and pet therapies in managing pain and anxiety in paediatric patients in hospital: A rapid systematic review. Paediatr Child Health 2023;28(4):218-24. doi : 10.1093/pch/pxad010
- Foster JP, Taylor C, Spence K. Topical anaesthesia for needle-related pain in newborn infants. Cochrane Database Syst Rev 2017;2:CD010331.
- Rogers TL, Ostrow CL. The use of EMLA cream to decrease venipuncture pain in children. J Pediatr Nurs 2004;19(1):33–9.
- Shah V, Taddio A, McMurtry CM et coll.; HELPinKIDS Team. Pharmacological and combined interventions to reduce vaccine injection pain in children and adults: Systematic review and meta-analysis. Clin J Pain 2015;31(10 Suppl):S38-63.
- Le May S, Wu W, Francoeur M et coll. Topical anesthetics for needle-related pain in adults and children (TOPIC): A mini-review. Front Pain Res 2024;4:1350578. doi : 10.3389/fpain.2023.1350578
- Poonai N, Alawi K, Rieder M, Lynch T, Lim R. A comparison of amethocaine and liposomal lidocaine cream as a pain reliever before venipuncture in children: A randomized control trial. Pediatr Emerg Care 2012;28(2):104–8.
- Koh JL, Harrison D, Myers R, Dembinski R, Turner H, McGraw T. A randomized, double-blind comparison study of EMLA and ELA-max for topical anesthesia in children undergoing intravenous insertion. Paediatr Anaesth 2004;14(12):977–82.
- Eichenfield LF, Funk A, Fallon-Friedlander S, Cunningham BB. A clinical study to evaluate the efficacy of ELA-max (4% liposomal lidocaine) as compared with eutectic mixture of local anesthetics cream for pain reduction of venipuncture in children. Pediatrics 2002;109(6):1093–9.
- Taddio A, Soin HK, Schuh S, Koren G, Scolnik D. Liposomal lidocaine to improve procedural success rates and reduce procedural pain among children: A randomized controlled trial. CMAJ 2005;172(13):1691–5.
- Lander JA, Weltman BJ, So SS. EMLA and amethocaine for reduction of children’s pain associated with needle insertion. Cochrane Database Syst Rev 2006;3:CD004236.
- Friedman PM, Mafong EA, Friedman ES, Geronemus RG. Topical anesthetics update: EMLA and beyond. Dermatol Surg 2001;27(12):1019–26.
- Kumar M, Chawla R, Goyal M. Topical anesthesia. J Anaesthesiol Clin Pharmacol 2015;31(4):450–6.
- Yip A, Soin H, Taddio A. Review of a new topical anesthetic, liposomal lidocaine, for procedural pain in children. Can J Hosp Pharmacy 2005;58(3):148–50.
- O’Brien L, Taddio A, Lyszkiewicz DA, Koren G. A critical review of the topical local anesthetic amethocaine (Ametop) for pediatric pain. Paediatr Drugs 2005;7(1):45–54.
- Centre hospitalier pour enfants de l’est de l’Ontario. Medical Directive no. 2051. Application of Topical Anesthetics prior to Painful Procedures. 2018. www.cheo.on.ca/uploads/Physican/2051-CorporateDirective-TopicalAnesthetics-2018Renewal.pdf (consulté le 16 novembre 2018).
- Baxter AL, Cohen LL, McElvery HL, Lawson ML, von Baeyer CL. An integration of vibration and cold relieves venipuncture pain in a pediatric emergency department. Pediatr Emerg Care 2011;27(12):1151–6.
- Lunoe MM, Drendel AL, Levas MN et coll. A randomized clinical trial of jet-injected lidocaine to reduce venipuncture pain for young children. Ann Emerg Med 2015;66(5):466–74.
- Spanos S, Booth R, Koenig H, Sikes K, Gracely E, Kim IK. Jet Injection of 1% buffered lidocaine versus topical ELA-max for anesthesia before peripheral intravenous catheterization in children: A randomized controlled trial. Pediatr Emerg Care 2008;24(8):511–5.
- Auerbach M, Tunik M, Mojica M. A randomized, double-blind controlled study of jet lidocaine compared to jet placebo for pain relief in children undergoing needle insertion in the emergency department. Acad Emerg Med 2009;16(5):388–93.
- Lunoe MM, Drendel AL, Brousseau DC. The use of the needle-free jet injection system with buffered lidocaine device does not change intravenous placement success in children in the emergency department. Acad Emerg Med 2015;22(4):447–51.
- Ferayorni A, Yniguez R, Bryson M, Bulloch B. Needle-free jet injection of lidocaine for local anesthesia during lumbar puncture: A randomized controlled trial. Pediatr Emerg Care 2012;28(7):687–90.
- Caltagirone R, Raghavan VR, Adelgais K, Roosevelt GE. A randomized double blind trial of needle-free injected lidocaine versus topical anesthesia for infant lumbar puncture. Acad Emerg Med 2018;25(3):310–6.
- Ballard A, Khadra C, Fortin O et coll. Cold and vibration for children undergoing needle-related procedures: A non-inferiority randomized clinical trial. Paediatr Neonatal Pain 2024;6(4):164-73. doi: 10.1002/pne2.12125
- Haidar NA, Al Amri MH, Sendad NG, Toaimah FHS. Efficacy of Buzzy device versus EMLA cream for reducing pain during needle-related procedures in children: A randomized controlled trial. Pediatr Emerg Care 2024;40(3):180-6. doi : 10.1097/PEC.0000000000002965
- Lescop K, Joret I, Delbos P et coll. The effectiveness of the BuzzyⓇ device to reduce or prevent pain in children undergoing needle-related procedures: The results from a prospective, open-label, randomised, non-inferiority study. Int J Nurs Stud 2021;113:103803. doi : 10.1016/j.ijnurstu.2020.103803
- Potts DA, Davis KF, Elci OU, Fein JA. A vibrating cold device to reduce pain in the pediatric emergency department: A randomized clinical trial. Pediatr Emerg Care 2019;35(6):419-25. doi : 10.1097/PEC.0000000000001041
- Ballard A, Khadra C, Adler S, Trottier ED, Le May S. Efficacy of the Buzzy device for pain management during needle-related procedures: A systematic review and meta-analysis. Clin J Pain 2019;35(6):532-43. doi : 10.1097/AJP.0000000000000690
- Griffith RJ, Jordan V, Herd D, Reed PW, Dalziel SR. Vapocoolants (cold spray) for pain treatment during intravenous cannulation. Cochrane Database Syst Rev 2016;4:CD009484.
- Zhu Y, Peng X, Wang S et coll. Vapocoolant spray versus placebo spray/no treatment for reducing pain from intravenous cannulation: A meta-analysis of randomized controlled trials. Am J Emerg Med 2018;36(11):2085–92.
- Hee HI, Goy RW, Ng AS. Effective reduction of anxiety and pain during venous cannulation in children: A comparison of analgesic efficacy conferred by nitrous oxide, EMLA and combination. Paediatr Anaesth 2003;13(3):210–6.
- Pedersen RS, Bayat A, Steen NP, Jacobsson ML. Nitrous oxide provides safe and effective analgesia for minor paediatric procedures—A systematic review. Dan Med J 2013;60(6):A4627.
- Roback MG, Carlson DW, Babl FE, Kennedy RM. Update on pharmacological management of procedural sedation for children. Curr Opin Anaesthesiol 2016;29 Suppl 1:S21-35.
- Tobias JD. Applications of nitrous oxide for procedural sedation in the pediatric population. Pediatr Emerg Care 2013;29(2):245–65.
- Tsze DS, Mallory MD, Cravero JP. Practice patterns and adverse events of nitrous oxide sedation and analgesia: A report from the Pediatric Sedation Research Consortium. J Pediatr 2016;169:260–5.e262.
- Trottier ED, Fabrizi A, Vincent M. La sédation procédurale en salle d’urgence : Particularités pédiatriques et gériatriques. Médecin du Québec 2017;7:article 2.
- Zier JL, Liu M. Safety of high-concentration nitrous oxide by nasal mask for pediatric procedural sedation: Experience with 7802 cases. Pediatr Emerg Care 2011;27(12):1107–12.
- Veger ML, van Iterson J, Bakx R, Ridderikhof ML. The role of nitrous oxide in minor pediatric procedures in the emergency department: A systematic review. J Pediatr Surg 2024;59(6):1154-62. doi : 10.1016/j.jpedsurg.2023.12.026
- Poonai N, Creene C, Dobrowlanski A et coll. Inhaled nitrous oxide for painful procedures in children and youth: A systematic review and meta-analysis. CJEM 2023;25(6):508-28. doi : 10.1007/s43678-023-00507-0.
- Mjahed K, Sadraoui A, Benslama A, Idali B, Benaguida M. Association crème Emla et protoxyde d’azote pour l’abord veineux chez l’enfant. Ann Fr Anesth Reanim 1997;16(5):488–91.
- Taddio A, McMurtry CM, Shah V et coll.; HELPinKids&Adults. Reducing pain during vaccine injections: Clinical practice guideline. CMAJ 2015;187(13):975–82.
- Ekbom K, Jakobsson J, Marcus C. Nitrous oxide inhalation is a safe and effective way to facilitate procedures in paediatric outpatient departments. Arch Dis Child 2005;90(10):1073–6.
- Gorchynski J, McLaughlin T. The routine utilization of procedural pain management for pediatric lumbar punctures: Are we there yet? J Clin Med Res 2011;3(4):164–7.
- Breakey VR, Pirie J, Goldman RD. Pediatric and emergency medicine residents’ attitudes and practices for analgesia and sedation during lumbar puncture in pediatric patients. Pediatrics 2007; 119(3):e631-6.
- Baxter AL, Fisher RG, Burke BL, Goldblatt SS, Isaacman DJ, Lawson ML. Local anesthetic and stylet styles: Factors associated with resident lumbar puncture success. Pediatrics 2006;117(3):876–81.
- Goldman RD. Analgesia for lumbar puncture in infants and children. Can Fam Physician 2019;65(3):192-4.
- Pessano S, Romantsik O, Olsson E, Hedayati E, Bruschettini M. Pharmacological interventions for the management of pain and discomfort during lumbar puncture in newborn infants. Cochrane Database Syst Rev 2023;9(9):CD015594. doi : 10.1002/14651858.CD015594.pub2
- Fein D, Avner JR, Khine H. Pattern of pain management during lumbar puncture in children. Pediatr Emerg Care 2010;26(5):357–60.
- Germán M, Pavo MR, Palacios A, Ordoñez O. Use of fixed 50% nitrous oxide-oxygen mixture for lumbar punctures in pediatric patients. Pediatr Emerg Care 2011;27(3):244–5.
- Livingston M, Lawell M, McAllister N. Successful use of nitrous oxide during lumbar punctures: A call for nitrous oxide in pediatric oncology clinics. Pediatr Blood Cancer 2017;64(11):e26610.
- Herreros ML, Tagarro A, García-Pose A, Sánchez A, Cañete A, Gili P. Accuracy of a new clean-catch technique for diagnosis of urinary tract infection in infants younger than 90 days of age. Paediatr Child Health 2015;20(6):e30-2.
- Labrosse M, Levy A, Autmizguine J, Gravel J. Evaluation of a new strategy for cleancatch urine in infants. Pediatrics 2016;138(3):pii.e20160573.
- Lennon R, Krishnamohan A, Fitzpatrick L, Gillett M. CATCH IT: The Effect of bladder ultrasound in decreasing the time to collect a clean-catch urine sample in the nontoilet-trained child: A randomized control trial. Pediatr Emerg Care 2024;40(2):98-102. doi : 10.1097/PEC.0000000000002937
- Weill O, Labrosse M, Levy A, Desjardins MP, Trottier ED, Gravel J. Point-of-care ultrasound before attempting clean-catch urine collection in infants: A randomized controlled trial. CJEM 2019;21(5):646-52. doi : 10.1017/cem.2019.30
- Kaufman J, Fitzpatrick P, Tosif S et coll. Faster clean catch urine collection (Quick-Wee method) from infants: Randomised controlled trial. BMJ 2017;357:j1341.
- Urgence CHU Sainte Justine. Prélèvement d’urine par clean catch chez la fille (MD). https://www.urgencehsj.ca/savoirs/prelevement-durine-clean-catch-chez-la-fille-inf (consulté en janvier 2025).
- Poonai N, Li J, Langford C et coll. Intraurethral lidocaine for urethral catheterization in children: A randomized controlled trial. Pediatrics 2015;136(4):e879-86.
- Mularoni PP, Cohen LL, DeGuzman M, Mennuti-Washburn J, Greenwald M, Simon HK. A randomized clinical trial of lidocaine gel for reducing infant distress during urethral catheterization. Pediatr Emerg Care 2009;25(7):439–43.
- Vaughan M, Paton EA, Bush A, Pershad J. Does lidocaine gel alleviate the pain of bladder catheterization in young children? A randomized, controlled trial. Pediatrics 2005;116(4):917–20.
- Rogers AJ, Greenwald MH, Deguzman MA, Kelley ME, Simon HK. A randomized, controlled trial of sucrose analgesia in infants younger than 90 days of age who require bladder catheterization in the pediatric emergency department. Acad Emerg Med 2006;13(6):617–22.
- Chua ME, Firaza PNB, Ming JM, Silangcruz JMA, Braga LH, Lorenzo AJ. Lidocaine gel for urethral catheterization in children: A meta-analysis. J Pediatr 2017;190:207–214.e1.
- Kozer E, Rosenbloom E, Goldman D, Lavy G, Rosenfeld N, Goldman M. Pain in infants who are younger than 2 months during suprapubic aspiration and transurethral bladder catheterization: A randomized, controlled study. Pediatrics 2006;118(1):e51-6.
- Badiee Z, Sadeghnia A, Zarean N. Suprapubic bladder aspiration or urethral catheterization: Which is more painful in uncircumcised male newborns? Int J Prev Med 2014;5(9):1125–30.
- El-Naggar W, Yiu A, Mohamed A et coll. Comparison of pain during two methods of urine collection in preterm infants. Pediatrics 2010;125(6):1224–9.
- Nahum Y, Tenenbaum A, Isaiah W, Levy-Khademi F. Effect of eutectic mixture of local anesthetics (EMLA) for pain relief during suprapubic aspiration in young infants: A randomized, controlled trial. Clin J Pain 2007;23(9):756–9.
- Chen S, Zhang Q, Xie RH, Wen SW, Harrison D. What is the best pain management during gastric tube insertion for infants aged 0–12 months: A systematic review. J Pediatr Nurs 2017;34:78–83.
- Menezes C, Breen-Reid K. Sonde nasogastrique (NG): Comment mettre en place une sonde NG chez un enfant. 2017. www.aboutkidshealth.ca/Article?contentid=984&language=French (consulté le 18 octobre 2018).
- Lor YC, Shih PC, Chen HH et coll. The application of lidocaine to alleviate the discomfort of nasogastric tube insertion: A systematic review and meta-analysis. Medicine (Baltimore) 2018;97(5):e9746.
- Farrington M, Bruene D, Wagner M. Pain management prior to nasogastric tube placement: Atomized lidocaine. ORL Head Neck Nurs 2015;33(1):8–16.
- Kuo YW, Yen M, Fetzer S, Lee JD. Reducing the pain of nasogastric tube intubation with nebulized and atomized lidocaine: A systematic review and meta-analysis. J Pain Symptom Manage 2010;40(4):613–20.
- Babl FE, Goldfinch C, Mandrawa C, Crellin D, O’Sullivan R, Donath S. Does nebulized lidocaine reduce the pain and distress of nasogastric tube insertion in young children? A randomized, double-blind, placebo-controlled trial. Pediatrics 2009;123(6):1548–55.
- Craig SS, Seith RW, Cheek JA et coll. Lidocaine and phenylephrine versus saline placebo nasal spray for the pain and distress of nasogastric tube insertion in young children and infants: A randomised, double-blind, controlled trial. Lancet Child Adolesc Health 2019;3(6):391-7. doi : 10.1016/S2352-4642(19)30058-6
- Harman S, Zemek R, Duncan MJ, Ying Y, Petrcich W. Efficacy of pain control with topical lidocaine-epinephrine-tetracaine during laceration repair with tissue adhesive in children: A randomized controlled trial. CMAJ 2013;185(13):E629-34.
- Farion KJ, Osmond MH, Hartling L et coll. Tissue adhesives for traumatic lacerations: A systematic review of randomized controlled trials. Acad Emerg Med 2003;10(2):110–8.
- Urgence CHU Sainte-Justine. Lacération. (consulté le 1ᵉʳ avril 2025).
- Al-Abdullah T, Plint AC, Fergusson D. Absorbable versus nonabsorbable sutures in the management of traumatic lacerations and surgical wounds: A meta-analysis. Pediatr Emerg Care 2007;23(5):339–44.
- Karounis H, Gouin S, Eisman H, Chalut D, Pelletier H, Williams B. A randomized, controlled trial comparing long-term cosmetic outcomes of traumatic pediatric lacerations repaired with absorbable plain gut versus nonabsorbable nylon sutures. Acad Emerg Med 2004;11(7):730–5.
- Cepeda MS, Tzortzopoulou A, Thackrey M, Hudcova J, Arora Gandhi P, Schumann R. Adjusting the pH of lidocaine for reducing pain on injection. Cochrane Database Syst Rev 2010;12:CD006581.
- Frank SG, Lalonde DH. How acidic is the lidocaine we are injecting, and how much bicarbonate should we add? Can J Plast Surg 2012;20(2):71–3.
- Rech MA, Barbas B, Chaney W, Greenhalgh E, Turck C. When to pick the nose: Out-of-hospital and emergency department intranasal administration of medications. Ann Emerg Med 2017;70(2):203–11.
- Siu A, Tran NA, Ali S et coll. Pharmacologic procedural distress management during laceration repair in children: A systematic review. Pediatr Emerg Care 2024;40(2):88-97. doi : 10.1097/PEC.0000000000003020
- Poonai N, Creene C, Dobrowlanski A et coll. Inhaled nitrous oxide for painful procedures in children and youth: A systematic review and meta-analysis. CJEM 2023;25(6):508-28. doi : 10.1007/s43678-023-00507-0
- Miller JL, Capino AC, Thomas A, Couloures K, Johnson PN. Sedation and analgesia using medications delivered via the extravascular route in children undergoing laceration repair. J Pediatr Pharmacol Ther 2018;23(2):72–83.
- Ryan PM, Kienstra AJ, Cosgrove P, Vezzetti R, Wilkinson M. Safety and effectiveness of intranasal midazolam and fentanyl used in combination in the pediatric emergency department. Am J Emerg Med 2018;pii:S0735-6757(18)30413-3 [publication en ligne avant impression].
- Wang JY, Speechley K, Anderson KK et coll. Intranasal midazolam for procedural distress in children in the emergency department: A systematic review and meta-analysis. CJEM 2024;26(9):658-70. doi : 10.1007/s43678-024-00731-2
- Rached-d’Astous S, Finkelstein Y, Bailey B et coll. Intranasal ketamine for procedural sedation in children: An open-label multicenter clinical trial. Am J Emerg Med 2023;67:10-16. doi : 10.1016/j.ajem.2023.01.046
- Poonai N, Sabhaney V, Ali S et coll. Optimal dose of intranasal dexmedetomidine for laceration repair in children: A phase II dose-ranging study. Ann Emerg Med 2023;82(2):179-90. doi : 10.1016/j.annemergmed.2023.01.023
- Poonai N, Spohn J, Vandermeer B et coll. Intranasal dexmedetomidine for procedural distress in children: A systematic review. Pediatrics 2020;145(1):e20191623. doi : 10.1542/peds.2019-1623 119.
- Kumar K, Ali S, Sabhaney V et coll.; Pédiatrie urgence recherche Canada. Anxiolysis for laceration repair in children: A survey of pediatric emergency providers in Canada. CJEM 2022;24(1):75-83. doi : 10.1007/s43678-021-00210-y
- Le May S, Ali S, Plint AC et coll.; Pediatric Emergency Research Canada (PERC). Oral analgesics utilization for children with musculoskeletal injury (OUCH Trial): An RCT. Pediatrics 2017;140(5).pii:e20170186.
- Le May S, Ali S, Khadra C et coll. Pain management of pediatric musculoskeletal injury in the emergency department: A systematic review. Pain Res Manag 2016;2016:4809394.
- Poonai N, Bhullar G, Lin K et coll. Oral administration of morphine versus ibuprofen to manage postfracture pain in children: A randomized trial. CMAJ 2014;186(18):1358–63.
- Mudd S. Intranasal fentanyl for pain management in children: A systematic review of the literature. J Pediatr Health Care 2011;25(5):316–22.
- Murphy A, O’Sullivan R, Wakai A et coll. Intranasal fentanyl for the management of acute pain in children. Cochrane Database Syst Rev 2014;10:CD009942.
- Friedrichsdorf SJ, Eull D, Weidner C, Postier A. A hospital-wide initiative to eliminate or reduce needle pain in children using lean methodology. Pain Rep 2018;3(Suppl 1):e671.
- American Academy of Pediatrics; comité des soins hospitaliers et conseil des services éducatifs en milieu pédiatrique. Child life services. Pediatrics 2014;133(5):e1471-8.
- Mulhall A, May AL, Alexander C. Research based nursing practice—An evaluation of an educational programme. Nurse Educ Today 2000;20(6):435–42.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


