Document de principes
Un guide pour la prise en charge communautaire des troubles des conduites alimentaires en pédiatrie
Affichage : le 6 juin 2024
Auteur(s) principal(aux)
Marian Coret MD, M. Sc., B. Sc.; Ellie Vyver MD, FRCPC; Megan Harrison MD FRCPC; Alene Toulany MD, M. Sc., FRCPC; Ashley Vandermorris MD, M. Sc., FRCPC; Holly Agostino MD, Société canadienne de pédiatrie, Comité de la santé de l’adolescent
Résumé
Les troubles des conduites alimentaires (TCA) désignent un groupe de maladies graves au potentiel mortel qui se déclarent généralement pendant l’adolescence et peuvent être associés à de graves complications médicales et psychosociales. Ils peuvent avoir d’importantes répercussions sur les proches et les autres membres de la famille. Les professionnels de la santé jouent un rôle important pour les dépister et les prendre en charge chez les adolescents et les jeunes adultes. Le présent document de principes aide les professionnels de la santé en milieu communautaire à dépister, diagnostiquer et traiter les TCA dans la population pédiatrique. Les modalités de dépistage, les indications d’hospitalisation, les complications médicales et la surveillance des jeunes ayant un TCA sont résumées. Les données probantes à jour appuient le recours au traitement familial, la modalité thérapeutique psychologique de première ligne auprès des adolescents ayant un TCA restrictif. Les traitements familiaux dépassent peut-être la portée de pratique de certaines médecins en milieu communautaire, mais le présent document de principes en examine les éléments fondamentaux. Au diagnostic d’un TCA, les professionnels de la santé qui mettent rapidement ces éléments à exécution en milieu communautaire peuvent ralentir l’évolution de la maladie et donner des conseils aux familles.
Mots-clés : anorexie; trouble des conduites alimentaires; traitement familial
La prévalence et les populations
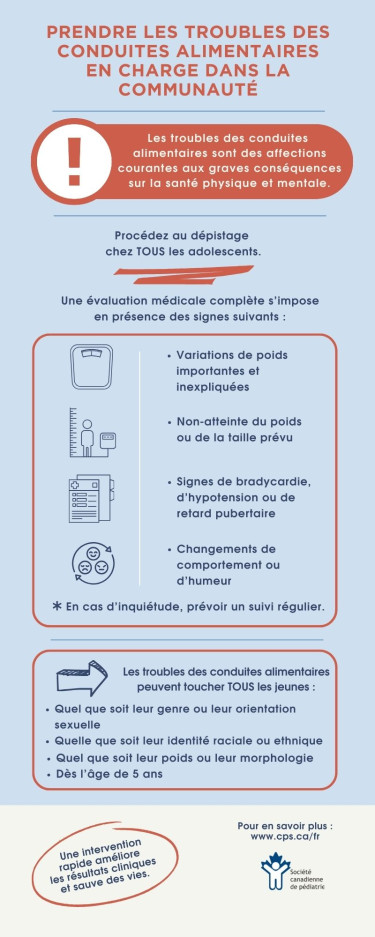
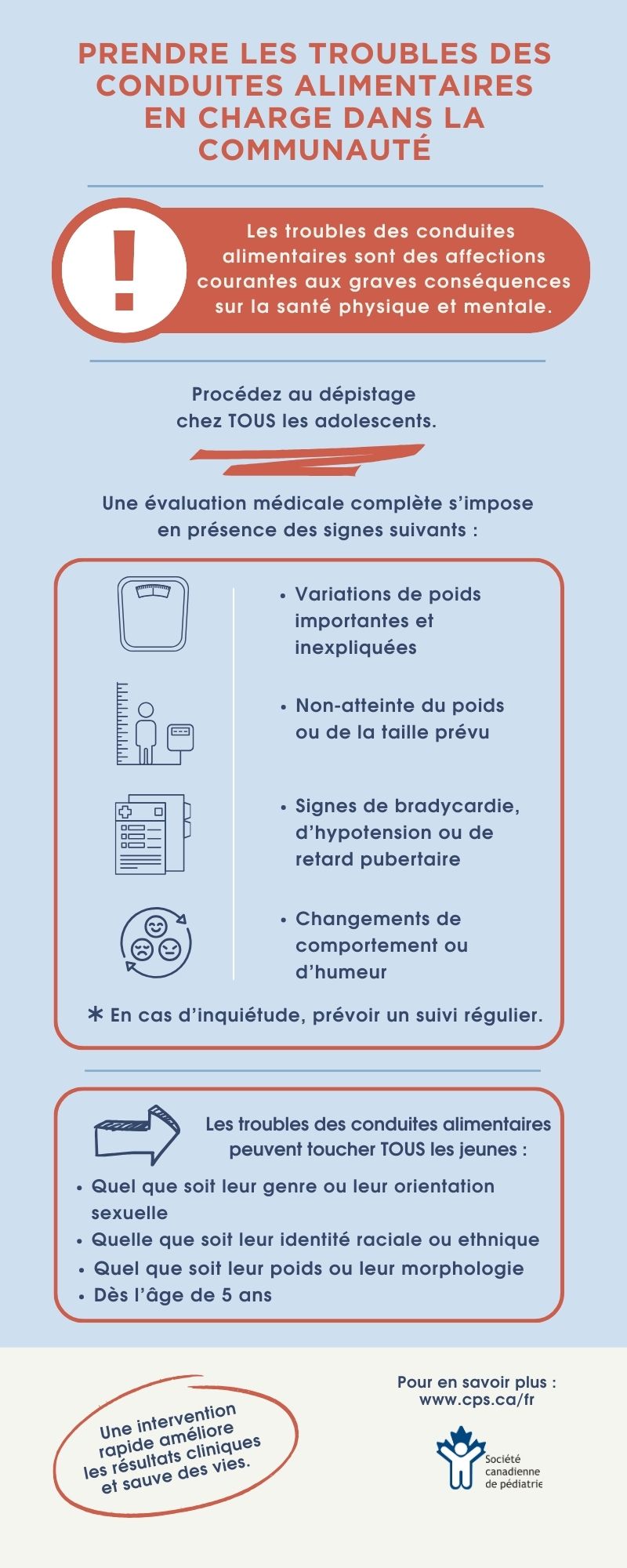
Les troubles des conduites alimentaires (TCA) désignent un groupe de maladies hétérogènes qui influent considérablement sur la santé physique et psychosociale des enfants et des adolescents du Canada[1]. Ils touchent tous les jeunes, quel que soit leur âge, leur genre, leur orientation sexuelle, leur identité raciale ou ethnique ou leur situation socioéconomique. Par rapport à des sujets témoins appariés selon l’âge, les jeunes ayant un TCA sont beaucoup plus à risque de morbidité et de mortalité[2]. Les TCA peuvent être responsables de complications complexes et même au potentiel mortel, et l’anorexie mentale est associée au taux de mortalité le plus élevé de tous les troubles psychiatriques[3][4].
On estime que jusqu’à 5 % des adolescents du Canada présentent un TCA[5]. Malgré cette prévalence, bon nombre de ces jeunes ne sont pas dépistés ou tardent à l’être. Les diagnostics manqués ou tardifs sont souvent observés dans les populations qui ne correspondent pas au phénotype classique de TCA, telles que les personnes de sexe masculin, les minorités sexuelles ou raciales, les enfants prépubères ou les personnes dont le poids est perçu comme dans la moyenne ou au-dessus de la moyenne[6]. Il est de plus en plus établi que de nombreux adolescents atteints d’anorexie mentale atypique (c’est-à-dire qu’ils ont perdu beaucoup de poids, mais ont un indice de masse corporelle (IMC) normal ou élevé) ne sont pas considérés par les professionnels de la santé (PdS) comme ayant un TCA ou sont perçus comme moins vulnérables aux complications. Cependant, d’après les recherches, les personnes ayant une anorexie mentale atypique présentent des taux d’instabilité médicale et de complications semblables à ceux des personnes en insuffisance pondérale et un degré de psychopathologie et de morbidité attribuables au TCA plus élevé qu’elles[7].
Les jeunes peuvent également présenter un TCA restrictif qui n’est pas lié au poids ou à l’image corporelle. Le trouble de l’alimentation avec restriction ou évitement est un TCA associé à des perturbations persistantes de l’alimentation responsables de l’incapacité à répondre aux besoins nutritionnels ou énergétiques. Ils peuvent ne pas être intéressés à manger ou avoir une alimentation limitée en raison d’une sensibilité sensorielle ou d’une crainte de conséquences répulsives lors de l’alimentation (p. ex., étouffement ou vomissements)[3][8].
Depuis dix ans, l’incidence de TCA a continué graduellement d’augmenter chez les adolescents[9]. Récemment, la pandémie de COVID-19 a entraîné des augmentations de la prévalence et de la gravité des TCA restrictifs dans les populations pédiatriques[10]-[13]. La hausse mondiale de cas de TCA a suscité d’importants problèmes d’accès aux services de soins tertiaires et fait ressortir la nécessité de soutenir et former des professionnels de la santé en milieu communautaire en mesure de soigner les jeunes ayant des TCA[14].
Améliorer le rôle des professionnels de la santé en milieu communautaire
Les PdS en milieu communautaire peuvent jouer un rôle important pour dépister, évaluer et prendre en charge les TCA chez les jeunes. Des études ont démontré que la plupart des adolescents ayant un TCA consultent d’abord leur PdS de première ligne, parfois à cause de symptômes vagues comme des douleurs abdominales, de la fatigue ou des anomalies menstruelles[15]. Les bilans de santé préventifs sont des occasions régulières de dépister les comportements de TCA dans le cadre de l’évaluation psychosociale[14]. Les PdS en milieu communautaire possèdent de vastes compétences d’encadrement des proches pour qu’ils adoptent des comportements essentiels en matière de santé (p. ex., la vaccination, l’adhésion à la médication), et leur expérience les outille à aider les patients et les familles à adopter des changements de comportement[16]. La confiance qui s’installe grâce à leurs relations longitudinales avec les patients peut favoriser et renforcer les soins centrés sur la famille et l’adoption des traitements.
De nombreux obstacles peuvent compliquer le dépistage systématique des TCA et les interventions précoces, y compris le manque de ressources, le manque de temps et le manque de confiance de la part des médecins à les déceler et à les traiter[17]. Selon des sondages auprès de pédiatres de première ligne et de médecins de famille, la plupart des répondants avaient l’impression qu’ils avaient un rôle à jouer dans le dépistage et l’évaluation des TCA, mais échouaient souvent à déceler ces affections[18][19]. Par ailleurs, moins de la moitié d’entre eux avaient confiance en leur capacité d’intervenir efficacement[17][20]. Les adolescents ayant un TCA peuvent nier leurs symptômes et la gravité de leur maladie ou éviter les soins, ce qui complique le diagnostic[21]. Malgré ces difficultés, les PdS en milieu communautaire sont bien placés pour déceler les premiers signes de TCA. Puisqu’une intervention rapide améliore les résultats cliniques[22], ils sont également en position idéale pour ralentir l’évolution de la maladie par l’éducation et le counseling en vue de susciter des changements de comportement tôt dans l’évolution de la maladie.
Un dépistage et un diagnostic rapides
Le dépistage et le diagnostic précoces des TCA sont liés à un meilleur pronostic[22], et tous les adolescents devraient être soumis au dépistage lors des bilans de santé annuels [2]. Les PdS sont encouragés à utiliser une grille psychosociale structurée (tableau 1), qui contient des questions axées sur le régime alimentaire, le poids et l’image corporelle[23][24]. Les grilles de dépistage axées sur les TCA comme le questionnaire SCOFF[25] ou le dépistage des troubles alimentaires en soins primaires [26] (tableau 1) peuvent également être utilisés auprès des adolescents plus âgés[27].
Les jeunes qui font état de comportements évocateurs des TCA au dépistage devraient se prêter à une anamnèse détaillée pour confirmer le diagnostic[2]. Le tableau 2 présente une approche pour entreprendre un questionnaire axé sur les TCA. Les comportements qui peuvent laisser croire à un TCA incluent d’importantes préoccupations vis-à-vis de l’image corporelle, le désir de perdre du poids, la crainte de prendre du poids, des profils d’alimentation restrictive ou compulsive, des comportements d'hyperphagie, de l’exercice excessif et le recours à la pharmacothérapie pour perdre du poids ou modifier son apparence. De plus, l’exercice compulsif, l’exercice associé à la prise d’aliments ou la culpabilité en cas d’incapacité à faire de l’exercice sont fortement évocateurs d’une symptomatologie de TCA[28].
Le Manuel diagnostique et statistique des troubles mentaux (DSM-5) fournit les critères diagnostiques des TCA couramment observés à l’adolescence [29]. Même lorsque les critères diagnostiques ne sont pas tous respectés, les TCA peuvent se manifester sous des formes subcliniques par des atteintes fonctionnelles et médicales marquées. Il est important de se rappeler que selon leurs connaissances de la maladie, les enfants et les adolescents ayant un TCA ne reconnaîtront pas nécessairement la symptomatologie de leur trouble ou ne seront pas prêts à le faire[21]. Ainsi, il peut être utile d’obtenir l’histoire de leurs comportements auprès d’un parent ou d’un proche pour formuler un diagnostic de TCA[30].
Le dépistage des TCA lors des bilans de santé devrait également inclure un examen physique. À chaque rencontre de santé, les PdS devraient colliger les données anthropométriques du patient, y compris son poids, sa taille et son IMC, sur des courbes de croissance appropriées qui sont ensuite analysées pour déceler les tendances préoccupantes. Tous les enfants et les adolescents, y compris ceux dont l’IMC est normal ou élevé, qui présentent des variations de poids importantes et inexpliquées, qui n’atteignent pas le poids ou la taille prévu ou qui présentent des signes de bradycardie, d’hypotension ou de retard pubertaire, devraient se prêter à une évaluation médicale approfondie et au dépistage d’un TCA sous-jacent[27]. Il faut vérifier leurs variations orthostatiques après les avoir allongés pendant cinq minutes, puis reprendre la mesure après les avoir placés en position debout pendant trois minutes. Chez les adolescents, des changements évocateurs de la malnutrition peuvent inclure la bradycardie (fréquence cardiaque diurne de moins de 50 battements à la minute), l’hypotension (tension artérielle systolique inférieure à 90 mmHg), l’hypothermie (température centrale inférieure à 35,6 °C) et les variations orthostatiques (baisse posturale de la tension systolique supérieure à 20 mmHg ou baisse posturale de la tension diastolique supérieure à 10 mmHg ou augmentation de la fréquence cardiaque d’au moins 30 battements à la minute)[31].
Il faut envisager des examens de laboratoire initiaux auprès de tous les jeunes chez qui on soupçonne un TCA pour écarter d’autres étiologies organiques et évaluer les complications médicales liées aux TCA (tableau 3). La maladie cœliaque, les maladies inflammatoires de l’intestin, l’hyperthyroïdie, le diabète de type 1, l’insuffisance surrénalienne, le lupus érythémateux systémique, l’infection chronique et les néoplasmes peuvent ressembler à un TCA chez les jeunes[32]. Souvent, les examens de laboratoire effectués chez ceux ayant un TCA restrictif ne révèlent aucune anomalie, même en présence de grave morbidité médicale et psychologique.
Le suivi des enfants et des adolescents ayant un trouble des conduites alimentaires
Une fois le diagnostic de TCA posé, un suivi régulier auprès du patient et de la famille pour surveiller l’évolution clinique devient le pilier des soins. Les PdS devraient déterminer le degré de malnutrition. Cette évaluation peut être réalisée au moyen du pourcentage médian de l’IMC (l’IMC courant divisé par l’IMC au 50e percentile), ou des scores Z d’IMC. Cependant, puisque ces valeurs ne peuvent pas saisir la véritable gravité de la maladie chez les enfants ou les adolescents ayant une anorexie mentale atypique, l’ampleur et rythme de la perte de poids (tableau 4) sont de meilleures mesures[31]. L’ampleur de la perte de poids correspond au pourcentage de la perte de poids ((poids habituel déduction faite du poids à la première consultation) divisé par le poids habituel). Le rythme de la perte de poids correspond au total divisé par le nombre de mois au cours desquels la perte de poids s’est produite (pourcentage de la perte de poids divisé par le nombre de mois). Les directives habituelles indiquent d’utiliser des dénominateurs de un, trois, six et 12 mois[31].
Les enfants et les adolescents présentant une grave malnutrition doivent être suivis de plus près (p. ex., toutes les semaines ou les deux semaines) pour déceler toute complication médicale (tableau 5) et être orientés vers des soins surspécialisés (p. ex., à une clinique de troubles des conduites alimentaires), des soins multidisciplinaires (p. ex., thérapeute familial, psychiatre, diététiste) ou les deux[33].
Note : Cette liste est détaillée, mais ne doit pas être considérée comme complète.
Le suivi médical des patients ayant un TCA devrait inclure la consignation des signes vitaux et des variations de poids, de même que l’évaluation des complications médicales. Si c’est possible, les paramètres de croissance devraient être mesurés dans des conditions standardisées, par exemple à l’aide d’un pèse-personne calibré après que le patient a revêtu une jaquette d’hôpital. Il est recommandé de prescrire une dose quotidienne de multivitamines et de calcium élémentaire (1300 mg/jour chez les patients de neuf à 18 ans) et de suppléments de vitamine D (600 UI/jour) à tous les jeunes ayant un TCA restrictif[2]. Ces suppléments optimisent la santé osseuse pendant la restauration du poids et corrigent les éventuelles carences sous-jacentes en micronutriments.
La consignation des variations de poids est un aspect important du suivi et oriente les soins. La fréquence des vérifications de poids peut varier selon la gravité du cas. Certains jeunes peuvent trouver l’expérience de la pesée difficile sur le plan affectif, mais les pesées « à l’aveugle » (c’est-à-dire que le patient ne voit pas son poids) ne sont pas obligatoires. Il est possible d’aborder la perception du patient et la connaissance de son poids avec la famille et de moduler l’information en fonction de l’étape de la maladie, de l’évolution vers le rétablissement et de la maturité du patient. Il faut tenir compte des variations de poids par rapport au fonctionnement global, parce qu’elles ne constituent qu’un indicateur de l’évolution vers le rétablissement.
Certains symptômes cliniques évocateurs d’une instabilité médicale peuvent justifier une hospitalisation en vue de la réadaptation nutritionnelle (tableau 6)[31]. Les décisions entourant une telle hospitalisation devraient reposer sur une évaluation clinique approfondie de la santé physique et psychologique du patient, des ressources ambulatoires offertes et accessibles et du degré de soutien familial. Comme les critères d’admission varient selon les hôpitaux, les PdS devraient connaître les directives de leurs centres généraux ou spécialisés.
Les approches de traitement familial
Il existe diverses modalités de traitement psychologique pour les enfants et les adolescents ayant un TCA. Une intervention familiale axée sur les TCA, qu’on appelle traitement familial, est l’approche de première ligne du TCA restrictif en pédiatrie[34]. Lorsque ce traitement est disponible, les adolescents ayant un TCA restrictif doivent être orientés le plus rapidement possible vers un PdS spécialisé en traitement familial[35]. Le traitement familial est structuré pour les patients ambulatoires, dans le cadre duquel l’équipe soignante aide la famille à cibler les comportements de TCA et à habiliter les parents ou les proches à retrouver le contrôle de l’apport nutritionnel. Il est réparti en trois phases aux objectifs distincts. La phase 1 est axée sur la restauration du poids par des repas et une supervision assurés par les parents. La phase 2 remet le contrôle de l’alimentation à l’adolescent de manière graduelle et adaptée à son développement. La phase 3 aborde les autres facettes du développement de l’adolescent qui peuvent être touchées par le TCA[36].
Dans le modèle de traitement familial, les PdS devraient exiger que les parents ou les proches assument le plein contrôle du choix des repas jusqu’à l’atteinte d’un poids sain [36]. Les proches devraient superviser la préparation des repas, la disposition dans l’assiette et le déroulement de tous les repas et de toutes les collations. Les parents devraient être encouragés à préparer un plan de supervision des repas ou des collations consommés à l’école, suivi par le personnel scolaire ou les parents eux-mêmes. Les enfants ou les adolescents ayant un TCA ne devraient pas participer à la sélection ou à la préparation de leurs propres repas avant de parvenir à la fois à un poids santé et à une psychopathologie limitée du TCA.
S’il comprend les principes fondamentaux du traitement familial, le PdS peut mettre en place certains éléments de cette intervention fondée sur des données probantes en engageant la responsabilité des parents, sans entreprendre de thérapie officielle. De plus, les stratégies d’imposition de limites parentales en cas de TCA restrictif peuvent également être efficaces pour d’autres types de TCA (p. ex., la boulimie). Lors des rendez-vous de suivi, le PdS peut donner des conseils aux familles et les soutenir pour qu’elles contrôlent la préparation et la supervision des repas; il peut éduquer les parents et les habiliter à fixer des limites envers les comportements de TCA. La supervision parentale peut inclure l’observation des enfants et des adolescents qui adoptent des comportements d'hyperphagie sur une période de 30 minutes à une heure après les repas. Un aperçu de l’application du traitement familial en milieu ambulatoire communautaire peut être consulté[33].
Le traitement familial demeure la norme en cas de TCA restrictif, mais il n’est peut-être pas disponible ni même approprié pour toutes les familles. Les familles qui présentent un dysfonctionnement émotionnel grave, ont de grands besoins de soins (p. ex., pauvreté ou monoparentalité) ou ont une histoire d’abus sont peu susceptibles de répondre au traitement familial avec autant d’efficacité. De plus, des morbidités psychiatriques importantes peuvent remettre en question ou compliquer ce type de thérapie. D’autres modalités thérapeutiques peuvent être préférables dans une telle situation ou en cas de diagnostic de TCA non restrictif[35].
Les conseils nutritionnels
Chez les jeunes ayant un TCA restrictif, il est utile de déterminer un objectif thérapeutique de poids pour orienter la réadaptation nutritionnelle. Cet objectif correspond à une fourchette de poids qui assure des profils d’alimentation saine et régulière, le développement pubertaire, la croissance, l’activité physique et le fonctionnement psychosocial[37]. Cette fourchette de poids peut être estimée par l’analyse des poids sériels obtenus avant le début de TCA (à l’aide des courbes de croissance antérieures ou de l’information fournie par la famille) pour déterminer la perte de poids totale sur une période précise. Les objectifs thérapeutiques de poids ne sont que des estimations, qui doivent être réévaluées tous les trois à six mois tandis que le patient prend de la maturité et que le traitement évolue. Pour obtenir une approche détaillée, consulter le point de pratique de la Société canadienne de pédiatrie intitulé L’établissement d’objectifs thérapeutiques de poids pour les enfants et les adolescents atteints d’anorexie mentale[37].
Lors de la réadaptation nutritionnelle ambulatoire, les conseils doivent être axés sur la saine consommation de repas réguliers, qui consiste normalement en trois repas et trois collations par jour. Dans un modèle de traitement familial, les plans de repas qui précisent les objectifs caloriques par jour ne sont pas recommandés[2[36], et il n’est pas nécessaire d’assurer un suivi détaillé de l’apport calorique. Les régimes spéciaux qui ne précèdent pas le comportement alimentaire perturbé (p. ex., régimes végétariens ou végétaliens) sont souvent un symptôme de TCA et peuvent contribuer à rendre les objectifs nutritionnels particulièrement difficiles à respecter. Le PdS doit encourager les familles à servir des aliments à haute densité calorique et des boissons à haute teneur énergétique (p. ex., choisir du jus de fruits ou du lait au lieu de l’eau) pour maximiser l’apport énergétique sans accroître indûment le volume ingéré. Lorsqu’une restauration du poids s’impose, une prise de poids de 250 g à 500 g par semaine est considérée comme appropriée en milieu ambulatoire. En général, les adolescents doivent consommer de 2 000 kcal/jour à 3 000 kcal/jour pour réaliser ces objectifs[33]. Les besoins caloriques quotidiens peuvent augmenter en cours de traitement, conjointement avec la reprise des processus physiologiques. Les PdS devraient aider les parents et les proches à rajuster la taille et la densité énergétiques des portions d’après la progression du poids. Si le poids n’augmente pas, le médecin, en collaboration avec la famille, devrait tenter d’en déterminer la raison et contribuer à établir une stratégie pour améliorer les résultats. Une « réinitialisation » peut inclure la réduction ou l’arrêt de toutes les activités physiques ou une supervision plus étroite des repas et de la taille de portions.
L’adoption d’habitudes de consommation des repas et des collations à environ la même heure chaque jour facilite un retour au métabolisme normal et aux indices de faim et de satiété naturels. Les parents ou les proches devraient également être encouragés à réintroduire progressivement les aliments qui ont été évités ou qui inspirent la crainte d’une prise de poids.
Les restrictions aux activités
Les enfants et les adolescents en phase aiguë qui sont lourdement atteints ne devraient pas pratiquer d’activité physique, quels que soient leur âge, leur poids ou leurs capacités athlétiques[2]. Cette atteinte peut inclure de récents épisodes d’évanouissement, des variations des signes vitaux, de multiples épisodes quotidiens d’alimentation compulsive et d'hyperphagie, un apport nutritionnel inapproprié ou une déshydratation chronique. Même lorsque les signes vitaux se situent dans une plage normale, le traitement familial encourage les familles à fixer des limites à l’égard des activités qui, à leur avis, sont susceptibles de freiner le rétablissement de leur enfant ou de leur adolescent ou sa capacité à prendre du poids. Les patients ont souvent besoin d’être exemptés de l’éducation physique ou retirés temporairement de leurs équipes et activités sportives (ou les deux) jusqu’à l’atteinte de l’objectif thérapeutique de poids. À la reprise de l’activité physique, une réintroduction graduelle et une surveillance étroite du poids et des signes vitaux sont recommandés. L’apport nutritionnel peut devoir être rajusté pour éviter les rechutes. Les PdS devraient aider les familles à promouvoir des activités sociales limitées dans le temps et positives sur le plan affectif.
Le soutien des familles et les conseils qui leur sont donnés
Les interventions familiales précoces devraient s’orienter vers de la psychoéducation sur les risques de malnutrition et vers l’aide aux parents à fixer des limites sur les comportements de TCA. Dans le modèle de traitement familial, il est recommandé d’« accroître l’anxiété » entourant le diagnostic de TCA et ses risques pour la santé[36]. L’insistance sur la gravité de cette maladie auprès des familles peut constituer un moteur de changement[34], et le PdS est encouragé à ne pas minimiser ou banaliser les risques de TCA.
Un principe fondamental du traitement familial est la séparation ou l’« externalisation » du TCA par rapport à la personne qui le vit, c’est-à-dire que le trouble, plutôt que l’enfant ou l’adolescent qui en est atteint, est considéré comme la cause du conflit familial (« Ce n’est pas votre jeune qui lutte contre vos efforts et y résiste, c’est la maladie »). Pendant le traitement, les familles affirment souvent que les repas deviennent tendus à cause des disputes. Les PdS devraient habiliter les familles à externaliser le TCA pendant ces épisodes et à refuser de négocier ou de céder aux demandes. En présence d’un TCA restrictif, les PdS peuvent adopter une approche des « aliments comme médicaments » auprès des familles et prescrire les aliments comme non optionnels. Ils doivent encourager les familles à insister sur des repas familiaux, où tous les membres de la famille partagent un même repas, y compris le patient. Des techniques de distraction pendant les repas (p. ex., parler d’autres sujets) ou l’adoption d’une approche d’alimentation mécanique peuvent se révéler utiles pour certains. Les stratégies de modification du comportement traditionnelles, c’est-à-dire de récompenser les comportements souhaitables et de sanctionner les comportements non souhaitables, peuvent aussi être utiles[33]. Par exemple, on peut négocier des privilèges comme les sorties avec les amis ou la participation à des activités sociales en fonction de la coopération vis-à-vis de l’alimentation et de la prise de poids. Les parents sont invités à éviter les discussions sur les aliments ou le poids à la maison.
En général, les adolescents se rétablissent mieux d’un TCA que les adultes, les taux de rétablissement globaux se situant aux alentours de 70 %[38]. Cependant, ce rétablissement peut être compliqué et prolongé. Une forte proportion des proches sont dépassés, épuisés et désespérés. La plupart ont déjà tenté d’affronter les comportements de TCA de leur enfant, sans succès. Le fait de valider à la fois les difficultés et le rôle essentiel (mais souvent épuisant) des proches peut contribuer à forger une alliance thérapeutique avec les PdS et à renforcer l’adhésion au traitement. Les PdS doivent comprendre l’effet considérable du long processus de rétablissement sur la qualité de vie de tous les membres de la famille. La famille (y compris la fratrie) peut également avoir besoin de soutien personnel et devrait être encouragée à aller en thérapie, au besoin.
Recommandations
- Dépister les troubles des conduites alimentaires (TCA) chez les adolescents dans le cadre de tous les rendez-vous et de tous les bilans de santé.
- Procéder à une évaluation médicale détaillée de tous les enfants et les adolescents, y compris ceux dont l’indice de masse corporelle est normal ou élevé, qui présentent des variations de poids importantes et inexpliquées, qui n’atteignent pas le poids ou la taille prévu ou qui présentent des signes de bradycardie, d’hypotension ou de retard pubertaire, en vue de diagnostiquer un éventuel TCA.
- S’assurer que les enfants et les adolescents qui obtiennent des résultats positifs au dépistage se prêtent à une anamnèse détaillée, à un examen physique et à des examens de laboratoire pour confirmer le diagnostic et évaluer les complications médicales.
- Procéder à une évaluation systématique des variations des signes vitaux, des complications médicales et des considérations en vue d’une admission hospitalière chez les enfants et les adolescents ayant un TCA diagnostiqué.
- Lorsque la situation l’indique, orienter l’adolescent ayant un TCA restrictif vers un professionnel de la santé (PdS) spécialisé en traitement familial.
- Les PdS des enfants ou des adolescents ayant un TCA devraient se familiariser avec les concepts fondamentaux du traitement familial et sont encouragés à donner des conseils ou à mettre en place des éléments de cette intervention fondée sur des données probantes lors des rencontres cliniques avec les familles.
- Pendant le traitement, axer la réadaptation nutritionnelle sur la consommation régulière de repas et de collations sous la supervision des parents ou des proches. Les PdS devraient contribuer à rajuster la taille et la densité énergétique des portions en fonction de l’évolution du poids.
- Lorsque la situation médicale permet la reprise de l’activité physique, les PdS devraient contribuer à promouvoir des activités sociales limitées dans le temps et positives sur le plan affectif.
- Les PdS devraient comprendre l’effet des processus de traitement et de rétablissement sur la qualité de vie de tous les membres de la famille et les aider ou les orienter vers des services thérapeutiques ou un soutien lorsque la situation l’indique.
Remerciements
Le comité de la pédiatrie communautaire, le comité de la santé mentale et des troubles du développement et le comité des soins aigus de la Société canadienne de pédiatrie ont révisé le présent document de principes.
COMITÉ DE LA SANTÉ DE L’ADOLESCENT DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (AVRIL 2023)
Membres : Holly Agostino MD; Marian Coret MD, M. Sc., B. Sc. (membre résidente); Megan Harrison MD FRCPC; Ayaz Ramji MD (représentant du conseil); Alene Toulany MD, M. Sc., FRCPC; Ashley Vandermorris MD, M. Sc., FRCPC; Ellie Vyver MD, FRCPC (présidente)
Représentante : Amy Robinson MD, FRCPC (section de la santé de l’adolescent)
Auteures principales : Marian Coret MD, M. Sc., B. Sc.; Ellie Vyver MD, FRCPC; Megan Harrison MD FRCPC; Alene Toulany MD, M. Sc., FRCPC; Ashley Vandermorris MD, M. Sc., FRCPC; Holly Agostino MD
Références
- Academy for Eating Disorders; comité des normes de soins médicaux. Eating Disorders: A guide to Medical Care. 3e éd., 2016. https://www.massgeneral.org/assets/mgh/pdf/psychiatry/eating-disorders-medical-guide-aed-report.pdf (consulté le 24 janvier 2024).
- Hornberger LL, Lane MA; American Academy of Pediatrics (AAP), comité de l’adolescence. Identification and management of eating disorders in children and adolescents. Pediatrics2021;147(1):e2020040279. doi : 10.1542/peds.2020-040279.
- Herpertz-Dahlmann B. Adolescent eating disorders: Definitions, symptomatology, epidemiology and comorbidity. Child Adolesc Psychiatr Clin N Am 2009;18(1):31-47. doi : 10.1016/j.chc.2008.07.005.
- Franko DL, Keshaviah A, Eddy KT et coll. A longitudinal investigation of mortality in anorexia nervosa and bulimia nervosa. Am J Psychiatry 2013;170(8):917-25. doi : 10.1176/appi.ajp.2013.12070868.
- Société canadienne de pédiatrie, comité de la médecine de l’adolescence. Les troubles de l’alimentation chez les adolescents : Les principes de diagnostic et de traitement 1998;3(3):189-96. doi : 10.1093/pch/3.3.189.
- Swanson SA, Crow SJ, Le Grange D, Swendsen J, Merikangas KR. Prevalence and correlates of eating disorders in adolescents. Results from the national comorbidity survey replication adolescent supplement. Arch Gen Psychiatry 2011;68(7):714-23. doi : 10.1001/archgenpsychiatry.2011.22.
- Sawyer SM, Whitelaw M, Le Grange D, Yeo M, Hughes EK. Physical and psychological morbidity in adolescents with atypical anorexia nervosa. Pediatrics 2016;137(4):e20154080. doi : 10.1542/peds.2015-4080.
- Katzman DK, Guimond T, Spettigue W, Agostino H, Couturier J, Norris ML. Classification of children and adolescents with avoidant/restrictive food intake disorder. Pediatrics 2022;150(3):e2022057494. doi : 10.1542/peds.2022-057494.
- Nicholls DE, Lynn R, Viner RM. Childhood eating disorders: British national surveillance study. Br J Psychiatry 2011;198(4):295-301. doi : 10.1192/bjp.bp.110.081356.
- Agostino H, Burstein B, Moubayed D et coll. Trends in the incidence of new-onset anorexia nervosa and atypical anorexia nervosa among youth during the COVID-19 pandemic in Canada. JAMA Netw Open 2021;4(12):e2137395. doi : 10.1001/jamanetworkopen.2021.37395.
- Otto AK, Jary JM, Sturza J et coll. Medical admissions among adolescents with eating disorders during the COVID-19 pandemic. Pediatrics 2021;148(4):e2021052201. doi : 10.1542/peds.2021-052201.
- Toulany A, Kurdyak P, Guttmann A et coll. Acute care visits for eating disorders among children and adolescents after the onset of the COVID-19 pandemic. J Adolesc Health 2022;70(1):42-7. doi : 10.1016/j.jadohealth.2021.09.025.
- Vyver E, Han AX, Dimitropoulos G et coll. The COVID-19 pandemic and Canadian pediatric tertiary care hospitalizations for anorexia nervosa. J Adolesc Health 2023;72(3):344-51. doi : 10.1016/j.jadohealth.2022.07.003.
- Lenton-Brym T, Rodrigues A, Johnson N, Couturier J, Toulany A. A scoping review of the role of primary care providers and primary care-based interventions in the treatment of pediatric eating disorders. Eat Disord 2020;28(1):47-66. doi : 10.1080/10640266.2018.1560853.
- Hoek HW. Incidence, prevalence and mortality of anorexia nervosa and other eating disorders. Curr Opin Psychiatry 2006;19(4):389-94. doi : 10.1097/01.yco.0000228759.95237.78.
- Lebow J, Narr C, Mattke A et coll. Engaging primary care providers in managing pediatric eating disorders: A mixed methods study. J Eat Disord 2021;9(1):11. doi : 10.1186/s40337-020-00363-8.
- Linville D, Brown T, O’Neil M. Medical providers’ self perceived knowledge and skills for working with eating disorders: A national survey. Eat Disord 2012;20(1):1-13. doi : 10.1080/10640266.2012.635557.
- Stein REK, Horwitz SM, Storfer-Isser A, Heneghan A, Olson L, Hoagwood KE. Do pediatricians think they are responsible for identification and management of child mental health problems? Results of the AAP periodic survey. Ambul Pediatr 2008;8(1):11-7. doi : 10.1016/j.ambp.2007.10.006.
- Robinson AL, Boachie A, Lafrance GA. Assessment and treatment of pediatric eating disorders: A survey of physicians and psychologists. J Can Acad Child Adolesc Psychiatry 2012;21(1):45-52 .
- Davis DW, Honaker SM, Jones VF, Williams PG, Stocker F, Martin E. Identification and management of behavioral/mental health problems in primary care pediatrics: Perceived strengths, challenges, and new delivery models. Clin Pediatr (Phila) 2012;51(10):978-82. doi : 10.1177/0009922812441667.
- Couturier JL, Lock J. Denial and minimization in adolescents with anorexia nervosa. Int J Eat Disord 2006;39(3):212-6. doi : 10.1002/eat.20241.
- Haripersad YV, Kannegiesser-Bailey M, Morton K et coll. Outbreak of anorexia nervosa admissions during the COVID-19 pandemic. Arch Dis Child 2021;106(3):e15. doi : 10.1136/archdischild-2020-319868.
- Goldenring JM, Rosen DS. Getting into adolescent heads: An essential update. Contemp Pediatr 2004;21(1):64-90 .
- Tylee A, Haller DM, Graham T, Churchill R, Sanci LA. Youth-friendly primary-care services: How are we doing and what more needs to be done? Lancet 2007;369(9572):1565-73. doi : 10.1016/S0140-6736(07)60371-7.
- Morgan JF, Reid F, Lacey JH. The SCOFF questionnaire: Assessment of a new screening tool for eating disorders. BMJ 1999;319(7223):1467-8. doi : 10.1136/bmj.319.7223.1467.
- Cotton MA, Ball C, Robinson P. Four simple questions can help screen for eating disorders. J Gen Intern Med 2003;18(1):53-6. doi : 10.1046/j.1525-1497.2003.20374.x.
- Feltner C, Peat C, Reddy S et coll. Screening for eating disorders in adolescents and adults: Evidence report and systematic review for the US Preventive Services Task Force. JAMA 2022;327(11):1068-82. doi : 10.1001/jama.2022.1807.
- Carpine L, Charvin I, Da Fonseca D, Bat-Pitault F. Clinical features of children and adolescents with anorexia nervosa and problematic physical activity. Eat Weight Disord 2022;27(1):119-29. doi : 10.1007/s40519-021-01159-8.
- American Psychiatric Association. Manuel diagnostique et statistique des troubles mentaux (DSM-5), 5e édition, révision de texte. Elsevier Masson SAS, Issy-les-Moulineaux : APA, 2015.
- Lock J, La Via MC; American Academy of Child and Adolescent Psychiatry, Committee on Quality Issues. Practice parameter for the assessment and treatment of children and adolescents with eating disorders. J Am Acad Child Adolesc Psychiatry 2015;54(5):412-25. doi : 10.1016/j.jaac.2015.01.018.
- Society for Adolescent Health and Medicine. Medical management of restrictive eating disorders in adolescents and young adults. J Adolesc Health 2022;71(5):648-54. doi : 10.1016/j.jadohealth.2022.08.006.
- Katzman DK, Gordon C, Callahan T et coll. éd. Neinstein’s Adolescent and Young Adult Health Care: A Practical Guide. 7e éd. Alphen aan den Rijn, Pays-Bas : Wolters Kluwer/Lippincott; 2023.
- Findlay S, Pinzon J, Taddeo D, Katzman DK. Le traitement familial des enfants et des adolescents anorexiques : Des lignes directrices pour le médecin communautaire. Paediatr Child Health 2010;15(1):36-40. doi : 10.1093/pch/15.1.36.
- Rienecke RD. Family-based treatment of eating disorders in adolescents: Current insights. Adolesc Health Med Ther 2017;8:69-79. doi : 10.2147/AHMT.S115775.
- Couturier J, Isserlin L, Norris M et coll. Canadian practice guidelines for the treatment of children and adolescents with eating disorders. J Eat Disord 2020;8:4. doi : 10.1186/s40337-020-0277-8.
- Lock J, Le Grange. Treatment Manual for Anorexia Nervosa: A Family-Based Approach, 2e éd. New York, NY: The Guilford Press; 2015.
- Norris ML, Hiebert JD, Katzman DK; Société canadienne de pédiatrie; comité de la santé de l’adolescent. L’établissement d’objectifs thérapeutiques de poids pour les enfants et les adolescents atteints d’anorexie mentale. Paediatr Child Health 2018;23(8):552. doi : 10.1093/pch/pxy137. https://cps.ca/fr/documents/position/letablissement-dobjectifs-therapeutiques-de-poids
- Steinhausen HC, Grigoroiu-Serbanescu M, Boyadjieva S, Neumarker KJ, Winkler Metzke C. Course and predictors of rehospitalization in adolescent anorexia nervosa in a multisite study. Int J Eat Disord 2008;41(1):29-36. doi : 10.1002/eat.20414.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.