Point de pratique
Mise à jour sur l’infection congénitale à cytomégalovirus : la prévention prénatale, le diagnostic néonatal et la prise en charge
Affichage : le 9 septembre 2020 | Mise à jour : le 24 janvier 2025 | Reconduit : le 12 janvier 2026
Auteur(s) principal(aux)
Michelle Barton, A. Michael Forrester, Jane McDonald; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Mise à jour par : Michelle Barton, Ari Bitnun
Résumé
Le cytomégalovirus est la principale cause d’infection congénitale et la première cause de surdité de perception d’origine non génétique pendant l’enfance. Même si la plupart des nouveau-nés infectés ne sont pas symptomatiques à la naissance, l’infection congénitale à cytomégalovirus est une affection importante, en raison du risque de surdité de perception et des autres atteintes neurodéveloppementales qui s’y associent. Le respect des mesures d’hygiène pendant la grossesse peut réduire le risque d’infection de la mère par le CMV. Grâce au dépistage rapide, il est possible de vite entreprendre la surveillance et la prise en charge des nouveau-nés infectés. Il est essentiel d’adopter une prise en charge multidisciplinaire pour optimiser le pronostic des nouveau-nés atteints.
Mots-clés : amplification en chaîne de la polymérase (PCR); cytomégalovirus (CMV); infection congénitale; séquelles neurodéveloppementales; surdité de perception (SP) valganciclovir
Le cytomégalovirus (CMV) est la principale cause d’infection congénitale, puisqu’elle touche de 0,5 % à 1 % des naissances vivantes en Amérique du Nord et en Europe, et jusqu’à 6 % de celles des pays en développement [1]-[4]. C’est la première cause (jusqu’à 25 %) de surdité de perception (SP; qu’on appelle aussi surdité neurosensorielle) d’origine non génétique chez l’enfant [5]. On estime la prévalence des séquelles neurologiques permanentes entre 5 % et 15 % dans les cas d’infection congénitale à CMV (icCMV) asymptomatique, et entre 36 % et 90 % [1][6]-[10] chez les survivants d’une icCMV symptomatique (figure 1).
En raison des récents progrès de la pharmacothérapie contre cette infection, l’intérêt pour la prévention, le diagnostic et le traitement s’est renouvelé [5][11]. Le présent point de pratique s’attarde sur le diagnostic d’icCMV chez les nouveau-nés et fait ressortir les stratégies de prise en charge. Le dépistage universel néonatal de l’icCMV est envisagé dans certains pays, et il est déjà en cours en Ontario.
L’infection prénatale de la mère et le risque de transmission fœtale
Les femmes enceintes atteintes d’une primo-infection par le CMV ou d’un CMV non primaire (réinfection par d’autres souches virales ou réactivation de la souche primaire) risquent de transmettre le CMV par voie verticale (transplacentaire) à leur fœtus [12]-[15]. Le taux de transmission est de dix à 15 fois plus élevé lorsque la mère souffre d’une primo-infection plutôt que d’une infection non primaire (figure 1) [1][6][10][16]. Cependant, la plupart des nouveau-nés infectés sont asymptomatiques à la naissance; seulement 10 % présentent des manifestations cliniques [5][9][11].
| Figure 1. Le taux d’infection du fœtus et les séquelles après une infection de la mère |
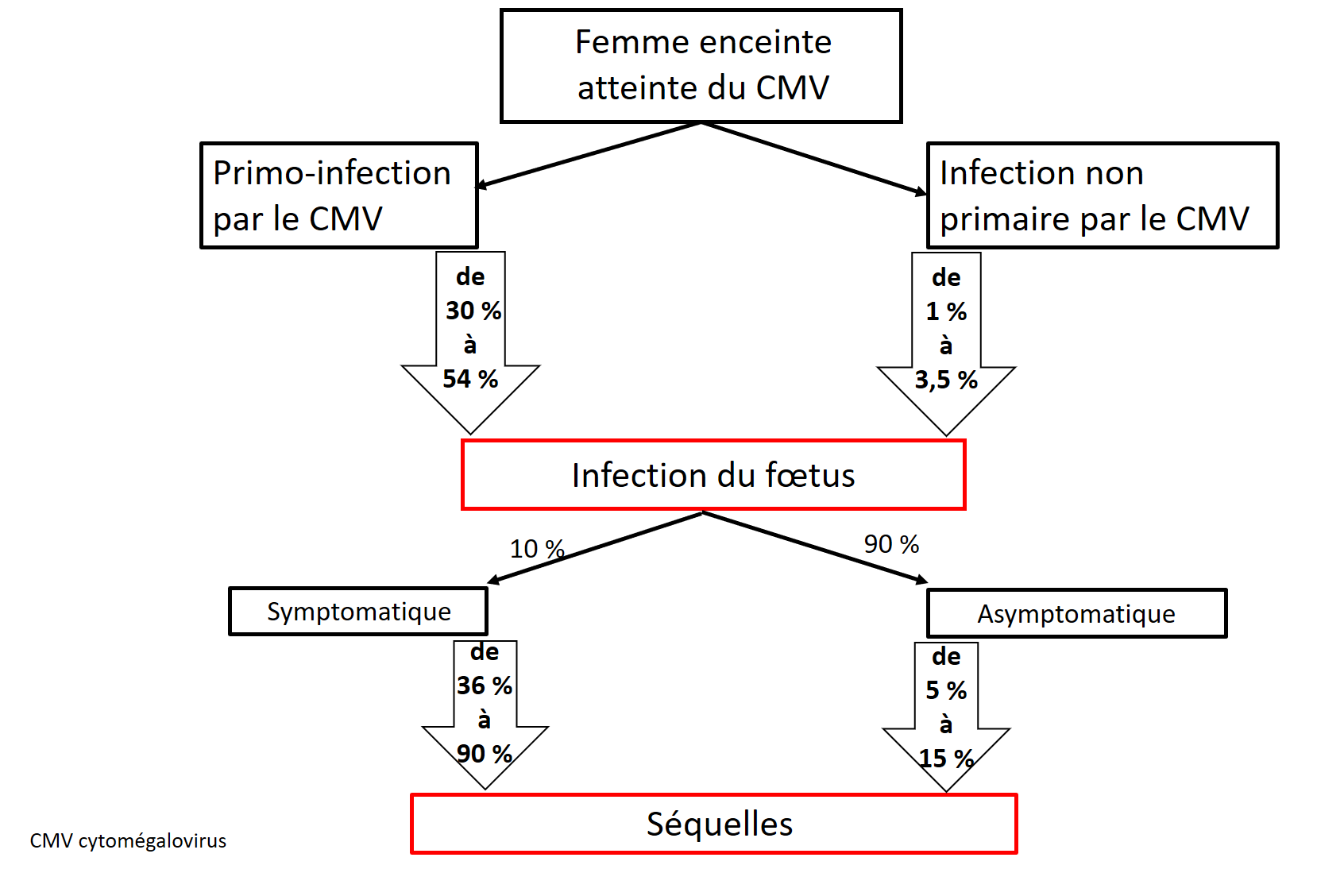 |
Le CMV est transmis par voie horizontale lors d’un contact intime avec les liquides organiques : salive, urine, sécrétions sexuelles et lait maternel [17]. Chez les jeunes enfants en bonne santé qui fréquentent un milieu de garde ou habitent dans des logements surpeuplés, le risque de transmission entre personnes risque d’être plus élevé, ce qui accroît alors la prévalence de primo-infection. Les enfants infectés peuvent continuer de propager le virus jusqu’à l’âge préscolaire [18] et représentent une source majeure d’infection chez les adultes qui s’occupent d’eux (y compris les femmes enceintes) et chez les autres enfants.
L’administration d’immunoglobulines hyperimmunes spécifiques anti-CMV et d’antiviraux aux femmes enceintes atteintes d’une primo-infection peut être bénéfique, mais on ne possède pas de données solides pour appuyer ces traitements [11][19]-[21]. Un vaccin efficace administré avant la grossesse constituerait sûrement la meilleure stratégie préventive, mais aucun n’a encore été créé [22]. Les femmes enceintes devraient être informées des mesures d’hygiène à respecter, car il est démontré que ces mesures réduisent leur risque d’infection [23]-[25] (tableau 1).
|
1. Éviter tout contact avec les liquides organiques
|
|
|
*A. Éviter le contact des muqueuses avec la salive d’autrui
|
|
|
B. Éviter les nouveaux partenaires sexuels
De nouveaux partenaires atteints du CMV provoquent une exposition par leurs sécrétions sexuelles et leur salive
|
|
|
2. Se laver les mains et maintenir les surfaces propres*
|
|
|
†Se laver les mains après :
|
‡Effectuer un nettoyage régulier des matières contaminées
|
|
*Mesures recommandées par les Centers for Disease Control and Prevention des États-Unis |
|
L’exploration et l’évaluation des nouveau-nés à risque d’icCMV
Les manifestations cliniques de l’icCMV symptomatique à la naissance sont la microcéphalie, le retard de croissance intra-utérine, l’hépatosplénomégalie, les pétéchies, l’ictère et les convulsions (tableau 2) [26]-[35]. Les nouveau-nés atteints d’une icCMV symptomatique doivent être détectés rapidement, afin d’amorcer une prise en charge appropriée le plus vite possible pour améliorer le pronostic [36][37]. Les tests diagnostiques de l’icCMV reposent sur l’identification directe du virus dans les liquides organiques du nouveau-né avant 21 jours de vie [36][37]. Lorsque le dépistage a lieu plus tard, un résultat positif peut être indicateur d’une infection périnatale ou postnatale, et ne permet donc pas de conclure qu’il s’agit d’une icCMV. La sérologie n’est pas recommandée, car même si un résultat négatif aux immunoglobulines G peut exclure l’icCMV, un résultat positif chez le nouveau-né est généralement indicateur de la transmission passive d’anticorps par la mère infectée, ce qui ne contribue pas au diagnostic d’icCMV [5][38]. De même, les immunoglobulines M donnent de piètres résultats (sensibilité de 20 % à 70 %) comme test diagnostique [39].
|
Constatations de l’examen physique
|
|
Générales : PAG, microcéphalie†, ictère, anasarque†
Cutanées : Pétéchies†
Respiratoires : Pneumonite§
Abdominales : Hépatosplénomégalie†
SNC : Convulsions‡, mauvaise succion, hypotonie, léthargie
Auditives*
Oculaires* : Choriorétinite†1, atrophie optique, microphtalmie, cicatrices rétiniennes, strabisme, déficience visuelle d’origine corticale‡
|
|
Anomalies observées en laboratoire
|
|
Hématologie : Surtout une faible numération plaquettaire2, mais possibilité de suppression d’autres lignées cellulaires
Transaminite : ALT élevée2
Hyperbilirubinémie : Bilirubine conjuguée élevée2
Anomalies du liquide céphalorachidien (non expliquées autrement) : Pléocytose, taux de protéines élevé, PCR CMV positive‡
|
|
Anomalies à l’imagerie cérébrale*1
|
|
Ventriculaires et périventriculaires‡ : Calcifications† (50 % des anomalies du SNC), ventriculomégalie ± atrophie
Structurelles‡ : Kystes cérébelleux, épendymaires, parenchymateux
Corticales‡ : Polymicrogyrie
Migratoires‡ : Lissencéphalie, porencéphalie, schizencéphalie, encéphalopathie étendue
Vasculaires : Vasculopathie lenticulostriée¶
|
|
1. La choriorétinite et les anomalies à l’imagerie intracrânienne sont considérées comme très évocatrices d’une icCMV. |
Les tests de dépistage du CMV au moyen de cultures virales rapides (sensibilité de plus de 92 %, spécificité de 100 %) ou d’analyses par amplification en chaîne par polymérase (PCR; sensibilité de plus de 95 %, spécificité de plus de 98 %) dans l’urine (méthode préférable; un prélèvement dans un sac collecteur convient) ou dans la salive du nouveau-né sont à préconiser [40]-[42]. Les prélèvements de salive s’effectuent par écouvillonnage de l’intérieur de la bouche. Le prélèvement doit être effectué plus d’une heure après l’allaitement, afin de limiter les résultats faussement positifs chez les nouveau-nés d’une mère atteinte du CMV [41]. Tous les prélèvements de salive positifs doivent être confirmés par un test urinaire. Lorsque l’on ne connaît pas le statut CMV d’une population, mais que des enfants en faisant partie ne présentent pas nécessairement les manifestations cliniques d’icCMV, l’analyse de gouttes de sang séché prélevées chez le nouveau-né a un large spectre de sensibilité (28 % à 73 %) [43][44]. À 84 %, cette sensibilité était toutefois plus élevée dans une méta-analyse qui incluait des nouveau-nés ayant des symptômes évocateurs d’une icCMV ou atteints d’une icCMV confirmée [45]. Les nouveau-nés ne présentent pas toujours de virémie à la naissance. Ainsi, on ne peut pas exclure le CMV si on obtient un résultat négatif après une analyse du sang total ou du plasma par PCR ou une analyse à partir de gouttes de sang séché prélevées chez le nouveau-né [43][44]. L’analyse de gouttes de sang séché dont le résultat est positif contribue toutefois à confirmer la virémie [43][44][46] et peut parfois être utile lorsque l’évaluation est reportée après trois semaines de vie.
Les nouveau-nés dont la mère est atteinte d’une infection à CMV présumée ou démontrée pendant la grossesse (d’après les symptômes de la mère, la sérologie, les caractéristiques du fœtus à l’échographie ou l’histopathologie placentaire) ou les nouveau-nés présentant des facteurs de risque (tableau 3) ou des manifestations évocatrices d’une icCMV doivent être soumis au dépistage du CMV et à l’évaluation clinique et en laboratoire, pour établir la gravité de l’infection. Les tests de laboratoire doivent évaluer la présence d’anémie, de thrombopénie, d’hyperbilirubinémie et de transaminite [26]. Un test d’urine ou de salive dont le résultat est négatif au CMV doit susciter l’exploration d’autres infections congénitales ou affections génétiques (figure 2).
|
Quelles sont les indications pour dépister les nouveau-nés?
Comment confirmer le diagnostic d’icCMV?
Comment évaluer les nouveau-nés lorsque l’icCMV est confirmée?
|
|
*L’analyse du sang ou du LCR n’est pas recommandée systématiquement, mais si les résultats sont positifs avant trois semaines de vie, ils confirment l’icCMV. |
| Figure 2. Algorithme exposant le dépistage, l’envoi en consultation et le traitement des nouveau-nés chez qui on présume une infection à cytomégalovirus peut être consultée sous forme de fichier supplémentaire. |
Les nouveau-nés qui échouent le dépistage de la surdité sont également soumis au dépistage du CMV. Cette démarche plus ciblée, obligatoire dans certains États américains [47], assure une détection et une prise en charge plus rapides des nouveau-nés ayant une SP associée au CMV [30][48]. Cependant, le dépistage ciblé ne permettra pas de diagnostiquer les nouveau-nés asymptomatiques à la naissance dont le dépistage de la surdité ne suscite d’abord aucune inquiétude, mais qui présentent ensuite une SP isolée tardive.
Même si, dans l’idéal, le dépistage universel optimise la détection de l’icCMV, il n’y a pas encore de consensus quant aux échantillons optimaux à utiliser lors du dépistage néonatal précoce. Le spectre de sensibilité du dépistage au moyen de l’analyse de gouttes de sang séché, ainsi que le coût supplémentaire et les difficultés logistiques liés à l’utilisation d’échantillons plus performants, tels que l’urine ou la salive, sont des éléments qui ne sont pas encore résolus [49].
Lorsque les nouveau-nés chez qui on soupçonne une icCMV avec atteinte du système nerveux central sont soumis à une ponction lombaire pour exclure d’autres causes infectieuses, on peut envisager une PCR CMV à partir du liquide céphalorachidien [5] qui, si elle est positive, contribue au diagnostic d’une maladie du système nerveux central (tableau 3). Cependant, en raison de la faible sensibilité de la PCR et de son peu d’utilité pronostique, il est difficile de la recommander systématiquement en présence d’une icCMV symptomatique [50]. Lorsque le dépistage confirme l’icCMV, les nouveau-nés symptomatiques ont besoin d’une évaluation ophtalmologique et auditive, de même qu’une imagerie cérébrale (tableau 3) [5][11]. En général, l’échographie cérébrale suffit chez les nouveau-nés asymptomatiques ou peu symptomatiques. Tant la neuro-imagerie par résonance magnétique que celle par tomodensitométrie sont supérieures à l’échographie pour déceler des anomalies évocatrices d’un pronostic moins favorable [51]. Cependant, l’imagerie par résonance magnétique est préférable à la tomodensitométrie et doit être utilisée chez les nouveau-nés qui présentent des manifestations neurologiques importantes ou dont les résultats sont anormaux à l’échographie (tableau 3). En effet, elle a l’avantage supplémentaire de mieux déceler les observations qui laissent présager une atteinte neurodéveloppementale (p. ex., dysplasie de l’hippocampe et du cervelet et polymicrogyrie) (tableau 3) [52].
La prise en charge fondée sur la gravité des symptômes
Dans la période entourant la naissance, les cas d’icCMV sont classés en fonction de la gravité des symptômes, c’est-à-dire une infection asymptomatique, bénigne ou modérée à grave (tableau 4) [11][53]. Puisque l’évaluation des symptômes et la classification de la gravité précèdent l’évaluation audiologique, la classification symptomatique actuelle ne fait pas mention de la SP.
|
Quelle est la classification des nouveau-nés?
Cas confirmé : Test de référence positif* avant l’âge de trois semaines OU résultat positif à partir de GSS à la naissance
Nouveau-né asymptomatique ± SP‡
Nouveau-né légèrement symptomatique ± SP
Nouveau-né présentant des symptômes modérés à graves ± SP
Cas probable§ : Test de référence positif* après 3 semaines de vie PLUS manifestations caractéristiques du CMV (tableau 2)
Quels nouveau-nés devraient être dirigés vers un infectiologue?
Quels cas devraient être traités?
Quel est le traitement recommandé?
En quoi le suivi consiste-t-il?
|
|
*Le test de référence désigne la PCR CMV ou la culture virale du CMV à partir de l’urine OU la PCR CMV à partir de la salive chez les nouveau-nés non allaités. Un résultat positif à la PCR CMV à partir de la salive doit être confirmé par un test positif au CMV dans l’urine chez les nouveau-nés allaités. |
L’infection asymptomatique
À l’heure actuelle, il n’y a pas de données probantes pour appuyer l’antivirothérapie contre l’infection à CMV asymptomatique sans SP. Cependant, les nouveau-nés asymptomatiques ont besoin d’une évaluation audiologique régulière et doivent être dirigés rapidement en otorhinolaryngologie s’ils présentent une SP. Les experts n’ont pas tous le même avis au sujet du traitement des nouveau-nés infectés ayant une SP isolée [11][37]. Pour formuler des recommandations définitives, il faudra attendre les résultats d’études en cours, mais selon les données d’observation actuelles, il y aurait des avantages à l’utiliser [54].
L’infection bénigne
Une infection à CMV bénigne se caractérise par des anomalies transitoires ou mineures touchant un ou deux systèmes, sans atteinte du système nerveux central. La prise en charge des cas d’infection à CMV bénigne chez qui on confirme une SP par la suite doit inclure une consultation en infectiologie [11][37]. La prise en charge peut être personnalisée, en tenant compte de la présence ou de la gravité de la SP [11][27] (figure 2).
L’infection modérée à grave
Tous les cas d’infection à CMV modérée à grave (définis au tableau 4) [53] doivent être dirigés rapidement vers un infectiologue. Les données tirées de deux études soutiennent l’antivirothérapie des nouveau-nés très symptomatiques [55][56]. L’étude la plus récente a fait état d’un meilleur pronostic neurodéveloppemental et auditif chez les nouveau-nés ayant reçu un traitement pendant plus de six mois plutôt que six semaines [56]. Le valganciclovir par voie orale doit être administré pendant six mois. Le ganciclovir par voie parentérale peut le remplacer pendant les deux à six premières semaines du traitement, lorsque le nouveau-né est très malade [5][57].
La neutropénie [29], la thrombopénie, la transaminite et les taux élevés d’urée et de créatinine font partie des effets indésirables de l’antivirothérapie. Pendant le traitement, les nouveau-nés doivent faire l’objet d’une surveillance sérielle des effets indésirables (tableau 4). Il n’y a pas de données probantes pour soutenir la surveillance systématique de la charge virale, qui n’est pas toujours corrélée avec la réponse au traitement [28][56].
Le suivi et la surveillance des séquelles (tableau 4)
En plus de l’évaluation auditive et neurodéveloppementale continue et du suivi ophtalmologique [2][58], il peut être nécessaire d’assurer un suivi dentaire étroit. Jusqu’à 40 % des enfants atteints d’une infection à CMV symptomatique présentent une hypoplasie de l’émail [59][60]. Des données probantes s’accumulent pour démontrer une forte prévalence de dysfonction vestibulaire chez les enfants atteints d’une icCMV, même s’ils n’ont pas de SP, ce qui indique que l’ergothérapie pourrait aussi être bénéfique [61].
La SP progressive à apparition tardive se déclare à l’âge médian de 27 mois, mais elle peut se manifester jusqu’à l’âge de 44 mois [30]. Il faut procéder à des évaluations sérielles et régulières de l’audition jusqu’à l’âge de quatre à cinq ans [30]. Les enfants qui présentent une atteinte importante du système nerveux central peuvent avoir des convulsions, une paralysie cérébrale et un retard intellectuel (tableau 5) [17][62]-[64]. Ils ont besoin d’un suivi neurodéveloppemental et d’un soutien multidisciplinaire approprié.
| Tableau 5. Séquelles neurodéveloppementales, auditives et visuelles chez les nouveau-nés atteints d’une infection congénitale à cytomégalovirus symptomatique | |
| Fréquence (en %) chez les nouveau-nés symptomatiques à la naissance | |
| Séquelles de quelque nature que ce soit | de 36 à 90 |
| Microcéphalie | de 35 à 40 |
| Déficits moteurs importants | de 15 à 25 |
| Déficit neurodéveloppemental | 42 |
| Déficits cognitifs | de 50 à 70 |
| Convulsions | de 15 à 20 |
| SP de quelque nature que ce soit | de 27 à 69 |
| SP unilatérale | 19 |
| SP bilatérale | 50 |
| Anomalies oculaires | de 25 à 50 |
| Déficience visuelle | de 22 à 58 |
|
Données tirées des références [1][6][7][9][10][16] [31][62]-[64] |
|
Conclusion
L’icCMV est la principale cause de SP d’origine non génétique et une cause importante d’atteinte neurodéveloppementale et neurosensorielle. Les mesures d’hygiène de base sont d’une grande efficacité dans la prévention de l’infection chez la mère et doivent être préconisées dans le cadre des soins prénatals. Il est essentiel de détecter les nouveau-nés atteints d’une icCMV en laboratoire avant 21 jours de vie pour déterminer la gravité de l’infection et entreprendre une antivirothérapie dans les cas modérés à graves. Tous les nouveau-nés atteints d’une icCMV symptomatique et les nouveau-nés asymptomatiques présentant une déficience auditive isolée doivent être dirigés vers en infectiologie. Lorsque la situation l’indique, il est démontré qu’un traitement par le valganciclovir, entrepris pendant la période néonatale et administré pendant six mois, améliore l’audition et le pronostic développemental. Les nouveau-nés touchés ont besoin d’un suivi multidisciplinaire. Les futures recherches devraient porter sur le dépistage des nouveau-nés, les résultats du traitement chez les enfants atteints d’une SP isolée ou d’une infection bénigne, la mise au point d’un vaccin contre le CMV et les stratégies diagnostiques et pronostiques.
Addenda
Depuis l’écriture des présentes directives, de nouvelles données probantes sur le traitement antiviral du cytomégalovirus congénital associé à une surdité de perception ont émergé [66]. Même si la récente étude citée ci-dessous n’a pas été randomisée et est limitée par son faible échantillonnage, elle a établi qu’un traitement au valganciclovir par voie orale entrepris avant l’âge de 13 semaines de vie chez les nourrissons atteints du cytomégalovirus congénital était associé à un meilleur pronostic auditif à l’âge de 18 à 22 mois. D’après ces résultats, tant les directives européennes [66] qu’américaines [67] préconisent un traitement au valganciclovir pendant six semaines chez les nourrissons de moins de trois mois atteints d’un cytomégalovirus congénital associé à une surdité de perception. En cas de cytomégalovirus aux symptômes modérés à graves, de choriorétinite ou de maladie du système nerveux central, le traitement devrait être entrepris le plus rapidement possible, mais pourrait l’être jusqu’à 13 semaines de vie [67].
Remerciements
Les auteurs remercient le docteur Soren Gantt (Université de la Colombie-Britannique, B.C. Children’s Hospital Research Institute) et la docteure Wendy Vaudry (Université de l’Alberta, Stollery Children’s Hospital), qui ont révisé le présent point de pratique. Le comité d’étude du fœtus et du nouveau-né, le comité de la pédiatrie communautaire, le comité de la pharmacologie et le comité de la santé mentale et des troubles du développement de la Société canadienne de pédiatrie l’ont également révisé.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres : Michelle Barton MD; A. Michael Forrester MD (membre sortant); Ruth Grimes MD (représentante du conseil); Nicole Le Saux MD (présidente); Laura Sauve MD; Karina Top MD
Représentants : Tobey Audcent MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Sean Bitnun MD; Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida; Fahamia Koudra MD, Le Collège des médecins de famille du Canada; Marc Lebel MD, Programme canadien de surveillance active de l’immunisation (IMPACT); Yvonne Maldonado MD, comité des maladies infectieuses, American Academy of Pediatrics; Jane McDonald MD, Association pour la microbiologie médicale et l’infectiologie Canada; Dorothy L. Moore MD, Comité consultatif national de l’immunisation; Howard Njoo MD, Agence de la santé publique du Canada
Conseillère : Noni E. MacDonald MD
Auteurs principaux : Michelle Barton MD, A. Michael Forrester MD, Jane McDonald MD
Mise à jour en janvier 2025 : Michelle Barton MD, Ari Bitnun MD
Références
- Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol 2007;17(4):253–76.
- Vaudry W, Lee BE, Rosychuk RJ. Congenital cytomegalovirus infection in Canada: Active surveillance for cases diagnosed by paediatricians. Paediatr Child Health 2014;19(1):e1-5.
- Lanzieri TM, Dollard SC, Bialek SR, Grosse SD. Systematic review of the birth prevalence of congenital cytomegalovirus infection in developing countries. Int J Infect Dis 2014;22:44–8.
- Pass RF, Arav-Boger R. Maternal and fetal cytomegalovirus infection: Diagnosis, management, and prevention. F1000Res 2018;7:255.
- Gantt S, Bitnun A, Renaud C, Kakkar F, Vaudry W. Diagnosis and management of infants with congenital cytomegalovirus infection. Paediatr Child Health 2017;22(2):72–4.
- Pass RF, Fowler KB, Boppana SB, Britt WJ, Stagno S. Congenital cytomegalovirus infection following first trimester maternal infection: Symptoms at birth and outcome. J Clin Virol 2006;35(2):216–20.
- Dollard SC, Grosse SD, Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Rev Med Virol 2007;17(5): 355–63.
- Lopez AS, Lanzieri TM, Claussen AH et coll. Intelligence and academic achievement with asymptomatic congenital cytomegalovirus infection. Pediatrics 2017;140(5):pii:e20171517.
- Soper DE. Congenital cytomegalovirus infection: An obstetrician’s point of view. Clin Infect Dis 2013; 57 Suppl 4:S171-3.
- Simonazzi G, Curti A, Cervi F et coll. Perinatal outcomes of non-primary maternal cytomegalovirus infection: A 15-year experience. Fetal Diagn Ther 2018;43(2): 138–42.
- Rawlinson WD, Boppana SB, Fowler KB et coll. Congenital cytomegalovirus infection in pregnancy and the neonate: Consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis 2017;17(6): e177–88.
- Yamamoto AY, Mussi-Pinhata MM, Boppana SB et coll. Human cytomegalovirus reinfection is associated with intrauterine transmission in a highly cytomegalovirus-immune maternal population. Am J Obstet Gynecol 2010;202(3):297.e1-8.
- Wang C, Zhang X, Bialek S, Cannon MJ. Attribution of congenital cytomegalovirus infection to primary versus non-primary maternal infection. Clin Infect Dis 2011;52(2):e11-3.
- Britt W. Controversies in the natural history of congenital human cytomegalovirus infection: The paradox of infection and disease in offspring of women with immunity prior to pregnancy. Med Microbiol Immunol 2015;204(3):263–71.
- Britt WJ. Congenital human cytomegalovirus infection and the enigma of maternal immunity. J Virol 2017;91(15):pii:e02392-16.
- van Zuylen WJ, Hamilton ST, Naing Z, Hall B, Shand A, Rawlinson WD. Congenital cytomegalovirus infection: Clinical presentation, epidemiology, diagnosis and prevention. Obstet Med 2014;7(4):140–6.
- Friedman S, Ford-Jones EL. Congenital cytomegalovirus infection – An update. Paediatr Child Health 1999;4(1):35–8.
- Cannon MJ, Hyde TB, Schmid DS. Review of cytomegalovirus shedding in bodily fluids and relevance to congenital cytomegalovirus infection. Rev Med Virol 2011;21(4):240-55.
- Revello MG, Lazzarotto T, Guerra B et coll. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med 2014;370(14):1316–26.
- Blázquez-Gamero D, Galindo Izquierdo A, Del Rosal T et coll. Prevention and treatment of fetal cytomegalovirus infection with cytomegalovirus hyperimmune globulin: A multicenter study in Madrid. J Matern Fetal Neonatal Med 2019;32(4):617-25.
- Seidel V, Feiterna-Sperling C, Siedentopf JP et coll. Intrauterine therapy of cytomegalovirus infection with valganciclovir: Review of the literature. Med Microbiol Immunol 2017;206(5):347–54.
- Pass RF, Zhang C, Evans A et coll. Vaccine prevention of maternal cytomegalovirus infection. N Engl J Med 2009;360(12):1191–9.
- Vauloup-Fellous C, Picone O, Cordier AG et coll. Does hygiene counseling have an impact on the rate of CMV primary infection during pregnancy? Results of a 3-year prospective study in a French hospital. J Clin Virol 2009;46 Suppl 4:S49-53.
- Adler SP, Finney JW, Manganello AM, Best AM. Prevention of child-to-mother transmission of cytomegalovirus among pregnant women. J Pediatr 2004;145(4):485–91.
- Centers for Disease Control and Prevention. CMV Fact Sheet for Pregnant women and Parents. Septembre 2018. www.cdc.gov/cmv/fact-sheets/parents-pregnant-women.html (consulté le 6 février 2019).
- Boppana SB, Pass RF, Britt WJ, Stagno S, Alford CA. Symptomatic congenital cytomegalovirus infection: Neonatal morbidity and mortality. Pediatr Infect Dis J 1992;11(2):93–9.
- Demmler GJ. Screening for congenital cytomegalovirus infection: A tapestry of controversies. J Pediatr 2005;146(2):162–4.
- Ross SA, Novak Z, Fowler KB, Arora N, Britt WJ, Boppana SB. Cytomegalovirus blood viral load and hearing loss in young children with congenital infection. Pediatr Infect Dis J 2009;28(7):588–92.
- Amir J, Wolf DG, Levy I. Treatment of symptomatic congenital cytomegalovirus infection with intravenous ganciclovir followed by long-term oral valganciclovir. Eur J Pediatr 2010;169(9):1061–7.
- Fowler KB. Congenital cytomegalovirus infection: Audiologic outcome. Clin Infect Dis 2013;57 Suppl 4: S182-4.
- Coats DK, Demmler GJ, Paysse EA, Du LT, Libby C. Ophthalmologic findings in children with congenital cytomegalovirus infection. J AAPOS 2000;4(2):110-6.
- Hebbal P, Russell BK, Akande T, Niazi M, Hagmann SH, Purswani MU. Disseminated congenital cytomegalovirus infection presenting as severe sepsis in a preterm neonate. J Pediatr 2016;170:339-e1.
- Rai N, Thakur N. Congenital CMV with LAD type 1 and NK cell deficiency. J Pediatr Hematol Oncol 2013;35(6):468-9.
- Irizarry K, Honigbaum S, Demmler-Harrison G, Rippel S, Wilsey M. Successful treatment with oral valganciclovir of primary CMV enterocolitis in a congenitally infected infant. Fetal Pediatr Pathol 2011;30(6):437-41.
- Lee-Yoshimoto M, Goishi K, Torii Y et coll. Congenital cytomegalovirus pneumonitis and treatment response evaluation using viral load during ganciclovir therapy: A case report. Jpn J Infect Dis 2018;71(4):309-11.
- Ross SA, Novak Z, Pati S, Boppana SB. Overview of the diagnosis of cytomegalovirus infection. Infect Disord Drug Targets 2011;11(5):466–74.
- Luck SE, Wieringa JW, Blázquez-Gamero D et coll. Congenital cytomegalovirus: A European expert consensus statement on diagnosis and management. Pediatr Infect Dis J 2017; 36(12):1205–13.
- Bilavsky E, Watad S, Levy I et coll. Positive IgM in congenital CMV infection. Clin Pediatr (Phila) 2017;56(4):371–5.
- Revello MG, Gerna G. Diagnosis and management of human cytomegalovirus infection in the mother, fetus, and newborn infant. Clin Microbiol Rev 2002;15(4):680-715.
- Balcarek KB, Warren W, Smith RJ, Lyon MD, Pass RF. Neonatal screening for congenital cytomegalovirus infection by detection of virus in saliva. J Infect Dis 1993;167(6):1433–6.
- Boppana SB, Ross SA, Shimamura M et coll. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med 2011;364(22):2111–8.
- Ross SA, Ahmed A, Palmer AL et coll. Detection of congenital cytomegalovirus infection by real-time polymerase chain reaction analysis of saliva or urine specimens. J Infect Dis 2014;210(9):1415–8.
- Boppana SB, Ross SA, Novak Z et coll. Dried blood spot real-time polymerase chain reaction assays to screen newborns for congenital cytomegalovirus infection. JAMA 2010;303(14):1375–82.
- Vives-Oñós I, Codina-Grau MG, Noguera-Julian A et coll. Is polymerase chain reaction in neonatal dried blood spots reliable for the diagnosis of congenital cytomegalovirus infection? Pediatr Infect Dis J 2018;38(5):520-4.
- Wang L, Xu X, Zhang H, Qian J, Zhu J. Dried blood spots PCR assays to screen congenital cytomegalovirus infection: A meta-analysis. Virol J 2015;12:60.
- Soetens O, Vauloup-Fellous C, Foulon I et coll. Evaluation of different cytomegalovirus (CMV) DNA PCR protocols for analysis of dried blood spots from consecutive cases of neonates with congenital CMV infections. J Clin Microbiol 2008;46(3):943–6.
- Dépistage néonatal Ontario. Hearing Screening FAQ. https://newbornscreening.on.ca/en/page/hearing-screening-faq (consulté le 7 février 2020).
- Ari-Even Roth D, Lubin D, Kuint J et coll. Contribution of targeted saliva screening for congenital CMV-related hearing loss in newborns who fail hearing screening. Arch Dis Child Fetal Neonatal Ed 2017;102(6):F519-24.
- Schleiss MR. Congenital cytomegalovirus: Impact on child health. Contemp Pediatr 2018;35(7):16-24.
- Goycochea-Valdivia WA, Baquero-Artigao F, Del Rosal T et coll. Cytomegalovirus DNA detection by polymerase chain reaction in cerebrospinal fluid of infants with congenital infection: Associations with clinical evaluation at birth and implications for follow-up. Clin Infect Dis 2017;64(10):1335-42.
- Giannattasio A, Bruzzese D, Di Costanzo P et coll. Neuroimaging profiles and neurodevelopmental outcome in infants with congenital cytomegalovirus infection. Pediatr Infect Dis J 2018;37(10):1028-33.
- de Vries LS, Gunardi H, Barth PG, Bok LA, Verboon-Maciolek MA, Groenendaal F. The spectrum of cranial imaging and magnetic resonance imaging abnormalities in congenital cytomegalovirus infection. Neuropediatrics 2004;35(2):113-9.
- Kadambari S, Williams EJ, Luck S, Griffiths PD, Sharland M. Evidence-based guidelines for the detection and treatment of congenital CMV. Early Hum Dev 2011;87(11):723-8.
- Pasternak Y, Ziv L, Attias J, Amir J, Bilavsky E. Valganciclovir is beneficial in children with congenital cytomegalovirus and isolated hearing loss. J Pediatr 2018;199:166-70.
- Kimberlin DW, Lin CY, Sánchez PJ et coll. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial. J Pediatr 2003;143(1):16-25.
- Kimberlin DW, Jester PM, Sánchez PJ et coll. Valganciclovir for symptomatic congenital cytomegalovirus disease. N Engl J Med 2015;372(10):933-43.
- American Academy of Pediatrics. Cytomegalovirus Infection. In: Kimberlin DW, Brady M, Jackson MA, Long S, éd. Red Book 2018-2021: Report of the Committee on Infectious Disease, 31e éd. Itasca, IL: American Academy of Pediatrics, 2018.
- Boppana S, Amos C, Britt W, Stagno S, Alford C, Pass R. Late onset and reactivation of chorioretinitis in children with congenital cytomegalovirus infection. Pediatr Infect Dis J 1994;13(12):1139-42.
- Stagno S, Pass RF, Thomas JP, Navia JM, Dworsky ME. Defects of tooth structure in congenital cytomegalovirus infection. Pediatrics 1982;69(5):646-8.
- Stagno S, Pass RF, Dworsky ME, Britt WJ, Alford CA. Congenital and perinatal cytomegalovirus infections: Clinical characteristics and pathogenic factors. Birth Defects Orig Artic Ser 1984;20(1):65-85.
- Bernard S, Wiener-Vacher S, Van Den Abbeele T, Teissier N. Vestibular disorders in children with congenital cytomegalovirus infection. Pediatrics 2015;136(4):e887-95.
- Dreher AM, Arora N, Fowler KB et coll. Spectrum of disease and outcome in children with symptomatic congenital cytomegalovirus infection. J Pediatr 2014;164(4):855-9.
- Jin HD, Demmler-Harrison GJ, Coats DK et coll. Long-term visual and ocular sequelae in patients with congenital cytomegalovirus infection. Pediatr Infect Dis J 2017;36(9):8777-882.
- Schleiss MR. Congenital cytomegalovirus infection: Update on management strategies. Curr Treat Options Neurol 2008;10(3):186-92.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


