Point de pratique
Le traitement pharmacologique des crises migraineuses aiguës chez les enfants et les adolescents qui consultent à l’urgence
Affichage : le 12 décembre 2025
Auteur(s) principal(aux)
Sarah Rogers MDCM, Serena L. Orr MD, Brigitte Parisien MD, Laurel Chauvin-Kimoff MD; Société canadienne de pédiatrie, Comité des soins aigus
Résumé
Le présent point de pratique s’applique aux enfants et aux adolescents qui consultent à l’urgence à cause d’une migraine aiguë. Les recommandations actuelles de prise en charge tirées d’études pertinentes sont résumées en vue de réduire les variations aux pratiques des professionnels de la santé et d’éviter les préjudices potentiels aux patients. La métoclopramide est le traitement de première intention des crises migraineuses aiguës, tandis que les blocs des grands nerfs occipitaux et la lidocaïne par voie intranasale peuvent être utilisés en deuxième intention. Les opioïdes sont à éviter pour le traitement de la migraine.
Mots-clés : céphalée; médecine d’urgence pédiatrique; migraine
Contexte
Les céphalées sont courantes à l’urgence, et les migraines représentent 30 % des consultations pédiatriques et suscitent de fréquentes reconsultations[1][2]. Environ 15 % de ces patients sont hospitalisés pour contrôler leurs symptômes[3]. La migraine, qui touche 10 % des enfants et des adolescents, se déclare en moyenne à l’âge de 12 ans et surtout chez les filles[4]-[8]. Elle a des effets importants sur la vie sociale, scolaire et personnelle[9]-[11].
Malgré leur prévalence, les données probantes sur la prise en charge des crises migraineuses à l’urgence pédiatrique sont limitées, et les pratiques varient beaucoup d’un centre à l’autre[8][12].
La portée du présent point de pratique inclut le traitement pharmacologique à l’urgence des crises migraineuses modérées à graves chez les enfants et les adolescents qui ne répondent pas aux traitements à domicile (acétaminophène, ibuprofène ou triptan).
Définition
Les critères diagnostiques de la troisième édition de la Classification internationale des céphalées (ICHD-3) pour la migraine sans aura chez les enfants et les adolescents[13] s’établissent comme suit :
- Au moins cinq crises répondant aux critères B-D
- Crises de céphalée durant deux à 72 heures (sans traitement ou avec un traitement inefficace)
- Céphalée ayant au moins deux des quatre caractéristiques suivantes :
- topographie frontotemporale unilatérale ou bilatérale
- type pulsatile
- douleur d’intensité modérée ou sévère
- aggravée par ou entraînant l’évitement de l’activité physique quotidienne (par ex., marche ou montée des escaliers)
- Durant la céphalée, au moins l’un des symptômes suivants :
- nausées et/ou vomissements
- photophobie et phonophobie
- N’est pas mieux expliquée par un autre diagnostic de l’ICHD-3
Données probantes pour le traitement de la douleur causée par des crises migraineuses aiguës
Les antagonistes de la dopamine
Le métoclopramide améliore à la fois les scores de douleur et les symptômes de nausées et de vomissements lors des crises migraineuses aiguës[14]. Une étude randomisée et contrôlée (ÉRC, n=53) réalisée dans une urgence pédiatrique a évalué le métoclopramide par voie intraveineuse (IV) pour le traitement des crises migraineuses chez les enfants et comparé la monothérapie à une polythérapie incluant du kétolorac IV[15]. L’étude n’a relevé aucune différence significative entre les deux traitements pour tout ce qui est de la réduction de la douleur. Une ÉRC croisée à double insu dans deux urgences pédiatriques (n=62) a établi que la prochlorpérazine IV était efficace chez 84,4 % des patients, par rapport à 55,2 % de ceux qui prenaient du kétorolac IV[16]. Le métoclopramide et la prochlorpérazine n’ont pas fait l’objet de comparaison directe chez les jeunes, mais semblent tous deux procurer un soulagement efficace de la douleur. La prochlorpérazine IV n’est pas homologuée au Canada.
Le kétorolac
Dans les études, le kétorolac IV n’était pas supérieur à la prochlorpérazine IV[14] ou à une combinaison avec le métoclopramide pour mieux soulager la douleur[15]. Une étude à double insu de non-infériorité pédiatrique (n=53) n’a révélé aucune différence entre l’administration de kétorolac par voie intranasale ou intraveineuse pour atténuer la douleur au bout de 60 minutes[17]. Aucune étude ne compare le kétorolac à un placebo.
Les solutions cristalloïdes par voie intraveineuse
Une analyse post-hoc de quatre études sur la migraine à l’urgence effectuée auprès de 570 patients qui avaient reçu du métoclopramide IV a démontré que l’ajout d’une solution IV n’atténuait pas la douleur des crises migraineuses[18].
Une ÉRC à simple insu réalisée dans une urgence pédiatrique (n=47) a mis à l’essai un bolus de 10 mL/kg de solution de chlorure de sodium 0,9 % pour le traitement de la migraine[19]. L’étude n’a établi aucune différence clinique significative pour le soulagement de la douleur après le traitement pharmacologique ou l’administration d’une solution de chlorure de sodium 0,9 % IV utilisée seule.
L’ibuprofène et l’acétaminophène
Deux ÉRC pédiatriques à double insu ont porté sur l’utilisation de ces médicaments pour soulager les crises migraineuses aiguës chez les enfants et les adolescents[20][21]. L’ibuprofène à une dose de 7,5 mg/kg était supérieur à un placebo pour réduire les scores de douleur au bout de 120 minutes[21]. Une ÉRC croisée incluant 10 mg/kg d’ibuprofène, 15 mg/kg d’acétaminophène et un placebo ont établi la supériorité de l’ibuprofène sur l’acétaminophène pour réduire les scores de douleur chez les enfants[20].
Les triptans
Selon des données probantes homogènes, les triptans sont supérieurs à un placebo, mais la plupart des études pédiatriques ont été effectuées auprès de patients ambulatoires ou de petits nombres de sujets[22]-[25]. De multiples études ont établi que les triptans sont moins efficaces après les deux premières heures de la crise ou lorsque la douleur a atteint une certaine gravité[25]-[27]. Ainsi, la plupart des patients qui consultent à l’urgence sont peu susceptibles de répondre aux critères du traitement aux triptans.
La lidocaïne par voie intranasale
Une étude pilote (n=32) sur la lidocaïne en vaporisation intranasale pour traiter les crises migraineuses aiguës chez les enfants fait foi de la tolérabilité de ce médicament et de la possibilité de l’utiliser à l’urgence, mais ne comptait pas assez de sujets pour en confirmer l’efficacité[28]. Une méta-analyse de six ÉRC chez des adultes a démontré que la lidocaïne par voie intranasale atténuait l’intensité de la douleur au bout de cinq et 15 minutes, améliorait les taux de soulagement et réduisait le recours aux médicaments de sauvetage. Cependant, ces avantages diminuaient lors de l’administration d’un antiémétique[29].
L’acide valproïque
Une méta-analyse de sept ÉRC a évalué le rôle de l’acide valproïque IV chez les adultes et révélé qu’elle était inférieure à la prochlorpérazine, au métoclopramide et au kétorolac[30]. Des études observationnelles chez les enfants ont établi la tolérabilité de ce médicament et confirmé qu’il réduisait la douleur lorsqu’il était utilisé en deuxième intention pour le traitement des migraines pédiatriques[31]-[33]. L’acide valproïque IV est réglementé par le Programme d’accès spécial de Santé Canada. Il n’est pas homologué pour les crises migraineuses et n’est pas recommandé à l’urgence.
Le magnésium
Une analyse systématique de sept ÉRC auprès d’adultes a démontré que le sulfate de magnésium IV améliorait le contrôle de la douleur, réduisait la durée des auras et limitait le besoin d’analgésie de sauvetage pour les crises migraineuses[34]. Cependant, selon une ÉRC, le sulfate de magnésium IV réduisait l’efficacité du métoclopramide IV lorsque leur utilisation était combinée[35]. Dans une série de cas pédiatriques à l’urgence, il entraînait peu d’effets secondaires, mais son efficacité pour réduire les symptômes de migraine demeure non concluante[36].
Les blocs des grands nerfs occipitaux
Dans les directives sur le traitement de la migraine chronique (plus de 15 jours de céphalée par mois)[37] chez l’adulte, les blocs des grands nerfs occipitaux font l’objet d’une faible recommandation. Une récente ÉRC à double insu (n=64) a comparé l’injection de lidocaïne au niveau des grands nerfs occipitaux à l’injection d’une solution placebo de chlorure de sodium 0,9 %, chez des enfants et des adolescents atteints de crises migraineuses intenses qui ne répondaient pas aux traitements habituels[38]. Le groupe qui a reçu l’injection de lidocaïne a présenté une diminution moyenne de la douleur de 2,3 points (sur dix) et celui qui a reçu une solution de chlorure de sodium 0,9 %, une diminution moyenne de 1,1 point (p=0,01) au bout de 30 minutes, ce qui en confirme la supériorité par rapport à un placebo.
Les opioïdes
Une étude du traitement de la céphalée chez les adultes à l’urgence a révélé une augmentation importante de l’utilisation d’opioïdes entre 2001 (20,6 %) et 2010 (35 %)[39], malgré leur absence d’efficacité pour le traitement des crises migraineuses aiguës[40]. Les opioïdes sont encore utilisés pour traiter les enfants et les adolescents qui consultent à l’urgence en raison de crises migraineuses, mais sont associés à des hospitalisations plus longues, à des réadmissions et à de nouvelles consultations à l’urgence[41]-[43]. Les opioïdes ne sont pas recommandés, car ils ne sont pas efficaces et ont le potentiel de causer des préjudices.
Les données probantes pour le traitement des nausées et des vomissements en cas de crises migraineuses aiguës
Selon une étude de cohorte rétrospective, l’ondansétron peut être utile pour le traitement des nausées et des vomissements découlant de crises migraineuses aiguës et donne des résultats semblables aux antagonistes de la dopamine comme le métoclopramide[44]. Cependant, aucune étude n’a démontré que l’ajout d’ondansétron au métoclopramide pour traiter la migraine aiguë soulage la nausée davantage que le métoclopramide seul. Il est peu probable que l’ajout d’ondansétron au métoclopramide pour soulager les douleurs céphaliques comporte des avantages pour le traitement de la nausée.
La prévention
Les stéroïdes
L’utilisation de stéroïdes est controversée pour prévenir la récurrence de migraines après un traitement aigu chez les enfants et les adolescents. Une vaste analyse systématique chez des adultes en appuyait l’utilisation chez les patients ambulatoires ou à l’urgence[45], et d’autres analyses systématiques appuient la prise de dexaméthasone, car elle est bien tolérée et efficace pour prévenir les récurrences de migraine[46]-[49]. D’après une étude rétrospective chez des patients pédiatriques ayant des migraines réfractaires, l’ajout de stéroïdes au traitement aigu ne réduisait pas les récurrences de migraine de manière significative[50].
Les nutraceutiques
La riboflavine, la coenzyme Q10 et le magnésium sont recommandés dans les directives sur la prévention de la migraine chez les adultes[51]. Tous ces produits sont liés à certaines données probantes de faible qualité pour la prévention de la migraine chez les enfants et les adolescents[52]-[60].
Points de pratique exemplaires
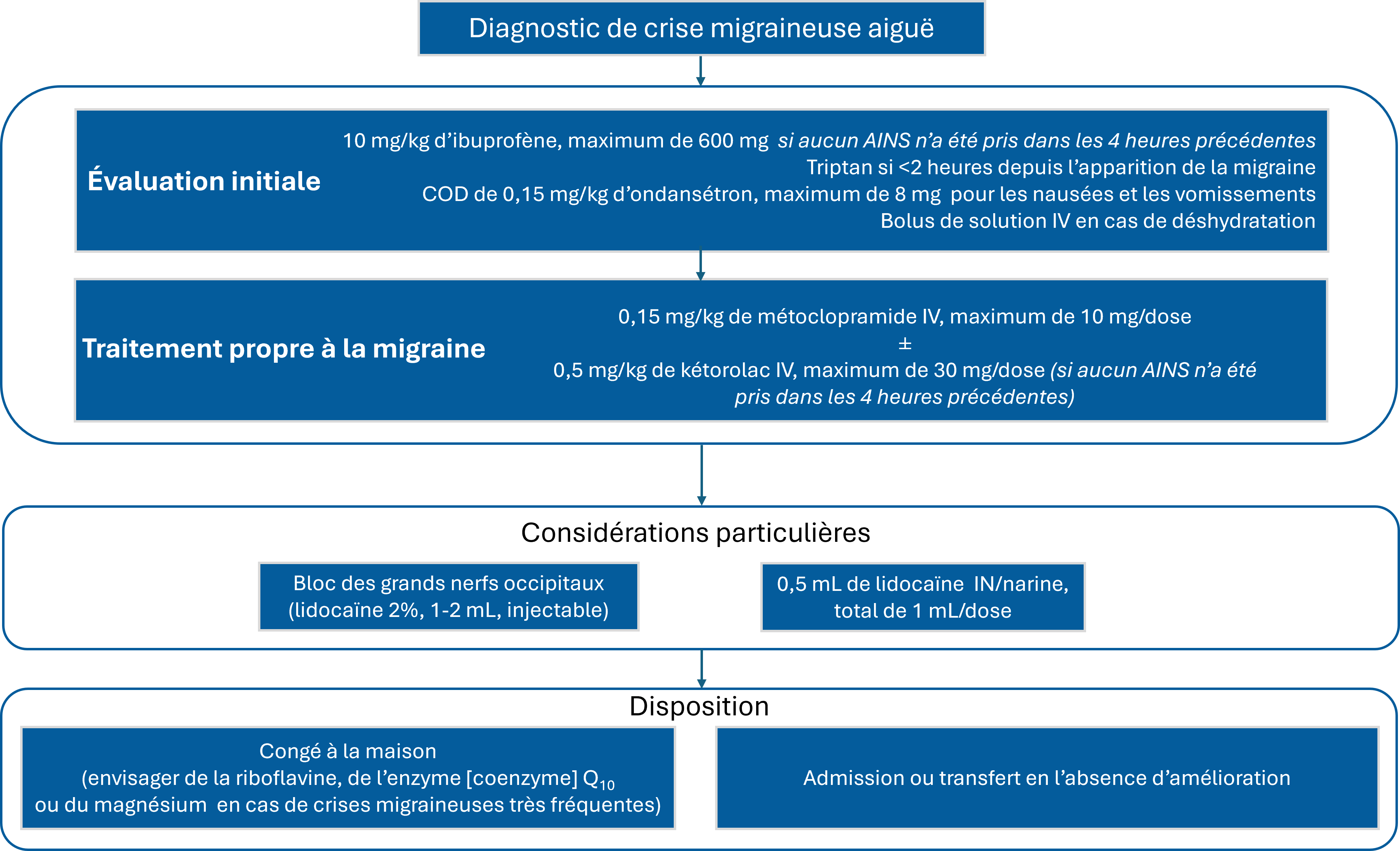
- La prise en charge initiale de la migraine aiguë peut inclure l’ibuprofène, un triptan (si la personne consulte dans les deux heures suivant le début de la crise) et un antiémétique par voie orale (ondansétron), selon le tableau clinique initial du patient.
- Les cliniciens devraient administrer des liquides par voie intraveineuse (IV) en fonction de l’hydratation du patient.
- Le métoclopramide IV est l’approche recommandée chez les patients pédiatriques atteints d’une crise migraineuse qui consultent à l’urgence.
- D’après des données pédiatriques limitées, le kétorolac n’ajoute peut-être pas d’avantages à la monothérapie au métoclopramide.
- Les blocs des grands nerfs occipitaux et la lidocaïne par voie intranasale sont des possibilités de traitement de deuxième intention, et leur utilisation dépend des compétences cliniques et des préférences du patient.
- L’acide valproïque IV, le sulfate de magnésium IV et les opioïdes ne sont pas des traitements recommandés pour les crises migraineuses.
- Les données au sujet de l’utilisation de dexaméthasone pour prévenir la récurrence de migraine sont insuffisantes, mais la riboflavine, la coenzyme Q10 et le magnésium par voie orale peuvent être utilisés en prophylaxie chez les jeunes patients qui font de fréquentes crises.
Conclusion
Les crises migraineuses sont courantes chez les enfants et les adolescents qui consultent à l’urgence. Étant donné le peu de données probantes en pédiatrie, les traitements reposent souvent sur des données chez les adultes. Des données probantes de haute qualité s’imposent pour améliorer le traitement des jeunes patients qui consultent à cause d’une migraine.
Figure 1. Algorithme de traitement
AINS anti-inflammatoire non stéroïdien; COD comprimés orodispersibles; coQ10 coenzyme Q10; kg kilogramme; IN par voie intranasale; IV par voie intraveineuse; mg milligramme; mL millilitre
| Tableau 1. Posologies | ||||
| Nom du médicament | Posologie | Effets indésirables | ||
| Médicaments par voie intraveineuse | ||||
| Métoclopramide |
0,15 mg/kg/dose IV; dose maximale : 10 mg Perfusion IV administrée pendant 15 à 30 minutes |
Réactions dystoniques, dyskinésie tardive, akathisie, somnolence, diarrhée | ||
| Kétorolac |
0,5 mg/kg/dose; dose maximale : 30 mg/dose Bolus IV sur 1 à 5 minutes |
Douleur abdominale, somnolence, étourdissements | ||
| Médicaments par voie intranasale | ||||
| Solution de lidocaïne 2 % | Dose habituelle de 20 mg (1 mL de lidocaïne 2 % par dose) 0,5 mL dans chaque narine. Utiliser un appareil de vaporisation pour les muqueuses nasales | Irritation nasale, épistaxis | ||
| Blocs nerveux | ||||
| Solution de lidocaïne 2 % | 2 injections (de 1 mL à 2 mL) dans les grands nerfs occipitaux droit et gauche | Saignement, douleur au foyer de l’injection, infiltration dans le nerf, paresthésie, engourdissement, toxicité systémique d’un anesthésique local | ||
| Médicaments par voie orale | ||||
| Ibuprofène | 10 mg/kg/dose, maximum de 600 mg | |||
| Ondansétron | Dose habituelle de 0,15 mg/kg, jusqu’à concurrence de 8 mg par voie orale. Comprimé orodispersible favorisé |
Prolongation de l’intervalle QT Diarrhée |
||
| Prophylaxie | ||||
| Magnésium élémentaire | 9 mg/kg/jour de magnésium élémentaire divisés en 3 doses quotidiennes | Diarrhée | ||
| Coenzyme Q10 | 1 mg/kg/jour à 3 mg/kg/jour une fois par jour | Douleur abdominale | ||
| Vitamine B2 (riboflavine) | 50 mg à 400 mg une fois par jour | Urine jaune ou orange clair (sans danger) | ||
IV par voie intraveineuse; kg kilogramme; mg milligramme; mL millilitre
Renseignements pour les professionnels de la santé
TREKK : Dosage des médicaments : Migraine
Renseignements pour les parents
Français : Migraine Québec
Anglais : Migraine Canada
Remerciements
Le comité de la pédiatrie communautaire, le comité de la pharmacologie et les comités directeurs de la section de la médecine d’urgence pédiatrique et de la section de la pédiatrie hospitalière de la Société canadienne de pédiatrie ont révisé le présent point de pratique, de même que des représentants de la Canadian Headache Society (CHS). Il a également été parcouru et approuvé par des représentants de l’Association canadienne de neurologie pédiatrique (ACNP).
COMITÉ DES SOINS AIGUS DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2024-2025)
Membres : Kevin Chan MD MHP MBA B. Sc. (président), Tricia Feener MD (représentante du conseil), Jonathan Sniderman MD, Troy Turner MD, Brigitte Parisien MD, Tanvi Agarwal MD, Patrick Seitzinger MD (membre résident)
Représentantes : Melanie Buba MD (section de la pédiatrie hospitalière de la SCP), April Kam MD (section de la médecine d’urgence pédiatrique de la SCP)
Auteures principales : Sarah Rogers MDCM, Serena L. Orr MD, Brigitte Parisien MD, Laurel Chauvin-Kimoff MD
Conflits d’intérêts potentiels
La docteure Serena Orr déclare avoir reçu des redevances de Cambridge University Press et siège au comité de rédaction des revues Neurology et Headache et de l’American Migraine Foundation. Elle détient des subventions des Instituts de recherche en santé du Canada (IRSC) à titre de chercheuse principale de deux projets en cours, de même qu’une subvention de l’American Headache Society. Elleest également responsable d’une étude clinique sur la prise en charge de la migraine à l’urgence, financée par les IRSC. Elle reçoit des dispositifs expérimentaux de Theranica, Inc., qui ne joue pas d’autre rôle dans l’étude et n’a versé aucun autre fonds. Aucun autre auteur n’a de conflits d’intérêts à déclarer.
Financement
Aucun financement n’a été accordé pour la préparation du présent manuscrit.
Références
- Lewis DW. Headache in the pediatric emergency department. Semin Pediatr Neurol.2001;8(1):46–51. doi : 10.1053/spen.2001.23331
- Orr SL, Friedman BW, Dodick DW, éd. Emergency Headache: Diagnosis and Management. Cambridge, U.K.: Cambridge University Press; 2017.
- Perry MC, Yaeger SK, Toto RL, Suresh S, Hickey RW. A modern epidemic: Increasing pediatric emergency department visits and admissions for headache. Pediatr Neurol 2018;89:19–25.doi : 10.1016/j.pediatrneurol.2018.07.015
- Orr SL, Potter BK, Ma J, Colman I. Migraine and mental health in a population-based sample of adolescents. Can J Neurol Sci 2017;44(1):44–50. doi : 10.1017/cjn.2016.402
- Abu-Arafeh I, Razak S, Sivaraman B, Graham C. Prevalence of headache and migraine in children and adolescents: A systematic review of population-based studies. Dev Med Child Neurol 2010;52(12):1088–97. doi : 10.1111/j.1469-8749.2010.03793.x
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392(10159):1789–858. doi : 10.1016/S0140-6736(18)32279-7
- Stewart WF, Wood C, Reed ML, Roy J, Lipton RB; AMPP Advisory Group. Cumulative lifetime migraine incidence in women and men. Cephalalgia 2008;28(11):1170–8.doi : 10.1111/j.1468-2982.2008.01666.x
- Richer LP, Laycock K, Millar K et coll. Treatment of children with migraine in emergency departments: National practice variation study. Pediatrics 2010;126(1):e150-5. doi : 10.1542/peds.2009-2337
- Orr SL, Christie SN, Akiki S, McMillan HJ. Disability, quality of life, and pain coping in pediatric migraine: An observational study. J Child Neurol 2017;32(8):717–24. doi : 10.1177/0883073817702025
- Arruda MA, Bigal ME. Migraine and migraine subtypes in preadolescent children: Association with school performance. Neurology 2012;79(18):1881–8. doi : 10.1212/WNL.0b013e318271f812
- Vannatta K, Getzoff EA, Gilman DK et coll. Friendships and social interactions of school-aged children with migraine. Cephalalgia 2008;28(7):734–43. doi : 10.1111/j.1468-2982.2008.01583.x
- Patniyot IR, Gelfand AA. Acute treatment therapies for pediatric migraine: A qualitative systematic review. Headache 2016;56(1):49–70. doi : 10.1111/head.12746
- Comité de la classification des céphalées de la Société canadienne des céphalées (IHS). The International Classification of Headache Disorders, 3e édition. Cephalalgia 2018;38(1):1–211.doi : 10.1177/0333102417738202
- Ellis GL, Delaney J, DeHart DA, Owens A. The efficacy of metoclopramide in the treatment of migraine headache. Ann Emerg Med 1993;22(2):191–5.doi : 10.1016/s0196-0644(05)80201-x
- Richer LP, Ali S, Johnson DW, Rosychuk RJ, Newton AS, Rowe BH. A randomized trial of ketorolac and metoclopramide for migraine in the emergency department. Headache 2022;62(6):681–9. doi : 10.1111/head.14307
- Brousseau DC, Duffy SJ, Anderson AC, Linakis JG. Treatment of pediatric migraine headaches: A randomized, double-blind trial of prochlorperazine versus ketorolac. Ann Emerg Med 2004;43(2):256–62. doi : 10.1016/s0196-0644(03)00716-9
- Tsze DS, Lubell TR, Carter RC et coll. Intranasal ketorolac versus intravenous ketorolac for treatment of migraine headaches in children: A randomized clinical trial. Acad Emerg Med 2022;29(4):465–75. doi : 10.1111/acem.14422
- Balbin JEB, Nerenberg R, Baratloo A, Friedman BW. Intravenous fluids for migraine: A post hoc analysis of clinical trial data. Am J Emerg Med 2016;34(4):713–6. doi : 10.1016/j.ajem.2015.12.080
- Richer L, Craig W, Rowe B. Randomized controlled trial of treatment expectation and intravenous fluid in pediatric migraine. Headache 2014;54(9):1496–505. doi : 10.1111/head.12443
- Hämäläinen MJ, Hoppu K, Valkeila E, Santavuori P. Ibuprofen or acetaminophen for the acute treatment of migraine in children: A double-blind, randomized, placebo-controlled, crossover study. Neurology 1997;48(1):103–7. doi : 10.1212/wnl.48.1.103
- Lewis DW, Kellstein D, Dahl G et coll. Children’s ibuprofen suspension for the acute treatment of pediatric migraine. Headache2002;42(8):780–6.doi : 10.1046/j.1526-4610.2002.02180.x
- Lionetto L, Negro A, Casolla B, Simmaco M, Martelletti P. Sumatriptan succinate: Pharmacokinetics of different formulations in clinical practice. Expert Opin Pharmacother. 2012;13(16):2369–80. doi : 10.1517/14656566.2012.730041
- Ferrari MD, Roon KI, Lipton RB, Goadsby PJ. Oral triptans (serotonin 5-HT(1B/1D) agonists) in acute migraine treatment: A meta-analysis of 53 trials. Lancet 2001;358(9294):1668–75.doi : 10.1016/S0140-6736(01)06711-3
- Napoletano F, Lionetto L, Martelletti P. Sumatriptan in clinical practice: Effectiveness in migraine and the problem of psychiatric comorbidity. Expert Opin Pharmacother 2014;15(3):303–5. doi : 10.1517/14656566.2014.858120
- Cady RK, Munjal S, Cady RJ, Manley HR, Brand-Schieber E. Randomized, double-blind, crossover study comparing DFN-11 injection (3 mg subcutaneous sumatriptan) with 6 mg subcutaneous sumatriptan for the treatment of rapidly-escalating attacks of episodic migraine. J Headache Pain 2017;18(1):17–8. doi : 10.1186/s10194-016-0717-7
- Freitag FG, Finlayson G, Rapoport AM et coll. Effect of pain intensity and time to administration on responsiveness to almotriptan: Results from AXERT 12.5 mg Time Versus Intensity Migraine Study (AIMS). Headache 2007;47(4):519–30. doi : 10.1111/j.1526-4610.2007.00756.x
- Goadsby PJ, Zanchin G, Geraud G et coll. Early vs. non-early intervention in acute migraine—‘Act when Mild (AwM)’. A double-blind, placebo-controlled trial of almotriptan. Cephalalgia 2008;28(4):383–91. doi : 10.1111/j.1468-2982.2008.01546.x
- Maki K, Doan Q, Sih K, Stillwell K, Chun A, Meckler G. A randomized controlled pilot study of intranasal lidocaine in acute management of paediatric migraine and migraine-like headache. Paediatr Child Health 2022;27(6):340–5. doi : 10.1093/pch/pxac054
- Chi PW, Hsieh KY, Chen KY et coll. Intranasal lidocaine for acute migraine: A meta-analysis of randomized controlled trials. PLoS One 2019;14(10):e0224285.doi : 10.1371/journal.pone.0224285
- Wang F, Zhang H, Wang L, Cao Y, He Q. Intravenous sodium valproate for acute migraine in the emergency department: A meta-analysis. Acta Neurol Scand 2020;142(6):521–30.doi : 10.1111/ane.13325
- Reiter PD, Nickisch J, Merritt G. Efficacy and tolerability of intravenous valproic acid in acute adolescent migraine. Headache 2005;45(7):899–903.doi : 10.1111/j.1526-4610.2005.05158.x
- Sheridan D, Sun B, O’Brien P, Hansen M. Intravenous sodium valproate for acute pediatric headache. J Emerg Med 2015;49(4):541–5. doi : 10.1016/j.jemermed.2015.02.024
- Rosenthal S, Mazzio E, Wellman Gilbert H et coll. Efficacy of IV valproic acid and oral valproic acid tapers for the treatment of pediatric headaches in the emergency department. Neurol Clin Pract 2023;13(4):e200170. doi : 10.1212/CPJ.0000000000200170
- Miller AC, Pfeffer BK, Lawson MR, Sewell KA, King AR, Zehtabchi S. Intravenous magnesium sulfate to treat acute headaches in the emergency department: A systematic review. Headache2019;59(10):1674–86. doi : 10.1111/head.13648
- Corbo J, Esses D, Bijur PE, Iannaccone R, Gallagher EJ. Randomized clinical trial of intravenous magnesium sulfate as an adjunctive medication for emergency department treatment of migraine headache. Ann Emerg Med 2001;38(6):621–7.doi : 10.1067/mem.2001.119424
- Gertsch E, Loharuka S, Wolter-Warmerdam K, Tong S, Kempe A, Kedia S. Intravenous magnesium as acute treatment for headaches: A pediatric case series. J Emerg Med 2014;46(2):308–12. doi : 10.1016/j.jemermed.2013.08.049
- Barad M, Ailani J, Hakim SM, Kissoon NR, Schuster NM. Percutaneous interventional strategies for migraine prevention: A systematic review and practice guideline. Pain Med 2022;23(1):164–88.doi : 10.1093/pm/pnab236
- Szperka C, de Prado BM, Hsu J et coll. Randomized controlled trial of lidocaine occipital nerve blocks to treat status migrainosus in children/adolescents (S22.009). Neurology 2024;102(17_supplement_1). doi : 1212/WNL.0000000000205849
- Mazer-Amirshahi M, Dewey K, Mullins PM et coll. Trends in opioid analgesic use for headaches in US emergency departments. Am J Emerg Med 2014;32(9):1068–73. doi : 10.1016/j.ajem.2014.07.001
- VanderPluym JH, Halker Singh RB, Urtecho M et coll. Acute treatments for episodic migraine in adults: A systematic review and meta-analysis. JAMA 2021;325(23):2357–69. doi : 10.1001/jama.2021.7939
- Masonbrink A, Richardson T, Catley D et coll. Opioid use to treat migraine headaches in hospitalized children and adolescents. Hosp Pediatr 2020;10(5):401–7.doi : 10.1542/hpeds.2020-0007
- DeVries A, Koch T, Wall E, Getchius T, Chi W, Rosenberg A. Opioid use among adolescent patients treated for headache. J Adolesc Health 2014;55(1):128–33.doi : 10.1016/j.jadohealth.2013.12.014
- Choisir avec soin Canada. Céphalalgie. Juillet 2020 (consulté le 21 juillet 2025).
- Talai A, Heilbrunn B. Ondansetron for acute migraine in the pediatric emergency department. Pediatr Neurol 2020;103:52–6. doi : 10.1016/j.pediatrneurol.2019.06.011
- Woldeamanuel YW, Rapoport AM, Cowan RP. The place of corticosteroids in migraine attack management: A 65-year systematic review with pooled analysis and critical appraisal. Cephalalgia 2015;35(11):996–1024.doi : 10.1177/0333102414566200
- Colman I, Friedman BW, Brown MD et coll. Parenteral dexamethasone for acute severe migraine headache: Meta-analysis of randomised controlled trials for preventing recurrence. BMJ 2008;336(7657):1359–61. doi : 10.1136/bmj.39566.806725.BE
- Singh A, Alter HJ, Zaia B. Does the addition of dexamethasone to standard therapy for acute migraine headache decrease the incidence of recurrent headache for patients treated in the emergency department? A meta-analysis and systematic review of the literature. Acad Emerg Med 2008;15(12):1223–33. doi : 10.1111/j.1553-2712.2008.00283.x
- Neill A, Brannigan D. Towards evidence-based emergency medicine: Best BETs from the Manchester Royal Infirmary. BET 2: Dexamethasone for reduction of migraine recurrence. Emerg Med J 2013;30(2):165–6. doi : 10.1136/emermed-2012-202190.3
- Huang Y, Cai X, Song X et coll. Steroids for preventing recurrence of acute severe migraine headaches: A meta-analysis. Eur J Neurol 2013;20(8):1184–90.doi : 10.1111/ene.12155
- Cobb-Pitstick KM, Hershey AD, O’Brien HL et coll. Factors influencing migraine recurrence after infusion and inpatient migraine treatment in children and adolescents. Headache 2015;55(10):1397–403. doi : 10.1111/head.12654
- Holland S, Silberstein SD, Freitag F et coll. Evidence-based guideline update: NSAIDs and other complementary treatments for episodic migraine prevention in adults; Report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Neurology 2012;78(17):1346–53.doi : 10.1212/WNL.0b013e3182535d0c
- MacLennan SC, Wade FM, Forrest KML, Ratanayake PD, Fagan E, Antony J. High-dose riboflavin for migraine prophylaxis in children: A double-blind, randomized, placebo-controlled trial. J Child Neurol 2008;23(11):1300–4.doi : 10.1177/0883073808318053
- Bruijn J, Duivenvoorden H, Passchier J, Locher H, Dijkstra N, Arts WF. Medium-dose riboflavin as a prophylactic agent in children with migraine: A preliminary placebo-controlled, randomised, double-blind, cross-over trial. Cephalalgia 2010;30(12):1426–34.doi : 10.1177/0333102410365106
- Condò M, Posar A, Arbizzani A, Parmeggiani A. Riboflavin prophylaxis in pediatric and adolescent migraine. J Headache Pain 2009;10(5):361–5.doi : 10.1007/s10194-009-0142-2
- Wang F, Van Den Eeden SK, Ackerson LM, Salk SE, Reince RH, Elin RJ. Oral magnesium oxide prophylaxis of frequent migrainous headache in children: A randomized, double-blind, placebo-controlled trial. Headache 2003;43(6):601–10. doi : 10.1046/j.1526-4610.2003.03102.x
- Gallelli L, Avenoso T, Falcone D et coll. Effects of acetaminophen and ibuprofen in children with migraine receiving preventive treatment with magnesium. Headache 2014;54(2):313–24.doi : 10.1111/head.12162
- Rozen TD, Oshinsky ML, Gebeline CA et coll. Open label trial of coenzyme Q10 as a migraine preventive. Cephalalgia 2002;22(2):137–41. doi : 10.1046/j.1468-2982.2002.00335.x
- Sándor PS, Di Clemente L, Coppola G et coll. Efficacy of coenzyme Q10 in migraine prophylaxis: A randomized controlled trial. Neurology 2005;64(4):713–5.doi : 10.1212/01.WNL.0000151975.03598.ED
- Hershey AD, Powers SW, Vockell ALB et coll. Coenzyme Q10 deficiency and response to supplementation in pediatric and adolescent migraine. Headache 2007;47(1):73–80. doi : 10.1111/j.1526-4610.2007.00652.x
- Slater SK, Nelson TD, Kabbouche MA et coll. A randomized, double-blinded, placebo-controlled, crossover, add-on study of CoEnzyme Q10 in the prevention of pediatric and adolescent migraine. Cephalalgia 2011;31(8):897–905.doi : 10.1177/0333102411406755
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.