Point de pratique
Les antiviraux contre la grippe : des conseils aux praticiens
Affichage : le 9 octobre 2018 | Reconduit : le 11 janvier 2024
Auteur(s) principal(aux)
Upton D. Allen; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Paediatr Child Health 2020 23(8):564. (Résumé). 
Résumé
Le présent point de pratique résume l’information relative à l’utilisation de médicaments antiviraux pour traiter la grippe chez les enfants et les adolescents. Les recommandations reposent sur celles qui ont déjà été publiées au Canada à l’intention des cliniciens au sujet de l’utilisation d’antiviraux pour prévenir et traiter la grippe. De l’information détaillée sur une chimioprophylaxie sélective figure dans le document original, qui fait également ressortir l’importance des infections bactériennes secondaires (Streptococcus pneumoniae, Staphylococcus aureus sensible à la méthicilline et S. aureus résistant à la méthicilline) dans les cas de grippe grave. Le présent document se veut une référence pour tous les cliniciens. Il présente les principes généraux et un algorithme facile à utiliser pour contribuer au processus décisionnel.
Mots-clés : Antiviral therapy; Children; Influenza; Neuraminidase inhibitors
Le recours aux antiviraux chez les enfants : le passé et le présent
L’information générale sur la grippe saisonnière chez les enfants est résumée dans un document source [1]. Le taux comparativement élevé de grippe chez les enfants d’âge scolaire [2]-[4], la nature atypique et non spécifique de la grippe chez les jeunes enfants [5] et le risque élevé de répercussions indésirables chez les enfants de moins de cinq ans font partie des principaux problèmes [6]. Ce sont les nourrissons de moins de six mois qui présentent le taux d’hospitalisation le plus élevé [4]. Malgré cette morbidité, les enfants de tout âge atteints d’une grippe légère n’ont généralement pas besoin d’antiviraux. Les groupes les plus vulnérables et les affections comorbides qui prédisposent à une grippe plus grave sont exposés au tableau 1.
Trois antiviraux sont approuvés au Canada chez les enfants (tableau 2). À l’heure actuelle, l’amantadine (réservée au traitement de la grippe causée par le virus influenza A) n’est toutefois pas utile, en raison de la résistance. L’oseltamivir (Tamiflu, Hoffman-La Roche Ltée, Canada), qui est administré par voie orale, et le zanamivir (Relenza, GlaxoSmithKline Inc., Royaume-Uni), qui est administré à l’aide d’un « Diskhaler », sont des inhibiteurs de la neuraminidase (INA) utilisés contre les virus influenza A et B. Dans l’ensemble, l’expérience clinique relative aux INA augmente [7]-[10]. Les indications potentielles relatives aux INA les plus récents qui ne sont pas encore approuvés au Canada chez les enfants deviennent de plus en plus évidentes (tableau 2) [11]-[14]. Le péramivir par voie intraveineuse est le dernier ajout en date. Il a été approuvé aux États-Unis et au Canada pour traiter les cas de grippe grave lorsque l’oseltamivir et le zanamavir ne peuvent pas être prescrits [11].
Des aspects précis de l’efficacité des INA ont fait l’objet de controverses dans les publications scientifiques, mais d’après l’expérience cumulative de la plupart des experts et les nombreuses données disponibles, ces médicaments devraient être utilisés pour le traitement de tous les enfants qui sont hospitalisés à cause de la grippe, ont une affection sous-jacente ou présentent des symptômes graves ou évolutifs de la grippe [15]. Un traitement rapide peut améliorer la survie des enfants atteints d’une grippe grave [16]. Pour ceux qui ont la grippe et qui sont dans un contexte ambulatoire, on doit envisager un traitement aux INA, tel qu’il est proposé dans le présent document. Dans l’ensemble, les données à jour démontrent un profil de toxicité généralement favorable pour les INA [17].
L’oseltamivir est l’agent qui convient actuellement le mieux aux jeunes enfants. Il n’est pas approuvé au Canada pour les enfants de moins d’un an, mais il l’a été temporairement pendant la pandémie de grippe H1N1 de 2009 en fonction d’un ratio risque-avantage favorable, et deux études font état de données d’innocuité précieuses chez les nourrissons à terme [18] et prématurés [19]. Il faut envisager l’oseltamivir chez les nourrissons de moins d’un an atteints de la grippe en fonction de chaque cas et de la gravité de la maladie. Les recommandations publiées sur la posologie de l’oseltamivir chez les nourrissons de moins d’un an varient selon une plage raisonnablement étroite [20]-[23].
La posologie antivirale de la chimioprophylaxie est abordée dans le présent document, mais cette pratique doit se limiter à des scénarios cliniques précis, après la consultation de spécialistes de la santé publique ou de l’infectiologie.
Recommandations thérapeutiques
Les voies d’administration et les doses des médicaments sont résumées aux tableaux 2 et 3. Un algorithme thérapeutique est également fourni. Pour obtenir des explications sur la qualité des preuves, consulter le document suivant : www.ammi.ca/Content/Guidelines/Flu%20%28published%20version%29%20FINAL.pdf
Principes pour les praticiens
- Les personnes de tout âge autrement en bonne santé qui sont atteintes d’une grippe résolutive relativement légère ne sont pas susceptibles de profiter d’un traitement aux INA entrepris plus de 48 heures après l’apparition de la maladie (facultatif, qualité des preuves D).
Il faut amorcer l’antivirothérapie même lorsque l’intervalle entre l’apparition de la grippe et l’administration des antiviraux est de plus de 48 heures dans les cas où la maladie exige une hospitalisation; qu’elle est progressive, grave ou compliquée, quel que soit l’état de santé auparavant; ou que le patient fait partie d’un groupe à haut risque de maladie grave (pour une autre raison que son jeune âge) (recommandation forte, qualité des preuves X). Cette qualité des preuves dénote les situations où il est impossible de réaliser des études de validation, mais où la prépondérance d’avantages ou de dommages est évidente.
- Lorsqu’il est entendu d’amorcer une antivirothérapie, il faut le faire le plus rapidement possible après l’apparition de la maladie, car les avantages du traitement sont beaucoup plus élevés si celui-ci est entrepris peu après l’apparition de la maladie (dans les 12 heures suivant son apparition) que plus tard (à compter de 48 heures) (recommandation forte, qualité des preuves B).
- Il est possible d’amorcer l’antivirothérapie avant d’avoir reçu les résultats diagnostiques, mais il faudra arrêter le traitement si les résultats sont négatifs.
- Il faut que les parents des enfants pour qui l’antivirothérapie n’est pas recommandée soient informés des signes et symptômes d’aggravation de la maladie qui justifient une réévaluation (recommandation, qualité des preuves D).
- Le traitement habituel dure généralement cinq jours (recommandation forte, qualité des preuves A), mais peut être prolongé en cas de maladie grave (facultatif, qualité des preuves D).
Traitement des nourrissons, des enfants et des adolescents atteints d’une grippe légère ou sans complication (figure 1)
Les renseignements essentiels sont résumés à la figure 1 et détaillés ci-dessous.
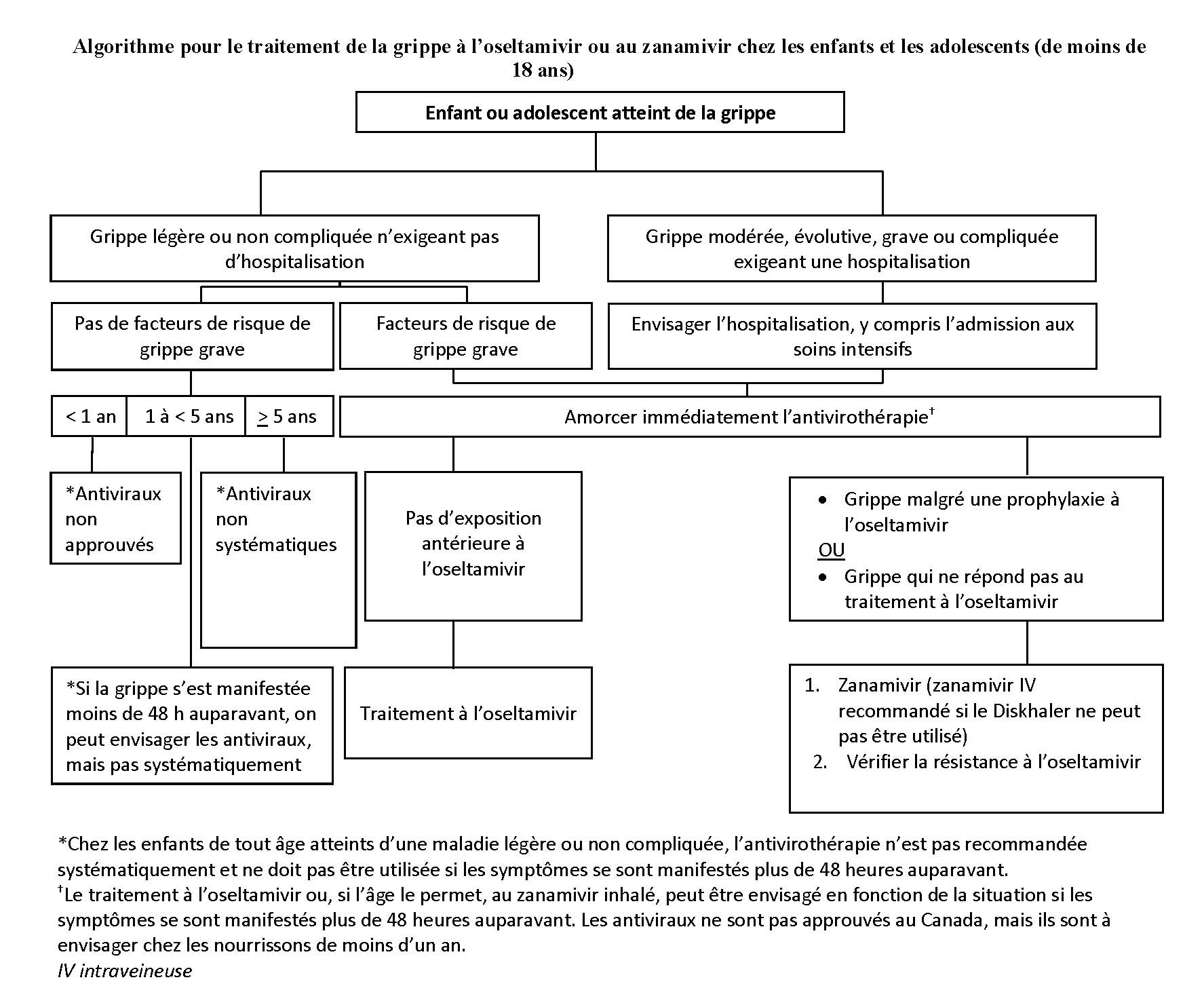
- Grippe légère sans facteurs de risque à part l’âge
- Nourrissons de moins d’un an : Les INA ne sont pas approuvés pour le traitement systématique de la grippe saisonnière. Puisque les nourrissons de moins de six mois ne sont pas vaccinés contre la grippe, il est important de vacciner les membres de la famille et les autres contacts étroits pour les protéger et, par conséquent, réduire la nécessité d’antivirothérapie. Il faut promouvoir la vaccination antigrippale des femmes enceintes pour protéger les nourrissons jusqu’à l’âge de six mois (facultatif, qualité des preuves D).
- Enfants de un an à moins de cinq ans : Même si les enfants de moins de cinq ans sont classés comme à haut risque (et ceux de moins de deux ans, comme les plus à risque), ceux qui sont autrement en santé, dont la grippe est légère et qui n’ont pas besoin d’être hospitalisés n’ont pas systématiquement besoin d’antivirothérapie. Le traitement de ces enfants est facultatif (facultatif, qualité des preuves D).
- Enfants de cinq ans et plus : L’antivirothérapie n’est pas systématiquement recommandée pour les enfants et les adolescents autrement en santé, dont la grippe est légère et qui n’ont pas besoin d’être hospitalisés (facultatif, qualité des preuves D).
- Grippe légère et facteurs de risque en plus de l’âge
- Nourrissons de moins d’un an : Les INA ne sont pas approuvés en ce moment pour le traitement systématique de la grippe saisonnière.
- Enfants d’un an ou plus : Dans les 48 heures suivant l’apparition de la grippe, il faut entreprendre un traitement à l’oseltamivir ou, si l’enfant est assez âgé (sept ans ou plus), un traitement au zanamivir inhalé (recommandation, qualité des preuves B).
- Enfants d’un an ou plus : Au-delà de 48 heures après l’apparition de la grippe, on peut envisager un traitement à l’oseltamivir en fonction de chaque cas. Si l’enfant a l’âge requis, on peut privilégier le zanamivir inhalé plutôt que l’oseltamivir (facultatif, qualité des preuves D).
Traitement des nourrissons, des enfants et des adolescents atteints d’une grippe modérée, évolutive, grave ou compliquée, qui présentent ou non des facteurs de risque
- Évaluer si l’hospitalisation et l’admission aux soins intensifs sont justifiées (recommandation, qualité des preuves C).
- Entreprendre immédiatement l’antivirothérapie (recommandation forte, qualité des preuves B).
- Administrer les doses appropriées d’oseltamivir ou de zanamivir, même lorsque la fenêtre entre l’apparition des symptômes et la dose de départ dépasse 48 heures (recommandation, qualité des preuves C).
- Envisager l’administration de zanamivir plutôt que d’oseltamivir dans les cas qui :
- ne répondent pas au traitement à l’oseltamivir (recommandation, qualité des preuves C);
- sont atteints de la grippe malgré une prophylaxie à l’oseltamivir (recommandation, qualité des preuves C).
- Traiter les enfants de moins d’un an en fonction de chaque situation selon la durée et la gravité de la grippe (facultatif, qualité des preuves D).
- Si des enfants sont gravement malades ou qu’ils ne peuvent pas tolérer l’oseltamivir par voie orale, les praticiens doivent consulter un infectiologue ou un pharmacien afin de trouver d’autres médicaments.
| Tableau 3. Posologie de l’oseltamivir et du zanamivir | |||
|
Médicament |
Traitement |
Chimioprophylaxie |
|
| Oseltamivir* | |||
| Adultes | |||
|
75 mg deux fois par jour |
75 mg une fois par jour |
||
| Enfants de 12 mois ou plus | |||
|
Poids (en kg) |
Poids (en lb) |
||
|
≤15 kg |
≤33 lb |
30 mg deux fois par jour |
30 mg une fois par jour |
|
>15 kg à 23 kg |
>33 lb à 51 lb |
45 mg deux fois par jour |
45 mg une fois par jour |
|
>23 kg à 40 kg |
>51 lb à 88 lb |
60 mg deux fois par jour |
60 mg une fois par jour |
|
>40 kg |
>88 lb |
75 mg deux fois par jour |
75 mg une fois par jour |
| Enfants de 3 mois à moins de 12 mois† | |||
|
3 mg/kg/dose deux fois par jour |
3 mg/kg/dose une fois par jour |
||
| Enfants de moins de 3 mois‡ | |||
|
3 mg/kg/dose deux fois par jour |
Non recommandé à moins que la situation soit considérée comme critique, en raison des données limitées sur l’utilisation de ce médicament dans ce groupe d’âge |
||
| Zanamivir§ | |||
| Adultes | |||
|
10 mg (deux inhalations de 5 mg) deux fois par jour |
10 mg (deux inhalations de 5 mg) une fois par jour |
||
| Enfants (de 7 ans ou plus, en vue du traitement et de la chimioprophylaxie) | |||
|
10 mg (deux inhalations de 5 mg) deux fois par jour |
10 mg (deux inhalations de 5 mg) une fois par jour |
||
|
Posologies adaptées de la référence 15. Même si les antiviraux ne sont pas autorisés au Canada pour le traitement systématique de la grippe saisonnière chez les nourrissons de moins d’un an, on peut en envisager l’utilisation compte tenu de la situation. Il faut consulter un infectiologue ou un pharmacien clinicien lorsqu’on envisage de traiter un patient ayant une atteinte rénale. Il faudra peut-être rajuster la dose d’oseltamivir en fonction de la clairance de la créatinine; il n’est pas nécessaire de rajuster la dose de zanamivir inhalé. *L’oseltamivir est administré par voie orale sans référence aux repas, même si l’administration conjointement avec le repas peut en améliorer la tolérabilité intestinale. L’oseltamivir est offert sous forme de capsules de 30 mg, 45 mg et 75 mg, de même que sous forme de poudre afin de préparer une suspension buvable reconstituée pour obtenir une concentration définitive de 6 mg/mL ou de 12 mg/mL. Si la suspension buvable commerciale n’est pas disponible, on peut ouvrir les capsules et en mélanger le contenu avec un liquide sucré pour en masquer le goût amer ou demander à une pharmacie de détail de préparer une suspension (concentration définitive de 6 mg/mL). Lorsqu’ils dispensent une formulation commerciale d’oseltamivir (Tamiflu poudre pour suspension buvable (6 mg/mL ou 12 mg/mL) Hoffman-La Roche Ltée, Canada), les pharmaciens doivent s’assurer que les unités de mesure sur les directives d’ordonnance correspondent au dispositif posologique. †Il est préférable de prévoir une posologie en fonction du poids. Les posologies que recommande l’American Academy of Pediatrics [2][20] sont présentées dans ce tableau pour fournir au clinicien une plage posologique acceptable : De la naissance à moins de neuf mois : 3 mg/kg/dose deux fois par jour De neuf à 12 mois : 3,5 mg/kg/dose deux fois par jour Si on ne connaît pas le poids du patient, il peut être nécessaire d’établir la posologie (deux doses par jour) ou la prophylaxie (une dose par jour) en fonction de l’âge pour les nourrissons à terme de moins d’un an : 0 à 3 mois = 12 mg par dose pour le traitement (mais pas pour la prophylaxie); 3 à 5 mois = 20 mg par dose; 6 à 11 mois = 25 mg par dose. ‡Les recommandations actuelles en fonction du poids relatives à l’oseltamivir par voie orale ne conviennent pas aux nourrissons prématurés, dont la clairance peut être plus lente en raison de l’immaturité de leur fonction rénale. Les doses recommandées pour les nourrissons à terme peuvent mener à des concentrations très élevées. Aux États-Unis, les Centers for Disease Control and Prevention et l’American Academy of Pediatrics (comité des maladies infectieuses, 2016) recommandent les posologies en fonction de données limitées provenant du groupe d’étude sur les antiviraux du National Institute of Allergy and Infectious Diseases Collaborative : 1,0 mg/kg/dose, par voie orale, deux fois par jour, pour les nourrissons prématurés nés avant 38 semaines d’âge gestationnel; 1,5 mg/kg/dose, par voie orale, deux fois par jour, pour ceux nés entre 38 et 40 semaines d’âge gestationnel; 3,0 mg/kg/dose, par voie orale, deux fois par jour, pour ceux nés après 40 semaines d’âge postmenstruel. Les données actuelles sont insuffisantes pour recommander une dose précise d’oseltamivir pour les nourrissons prématurés; il faut consulter un infectiologue ou un pharmacien clinicien. §Le zanamivir est administré par inhalation, au moyen d’un dispositif « Diskhaler » exclusif (Relenza, GlaxoSmithKline Inc., Royaume-Uni) qui contient le médicament. Le zanamivir est une poudre sèche, pas un aérosol, et ne doit pas être administré au moyen d’un nébuliseur, d’un ventilateur ou d’un autre dispositif utilisé pour administrer des solutions en aérosol. Le zanamivir n’est pas recommandé pour le traitement des maladies respiratoires chroniques (asthme ou autre maladie pulmonaire obstructive chronique), car il accroît le risque de bronchospasme. |
|||
Remerciements
Le comité des soins aigus, le comité de la pédiatrie communautaire et le comité de la pharmacologie et des substances dangereuses de la Société canadienne de pédiatrie ont révisé le présent point de pratique.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SCP
Membres : Michelle Barton-Forbes MD; Sean Bitnun MD; Natalie A. Bridger MD (membre sortante); Shalini Desai MD (membre sortante); Michael Forrester MD; Ruth Grimes MD (représentante du conseil); Nicole Le Saux MD (présidente); Karina Top MD
Représentants : Upton D. Allen MBBS, Groupe de recherche canadien sur le sida chez les enfants; Tobey Audcent MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Carrie Byington MD, comité des maladies infectieuses, American Academy of Pediatrics; Marc Lebel MD, Programme canadien de surveillance active de l’immunisation (IMPACT); Jane McDonald MD, Association pour la microbiologie médicale et l’infectiologie Canada; Dorothy L. Moore MD, Comité consultatif national de l’immunisation; Howard Njoo MD, Agence de la santé publique du Canada
Conseillère : Noni E. MacDonald MD
Auteur principal : Upton D. Allen MBBS
Références
- Aoki FY, Allen UD, Stiver HG, Evans GA. AMMI Canada Guideline: The use of antiviral drugs for influenza: A foundation document for practitioners. Can J Infect Dis Med Microbiol 2012;24(Suppl C):1C-15C. www.ammi.ca/Content/Guidelines/Flu%20%28published%20version%29%20FINAL.pdf (consulté le 9 octobre 2018).
- American Academy of Pediatrics. Influenza. In: Kimberlin DW, Brady MT, Jackson MA, Long SS, éd. Red Book: 2018 Report of the Committee on Infectious Diseases, 31e éd. Elk Grove Village: American Academy of Pediatrics, 2018:476-90.
- Centers for Disease Control and Prevention. Influenza-associated pediatric mortality – United States: https://gis.cdc.gov/GRASP/Fluview/PedFluDeath.html (consulté le 14 août 2018).
- Centers for Disease Control and Prevention. Clinical signs and symptoms of influenza: www.cdc.gov/flu/professionals/acip/clinical.htm (consulté le 14 août 2018).
- Dawood FS, Bresee J. Influenza viruses. In: Long SS, Pickering LK, Prober CG, éd. Principle and Practice of Pediatric Infectious Diseases, 5e éd. Edinburgh: Elsevier Inc., 2018:1181-1190.
- Neuzil KM, Zhu Y, Griffin MR et coll. Burden of interpandemic influenza in children younger than 5 years: A 25-year prospective study. J Infect Dis 2002;185(2):147-52.
- Kitching A, Roche A, Balasegaram S, Heathcock R, Maguire H. Oseltamivir adherence and side effects among children in three London schools affected by influenza A (H1N1)v, May 2009 – an internet-based cross-sectional survey. Euro Surveill 2009;14(30):19287.
- Barr CE, Schulman K, Iacuzio D, Bradley JS. Effect of oseltamivir on the risk of pneumonia and use of health care services in children with clinically diagnosed influenza. Curr Med Res Opin 2007;23(3):523-31.
- Piedra PA, Schulman KL, Blumentals WA. Effects of oseltamivir on influenza-related complications in children with chronic medical conditions. Pediatrics 2009;124(1):170-8.
- Gums JG, Pelletier EM, Blumentals WA. Oseltamivir and influenza-related complications, hospitalization and healthcare expenditure in healthy adults and children. Expert Opin Pharmacother 2008;9(2):151-61.
- Food and Drug Administration. Emergency use authorization of peramivir IV fact sheet for health care providers. www.fda.gov/downloads/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm187811.pdf (consulté le 10 septembre 2018).
- De Jong MD, Ison MG, Monto AS et coll. Evaluation of intravenous peramivir for treatment of influenza in hospitalized patients. Clin Infect Dis 2014:59(12):e172-85.
- Watanabe A, Chang SC, Kim MJ, Chu DW, Ohashi Y; Marvel Study Group. Long-acting neuraminidase inhibitor laninamivir octanoate versus oseltamivir for treatment of influenza: A double-blind, randomized, noninferiority clinical trial. Clin Infect Dis 2010;51(10):1167-75.
- Sugaya N, Ohashi Y. Long-acting neuraminidase inhibitor laninamivir octanoate (CS-8958) versus oseltamivir as treatment for children with influenza virus infection. Antimicrob Agents Chemother 2010;54(6):2575-82.
- Moodley A, Bradley JS, Kimberlin DW. Antiviral treatment of childhood influenza: An update. Curr Opin Pediatr 2018;30(3):438-47.
- Louie JK, Yang S, Samuel MC, Uyeki TM, Schechter R. Neuraminidase inhibitors for critically ill children with influenza. Pediatrics 2013;132(6):e1539-45.
- Boikos C, Caya C, Doll MK et coll. Safety and effectiveness of neuraminidase inhibitors in situations of pandemic and/or novel/variant influenza: A systematic review of the literature, 2009-15. J Antimicrob Chemother 2017;72(6):1556-73.
- Kimberlin DW, Shalabi M, Abzug MJ et coll. Safety of oseltamivir compared with the adamantanes in children less than 12 months of age. Pediatr Infect Dis J 2010;29(3):195-8.
- Acosta EP, Jester P, Gal P et coll. Oseltamivir dosing for influenza infection in premature neonates. J Infect Dis 2010;202(4):563-6.
- Organisation mondiale de la Santé. WHO guidelines for pharmacological management of pandemic influenza A (H1N1) 2009 and other influenza viruses. Révisé en février 2010. Part I. Recommendations: www.who.int/csr/resources/publications/swineflu/h1n1_guidelines_pharmaceutical_mngt.pdf (consulté le 10 septembre 2018).
- Centers for Disease Control and Prevention. Influenza Antiviral Medications: Summary for Clinicians: www.cdc.gov/flu/professionals/antivirals/summary-clinicians.htm (consulté le 14 août 2018).
- Public Health England. PHE guidance on use of antiviral agents for the treatment and prophylaxis of seasonal influenza. Version 8.0, septembre 2017. www.gov.uk/government/uploads/system/uploads/attachment_data/file/563029/PHE_guidance_antivirals_influenza_2016_to_2017_FINAL.pdf (consulté le 9 octobre 2018).
- American Academy of Pediatrics. Non-HIV antiviral drugs. In: Kimberlin DW, Brady MT, Jackson MA, Long SS, éd. Red Book 2018 Report of the Committee on Infectious Diseases, 31e éd. Elk Grove Village: American Academy of Pediatrics, 2018:966-84.
- Comité consultatif national de l’immunisation. Une déclaration d’un comité consultatif (DCC) : Chapitre sur la grippe du Guide canadien d’immunisation et Déclaration sur la vaccination antigrippale pour la saison 2016-2017. www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/naci-ccni/assets/pdf/flu-2016-2017-grippe-fra.pdf (consulté le 14 août 2018).
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.

