Document de principes
L’amélioration des médicaments à usage pédiatrique : une prescription pour les enfants et les adolescents canadiens
Affichage : le 24 septembre 2019 | Reconduit : le 12 janvier 2026
Un document de principes conjoint avec le Centre de formulations pédiatriques de la famille Rosalind et Morris Goodman du CHU Sainte-Justine (voir la liste complète des auteurs et des organismes qui l’ont approuvé plus loin)
Paediatr Child Health 2019 24(5) :336-9 (synthèse) 
Résumé
Dans une large mesure, les politiques qui régissent l’approbation et le remboursement des médicaments au Canada reposent sur des normes applicables aux adultes, et les nouveaux médicaments sont évalués d’après les normes de rendement du capital investi chez les adultes. Le financement de la recherche sur les maladies d’adultes est souvent privilégié aux dépens des maladies infantiles. Pour ce qui est de l’adoption de réformes en matière de réglementation et de recherches qui tiennent compte des caractéristiques particulières des enfants et des adolescents, le Canada s’est laissé distancer par d’autres pays. Afin que les enfants et les adolescents profitent d’un accès opportun à des médicaments sécuritaires et efficaces, y compris des formulations adaptées à la pédiatrie, le gouvernement fédéral doit adopter des réformes axées sur les enfants qui tiendront compte de leurs besoins de santé particuliers tout au long du cycle de vie des médicaments. Les réformes de la réglementation doivent reposer sur des principes de justice et d’équité, en restant sensibles au fait que les enfants méritent les mêmes normes que les adultes en matière d’innocuité, d’efficacité, de disponibilité et d’accès des médicaments. Les experts en pédiatrie doivent ouvrir la voie à des changements fondés sur des données probantes au sein même de Santé Canada, ainsi que dans les organismes de remboursement, par le biais d’un conseil consultatif d’experts consacré à la pédiatrie, permanent et bien financé. Les réformes doivent garantir la collecte et l’examen proactifs des données probantes en pédiatrie. Elles doivent également assurer la mise en œuvre de normes et de critères de référence adaptés à la pédiatrie dans l’ensemble du processus de réglementation et de décision relativement aux remboursements. Enfin, le gouvernement doit soutenir pleinement des prescriptions pédiatriques fondées sur des données probantes et mettre sur pied une infrastructure nationale stable pour la recherche et les essais cliniques sur les médicaments à usage pédiatrique.
Mots-clés : Health Canada; Medications; Paediatric formulations; Paediatrics; Regulation; Research
Les enfants ont droit au meilleur état de santé possible, entre autres grâce au traitement approprié des maladies [1]. Pourtant, les enfants et les adolescents continuent d’être sous-représentés dans la recherche sur les médicaments [2][3], la réglementation sur les médicaments et le développement de produits commerciaux [4].
Dans une large mesure, les politiques qui régissent le développement, l’approbation et le remboursement des médicaments sont conçues pour les adultes et ne tiennent pas compte des caractéristiques particulières des enfants et des adolescents. Le financement de la recherche sur les maladies d’adultes est souvent privilégié aux dépens des maladies infantiles, car on présume qu’à l’heure actuelle, la capacité et la faisabilité de la recherche sur les adultes sont plus élevées, de même que les profits commerciaux qui en découlent [5]–[7]. Les nouveaux médicaments sont souvent évalués et commercialisés d’après les principes de la physiologie des adultes et les normes de rendement du capital investi chez les adultes, sans tenir compte de l’enfant en développement [8]. Ainsi, les enfants tirent de l’arrière par rapport aux adultes, et le Canada s’est laissé distancer par les autres pays industrialisés pour ce qui est du développement et de l’approvisionnement de médicaments sécuritaires et efficaces pour les jeunes [9].
Jusqu’à 80 % de tous les médicaments prescrits dans les hôpitaux pédiatriques canadiens sont administrés dans un emploi non conforme à l’étiquette (ou dans une utilisation non autorisée), c’est-à-dire dans une utilisation qui diverge des renseignements posologiques, de la voie d’administration, de l’âge du patient ou des indications figurant dans la monographie de produit approuvée par Santé Canada [10]-[13]. De plus, de nombreux médicaments à usage pédiatrique couramment prescrits doivent prendre la forme de préparations magistrales (médicaments extemporanés), car il n’y a pas de formulations adaptées à la pédiatrie (p. ex., préparations buvables ou mini-comprimés à faible dose) sur le marché. Tant la prescription de médicaments dans un emploi non conforme que les préparations magistrales s’associent à des risques importants, y compris des événements indésirables et des inquiétudes en matière d’efficacité [14][15].
Dans un rapport phare publié en 2014, le Comité sénatorial permanent des affaires sociales, des sciences et de la technologie [10] a déployé les premiers efforts déterminants pour comprendre l’étendue et l’effet des médicaments utilisés dans un emploi non conforme au Canada et a ainsi démontré que les enfants forment une population vulnérable. La même année, le Conseil des académies canadiennes a publié le rapport d’un comité d’experts multidisciplinaires sur l’état de la pharmacothérapie pédiatrique au Canada [16]. Le Conseil est parvenu aux conclusions suivantes :
- Les enfants prennent des médicaments, dont un grand nombre n’ont pas fait la preuve de leur innocuité ou de leur efficacité pour l’usage auquel ils sont destinés.
- Les enfants réagissent aux médicaments différemment des adultes; les médicaments doivent donc faire l’objet d’études chez les enfants et être formulés pour les enfants.
- Du point de vue éthique, il est toujours possible d’étudier les médicaments sur des enfants, et cela est dans leur intérêt.
- Aux États-Unis et dans l’Union européenne, la recherche sur des médicaments pédiatriques est encouragée, obligatoire et surveillée selon des modalités qui constituent des leçons utiles pour le Canada.
- La recherche sur les médicaments pédiatriques a besoin d’une infrastructure établie et durable pour réaliser son plein potentiel.
En 2016, le gouvernement canadien a annoncé une modernisation importante de sa politique fédérale de réglementation [17]. Cet engagement constitue une occasion unique de rectifier des lacunes systémiques de longue date, ainsi que de renforcer et de rationaliser la sécurité et la disponibilité des médicaments à usage pédiatrique pour l’avenir. Pour exploiter pleinement cette possibilité, la réforme de la réglementation doit s’inspirer de valeurs fondamentales en matière de soins, y compris la justice et l’équité, pour s’assurer que les enfants et les adolescents fassent l’objet d’une réflexion et d’une attention équitables. Des experts en pédiatrie doivent ouvrir la voie aux changements fondés sur des données probantes au sein même de Santé Canada et dans les organismes décisionnels de remboursement. Les politiques et les processus doivent favoriser la collecte et l’utilisation de données pédiatriques. Enfin, il faut tenir compte des besoins particuliers des enfants et des adolescents tout au long du cycle de vie des médicaments. Les enfants méritent les mêmes normes élevées que les adultes en matière d’innocuité, d’efficacité, de disponibilité et d’accès des médicaments.
Les politiques et pratiques actuelles au Canada
L’approbation de Santé Canada
Santé Canada a l’autorité exclusive d’approuver les médicaments commercialisés au Canada [18]. Son mandat inclut les nouvelles molécules, l’examen de produits provenant d’autres territoires de compétence, mais nouveaux sur le marché canadien, et les nouvelles indications ou formulations de médicaments déjà homologués au Canada. Des règlements stricts et rigoureux garantissent l’innocuité et l’efficacité de médicaments dont la vente est approuvée et dont l’étiquette en précise l’usage approprié.
Tout comme dans les régimes de réglementation de territoires de compétence internationaux comparables, le processus de préparation d’une soumission à Santé Canada peut être fastidieux et coûteux. Les soumissions doivent contenir des données qui résument l’innocuité et l’efficacité cliniques du produit dans la population visée, l’information sur le processus de fabrication, les normes de qualité et les études non cliniques qui en corroborent l’utilisation sécuritaire chez les humains [19]. D’ordinaire, une soumission doit être assortie de plusieurs grands essais cliniques (souvent des études multicentriques auprès de centaines de patients), réalisés conformément aux normes de bonnes pratiques cliniques établies par la Conférence internationale sur l’harmonisation [20] et dont les paramètres sont bien définis et fondés sur des données probantes. Santé Canada peut également exiger des renseignements supplémentaires, qui entraîneront la tenue de nouvelles études.
Ces normes visent à protéger la santé de tous les Canadiens, mais les politiques actuelles ont des conséquences négatives non intentionnelles pour les enfants et les adolescents. Les normes actuelles en matière de réglementation reposent sur des données disponibles pour les populations adultes, qui proviennent de vastes bassins de patients et d’une infrastructure d’essais cliniques stable et bien financée. À l’heure actuelle, il pourrait bien être impossible de réaliser des essais parallèles dans les populations pédiatriques, en raison de la faible prévalence des maladies (p. ex., nombre total de patients) ou d’autres obstacles systémiques à la recherche en pédiatrie. Des réformes des politiques et des investissements ciblés et soutenus s’imposent pour vaincre ces obstacles avec efficacité.
Il faut des ressources financières et humaines imposantes pour préparer une soumission à Santé Canada, et les avantages pécuniaires anticipés par les fabricants peuvent décourager les investissements en raison du petit marché pédiatrique au Canada [21]. À ces facteurs dissuasifs s’ajoutent la perception de complexité du processus et l’incertitude de résultat. Il existe des aménagements, des mesures incitatives et des trajectoires différentes [22], mais ils sont rarement utilisés, et leur portée est limitée et mal comprise.
Par ailleurs, Santé Canada n’oblige pas les fabricants à soumettre des données pédiatriques, à moins qu’ils cherchent à obtenir une indication à visée pédiatrique. En opposition frappante avec les autorités internationales en matière de réglementation, Santé Canada n’exige pas activement de données probantes en pédiatrie, même lorsqu’un emploi peut être anticipé d’emblée pour les enfants ou les adolescents ou que des données pédiatriques existent et ont été soumises à des organismes de réglementation étrangers. Cette norme passive peut être considérée comme de la négligence sur le plan de la réglementation, car elle place les prescripteurs devant des options limitées et dans l’incertitude quant au meilleur moyen de modifier les médicaments pour adultes pour traiter les enfants et les adolescents [23].
L’utilisation de médicaments dans un emploi non conforme
Les évaluations varient selon les autorités en matière de réglementation, les milieux de pratique et les spécialités, mais les médicaments dans un emploi non conforme sont très prescrits chez les patients pédiatriques [24]-[26], particulièrement les nourrissons [27], les enfants en soins intensifs [28] et ceux qui sont traités pour un trouble de santé mentale [29]. « Emploi non conforme » ne signifie pas nécessairement « sans données probantes » (comme c’est souvent le cas chez les patients adultes), mais l’absence relative de données qui appuient l’efficacité, la posologie et l’innocuité des médicaments à usage pédiatrique peut donner lieu à des échecs de traitement, des erreurs de prescription et des événements indésirables chez les enfants [30][31].
Étant donné le coût, la complexité et l’incertitude associés aux processus de réglementation actuels, il est implicitement encouragé d’adhérer aux exigences minimales lors du dépôt de soumissions. Puisque Santé Canada n’oblige pas les fabricants à fournir des données justifiant un usage pédiatrique potentiel, à moins qu’ils cherchent à obtenir une indication à visée pédiatrique, l’omission constitue la « voie de la facilité » pour le fabricant. On constate des obstacles systémiques importants à la commercialisation de nouveaux médicaments à usage pédiatrique ou à de nouvelles indications de médicaments déjà homologués, même s’ils sont approuvés pour un usage pédiatrique depuis des décennies dans d’autres marchés à la réglementation rigoureuse. Le cadre actuel favorise la prescription de médicaments dans un emploi non conforme et met les enfants en danger.
Les difficultés et les risques associés aux préparations magistrales
En l’absence de formulation adaptée à la pédiatrie (p. ex., un liquide buvable) sur le marché, les médicaments pour adultes sont souvent manipulés pour obtenir la dose souhaitée ou pour en faciliter l’administration, selon un processus de fabrication par « préparation magistrale ». Ces préparations produites en pharmacie sont réglementées par des normes pharmaceutiques provinciales ou territoriales au Canada et sont considérées comme une pratique essentielle [32]. Les dispensateurs de soins peuvent également indiquer aux proches aidants de modifier un médicament à leur domicile afin d’en faciliter l’administration.
On ne connaît pas la prévalence exacte de cette pratique chez les enfants du Canada, mais on pense que, sur les 80 % de toutes les prescriptions pédiatriques qui échappent à l’approbation en matière de réglementation, bon nombre sont des préparations magistrales produites en pharmacie ou des produits modifiés par les proches aidants [16]. Les contrôles de qualité des préparations magistrales sont moins rigoureux que ceux des produits commerciaux [33]. Par conséquent, leur stabilité, leur puissance, leur uniformité, leur pureté chimique, leur stérilité microbienne et leur biodisponibilité ne sont pas aussi sûres, et elles comportent un risque d’importantes erreurs de concentration ou de posologie [34]. De plus, puisque le goût des préparations magistrales laisse souvent à désirer [35], il peut être difficile d’adhérer au traitement. Enfin, la manipulation de molécules prescrites, mais au potentiel dangereux, tels que les agents chimiothérapeutiques, peut poser un risque important à la fois pour les patients et les membres de la famille.
Dans bien des cas, les formulations pédiatriques commercialisées dans des lieux comme les États-Unis et l’Union européenne ne le sont tout simplement pas au Canada en raison du milieu de réglementation et de remboursement complexe et fastidieux, des limites commerciales propres aux petits marchés et des normes de pratique en place. Au Canada, les médicaments pour enfants méritent les mêmes mesures de protection en matière de réglementation que ceux pour adultes; c’est pourquoi il faut éliminer les obstacles à la commercialisation des formulations adaptées à la pédiatrie.
Les maladies rares et les médicaments à coût élevé
En vertu du cadre de réglementation actuel, de nombreux médicaments contre des maladies rares n’ont pas été soumis à l’approbation de Santé Canada et ne le seront sans doute jamais. À cause de cette lacune, on constate une dépendance disproportionnée au Programme d’accès spécial financé par le gouvernement fédéral, conçu pour faciliter l’accès à des médicaments essentiels non commercialisés au Canada. Le processus d’examen du Programme d’accès spécial est fastidieux, chronophage et fondé sur des cas, sans compter qu’il est accessible seulement pour les patients qui ont épuisé toutes les autres options thérapeutiques [36].
L’évolution de nouvelles pratiques de fixation des prix a stimulé l’intérêt envers l’approbation de médicaments contre certaines maladies rares [37][38]. Cependant, l’approbation de nouveaux médicaments parfois coûteux pour remplacer des options accessibles par l’entremise du Programme d’accès spécial a des effets pernicieux, comme d’inonder le marché de produits thérapeutiques qui, dans certains cas, coûtent beaucoup plus cher, mais n’apportent qu’un avantage thérapeutique négligeable par rapport aux anciens produits moins coûteux. Il est essentiel de s’assurer que les nouvelles soumissions de médicaments soient examinées conformément aux normes de soins cliniques à jour pour éviter les pratiques ou les prix prohibitifs désormais observés dans d’autres territoires de compétence. Pour soutenir et maintenir le système de santé du Canada à long terme, il est nécessaire d’intégrer l’approbation des médicaments aux processus [39].
Au-delà de Santé Canada : les processus de fixation des prix et de remboursement
Une approbation en matière de réglementation par Santé Canada ne garantit pas l’admissibilité à un remboursement en vertu des régimes d’assurance médicaments publics (ou privés). Pour faire partie des produits remboursés par le système public, un médicament doit respecter quatre étapes distinctes :
- Une évaluation des technologies de la santé (ÉTS), réalisée par l’Agence canadienne des médicaments et des technologies de la santé (pour toutes les régions sociosanitaires, sauf le Québec) ou l’Institut national d’excellence en santé et services sociaux (au Québec). Ces deux organismes fournissent des recommandations (positives, conditionnelles ou négatives) relatives au remboursement et à l’importance de la couverture afin que la valeur thérapeutique et économique de chaque médicament en justifie le financement public.
- Un examen de l’échelle de prix, effectué par le Conseil d’examen du prix des médicaments brevetés [39]. Cet organisme quasi judiciaire mandaté par le gouvernement fédéral s’assure que le prix des médicaments brevetés vendus au Canada n’est pas excessif [40].
- Des négociations nationales des prix par l’Alliance pancanadienne pharmaceutique, qui est responsable de maximiser les bénéfices nets des achats en gros.
- Un examen indépendant des programmes provinciaux, territoriaux ou fédéraux pour déterminer la pertinence d’inscrire les produits au formulaire public.
Ce processus est conçu pour optimiser le contrôle des achats et contribuer à la pérennité du système de santé public. Cependant, le système complexe d’évaluation des remboursements actuel a souvent la conséquence involontaire de compromettre l’accès aux médicaments et aux formulations adaptées à la pédiatrie chez les enfants et les adolescents canadiens. On ne tient pas systématiquement compte de leurs besoins particuliers, pas plus que des normes et des critères de référence adaptés à la pédiatrie.
Aucune entité publique de remboursement, quel que soit l’ordre du gouvernement, n’est tenue de prendre en compte les caractéristiques particulières des patients pédiatriques. L’ÉTS et les négociations sur la fixation des prix dépendent d’indications approuvées qui, dans bien des cas, se limitent exclusivement à la population adulte. Cette évaluation dépend de principes, de critères de référence et de ratios prix-volume établis selon des normes pour adultes, et porte souvent sur de vastes populations de patients atteints d’affections courantes. En général, elle néglige les caractéristiques particulières des populations pédiatriques, ce qui inclut un étiquetage limité, un petit marché, l’absence de données cliniques et de données coût-efficacité nécessaires pour garantir un remboursement, le besoin de posséder des formulations adaptées aux enfants et les avantages sociétaux découlant de l’offre de soins de qualité aux enfants [41]. Ces facteurs peuvent compromettre l’ÉTS à visée pédiatrique de tous les médicaments, mais prennent encore plus d’ampleur lorsque les affections touchent principalement ou exclusivement les enfants.
La réforme de l’ÉTS et des processus de fixation des prix, parallèlement aux améliorations en matière de réglementation, optimisera les soins et la santé des patients pédiatriques.
Les pratiques exemplaires internationales
L’Agence européenne des médicaments et la Food and Drug Administration des États-Unis sont toutes deux habilitées à exiger des études pédiatriques lorsqu’un médicament est susceptible d’être utilisé par des enfants, et elles reçoivent un financement pour promouvoir la tenue d’un tel travail. Santé Canada devrait se voir confier un mandat comparable [42].
En Europe, le Règlement pédiatrique est entré en vigueur en 2007, afin d’accroître le développement et l’offre de médicaments sécuritaires et efficaces pour les enfants [43]. Le Plan d’investigation pédiatrique [44], un volet obligatoire de toutes les soumissions de médicaments, est au cœur de cette initiative. Il doit inclure des données pédiatriques favorables aux indications pédiatriques lorsque leur utilisation chez les enfants constitue une hypothèse raisonnable. Les exigences du plan s’appliquent aux nouvelles soumissions et à celles comportant de nouvelles indications, de nouvelles formulations ou de nouvelles voies d’administration. Le Plan d’investigation pédiatrique est négocié rapidement au début du développement (phase 1 ou 2) de nouvelles molécules, mais lorsque ces molécules existent déjà, il est négocié dès qu’une nouvelle indication ou une nouvelle posologie est demandée. Les produits qui n’ont pas d’utilisation pédiatrique prévisible (p. ex., pour la démence sénile) doivent faire l’objet d’une exemption [44]. Le comité de pédiatrie permanent, un comité scientifique responsable de coordonner les activités de l’Agence européenne des médicaments à l’égard des médicaments pour enfants, examine et approuve chaque Plan d’investigation pédiatrique et détermine les études à réaliser dans le cadre du développement. Le fabricant est lié par les exigences qui figurent dans le plan [44][45].
La Food and Drug Administration des États-Unis appuie un comité de révision pédiatrique permanent, responsable de coordonner des activités liées au développement de médicaments sécuritaires et efficaces pour les enfants [46]. Ce comité se voit conférer cette autorité en vertu des lois suivantes :
-
La Pediatric Research Equity Act, qui accorde à la FDA l’autorité d’exiger des études sur certains médicaments et produits biologiques, d’obtenir des étiquettes appropriées et d’assurer le développement de formulations commerciales, si les besoins le justifient.
- La Best Pharmaceuticals for Children Act, qui prévoit des mesures incitatives, y compris l’exclusivité commerciale pour les promoteurs qui effectuent des études cliniques pédiatriques sur une base volontaire [47]. Cette loi incite également les National Institutes of Health à répertorier les médicaments qui ne sont plus sous brevet et doivent faire l’objet d’études chez les enfants à cause de l’absence de données sur leur posologie, leur innocuité ou leur efficacité. La Food and Drug Administration travaille en collaboration avec les National Institute of Health pour s’assurer de prendre en compte les données tirées d’études cliniques lors de la préparation des étiquettes.
À l’heure actuelle, les États-Unis cherchent à adopter des lois qui accroîtront les exigences d’évaluation des médicaments destinés à un usage pédiatrique, particulièrement ceux pour le traitement des patients pédiatriques atteints du cancer [48]. Ce travail marquant démontre que la réglementation gouvernementale peut assurer l’utilisation de médicaments à usage pédiatrique plus sécuritaires et plus efficaces.
Des relations étroites et coordonnées entre les régulateurs, les bailleurs de fonds de la recherche, les leaders cliniques et l’industrie sont essentielles au cadre de réglementation de l’Union européenne autant qu’à celle des États-Unis [49][50]. Au cœur de chaque modèle se trouve un conseil consultatif d’experts consacré à la pédiatrie, permanent et mandaté pour diriger et superviser le processus, favoriser les relations avec les parties prenantes et susciter le changement. L’efficacité de ce conseil dépend d’une approche proactive de collecte des données pédiatriques pour soutenir l’étiquetage, les indications et les formulations appropriés [51]-[53].
Des appels au changement
La gouvernance par des experts : coordonner le leadership en pédiatrie
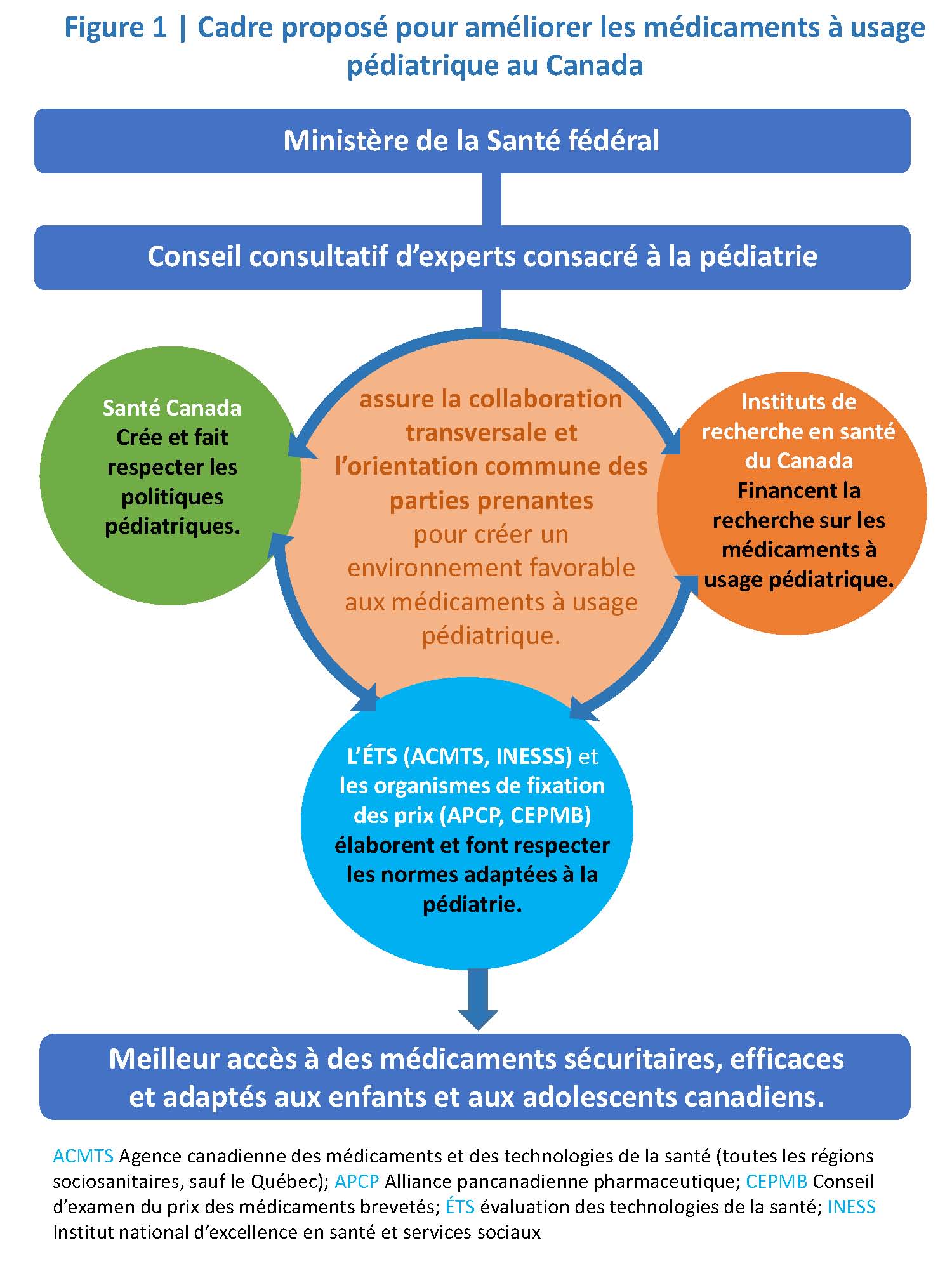
Le gouvernement fédéral devrait créer un conseil consultatif d’experts consacré à la pédiatrie, permanent et bien financé, pour analyser, orienter et coordonner les activités liées aux approbations de médicaments à usage pédiatrique, aux recherches cliniques connexes et aux programmes de remboursement (figure 1). Ce conseil assumerait les fonctions suivantes :
- Aider Santé Canada à créer des politiques et des marches à suivre pour déterminer et corriger de manière proactive les lacunes liées à l’utilisation des médicaments à usage pédiatrique dans toutes les soumissions de médicaments.
- Soutenir Santé Canada, les organismes d’ÉTS, les organismes de fixation des prix ou les organismes d’inscription provinciaux ou territoriaux pour qu’ils définissent et fassent respecter les normes en matière de preuves adaptées à la pédiatrie, tout en convenant de la nécessité de réaliser des enquêtes scientifiques rigoureuses, d’obtenir des données cliniques reproduisibles et de prendre en compte les réalités épidémiologiques et cliniques particulières aux soins pédiatriques.
- Collaborer avec Santé Canada à l’élaboration d’approches adaptées à la pédiatrie pour utiliser les données de territoires de compétence étrangers disposant d’une réglementation rigoureuse et pour accélérer l’accès aux médicaments à usage pédiatrique et aux formulations adaptées à la pédiatrie déjà largement utilisés dans d’autres pays industrialisés.
- Prioriser l’examen des médicaments et des formulations pédiatriques par Santé Canada, y compris ceux obtenus par l’entremise du Programme d’accès spécial.
- Dans tous les portefeuilles, conseiller Santé Canada quant aux enjeux liés aux investissements, à l’élaboration de politiques, au renouvellement en matière de réglementation et à la mise en œuvre des processus en santé pédiatrique.
- Coordonner les activités liées aux médicaments à usage pédiatrique chez les parties prenantes et tout au long du cycle de vie de ces médicaments.
Le conseil consultatif d’experts consacré à la pédiatrie devrait être intégré à un portefeuille et relever directement du ministre et du sous-ministre de la Santé. Il devrait être formé de chefs de file des secteurs cliniques, universitaires et administratifs, en mesure de former rapidement des groupes ponctuels d’experts lorsque des questions particulières surgissent. Il devrait sciemment faire participer le public, les parents et les patients, pour éclairer à la fois ses priorités et ses décisions. Ses délibérations devraient être transparentes, et il devrait produire un rapport annuel en ligne exposant les progrès vers des buts précis et des objectifs mesurables.
Les systèmes de réglementation : la reconception des processus en pédiatrie
Une réforme des processus de réglementation s’impose pour mieux intégrer l’approbation, l’ÉTS et les processus de fixation des prix. À cet effet, Santé Canada devrait :
- avoir l’autorité de solliciter et d’analyser les données pédiatriques de façon proactive à la réception de toutes les soumissions pour lesquelles un emploi pédiatrique est prévu ou anticipé.
- envisager des mesures d’incitation financière pour stimuler la soumission de médicaments à usage pédiatrique, y compris les médicaments hors brevet, qui ne sont pas assortis de dispositions en matière d’exclusivité commerciale ni de mesures de protection de la propriété intellectuelle.
- lorsque des données cliniques supplémentaires sont nécessaires pour appuyer une soumission à visée pédiatrique, collaborer avec des bailleurs de fonds de la recherche. Un financement réservé pour soutenir les essais cliniques en pédiatrie, les registres de médicaments et les études postcommercialisation doit s’harmoniser avec les priorités politiques en santé, corriger le manque de données probantes en pédiatrie et optimiser les retombées dans l’ensemble du système de santé.
- créer, appliquer et évaluer des méthodes novatrices et des normes de ce qui constitue des données probantes, attentives aux besoins des enfants et des adolescents [54]. Des directives établies par des partenaires internationaux rigoureux (et conjointement avec eux) peuvent faire progresser l’utilisation de médicaments sécuritaires et efficaces au Canada et ailleurs dans le monde [53].
- engager un dialogue régulier avec les fabricants en cas de questions sur les processus de réglementation et avec les organismes de remboursement lors de l’établissement de normes et de critères de référence en pédiatrie.
Toutes les parties prenantes doivent recevoir des directives pédiatriques claires sur les processus en matière de réglementation et de remboursement. Conjointement avec une analyse appropriée des organismes d’ÉTS, ces réformes réduiront les obstacles, les coûts et les incertitudes, et favoriseront des soumissions à visée pédiatrique au Canada.
La Loi C-17 : une occasion de rendre les médicaments à usage pédiatrique accessibles, sécuritaires et adaptés
La Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi C-17 ou « Loi de Vanessa ») modifie la Loi sur les aliments et drogues pour renforcer l’innocuité des médicaments en intensifiant la surveillance tout au long de leur cycle de vie, en améliorant les systèmes de déclaration d’événements indésirables et en accroissant la transparence [55]. Les propositions en matière de réglementation associées à la Loi C-17 sont lentes à émerger, mais les principales réformes doivent habiliter le ministère de la Santé à prendre les mesures suivantes :
- Obliger les fabricants à compiler des renseignements supplémentaires, à mener de nouvelles études cliniques et à modifier les monographies de produit en présence de risques importants pour la sécurité des patients. Les enquêtes peuvent inclure une révision des indications ou des posologies lorsque les prescriptions dans un emploi non conforme présentent un grave danger ou qu’un risque évident est associé à la préparation magistrale d’un médicament donné (p. ex., médicament cytotoxique).
- Autoriser l’importation, la fabrication ou la préparation d’un produit pour enfant lorsqu’un besoin thérapeutique précis et urgent est attesté.
Ces pouvoirs s’arriment avec des initiatives clés conçues pour améliorer l’accès à des médicaments à usage pédiatrique sécuritaires et efficaces et doivent être mis à profit de manière appropriée.
Les systèmes de remboursement : le besoin de revoir le processus
Les efforts en vue de moderniser et d’harmoniser les processus de réglementation auront peu de succès si les organismes d’ÉTS ne font pas simultanément l’objet de réformes. Des experts en pédiatrie devraient orienter les activités liées à ces réformes, donner des conseils aux organismes fédéraux de fixation des prix et assurer la liaison avec eux. Cette responsabilité devrait incomber au conseil consultatif d’experts consacré à la pédiatrie, qui devrait être habilité à concilier les normes et processus de réglementation, d’ÉTS et de politiques de remboursement. Les objectifs précis de ce conseil s’établiraient comme suit :
- Créer, mettre en application et évaluer des normes cliniques et économiques adaptées à la pédiatrie pour éclairer l’ÉTS et les processus de fixation des prix. Ces normes doivent reposer sur des considérations pharmacologiques, socioéconomiques, organisationnelles et éthiques et doivent tenir compte des évaluations de nouveaux produits, de nouvelles indications et de nouvelles formulations pédiatriques, tant à l’égard des médicaments brevetés qu’hors brevet.
- Au moment d’évaluer les risques et les avantages des médicaments, s’assurer de tenir compte de l’ensemble des risques associés aux préparations magistrales [56], et s’attarder sur l’innocuité, la flexibilité de la dose et les posologies qui maximisent l’adhérence (y compris la palatabilité).
- De manière proactive, cibler les médicaments et les formulations prioritaires qui ne sont pas offerts au Canada et faciliter les évaluations en vue de leur examen et de leur remboursement.
Les formulations adaptées aux enfants : élargir l’accès commercial
Pour que tous les patients pédiatriques aient accès à des formulations qui leur sont adaptées, il faut investir dans le développement de nouveaux produits [57] et développer des systèmes de délivrance de médicaments novateurs (p. ex., comprimés à dissolution rapide or mini-comprimés). Ces innovations favoriseront des modes d’administration plus sécuritaires, plus précis et plus acceptables pour les enfants.
Santé Canada doit s’assurer que les enfants du pays aient accès aux mêmes formulations commerciales sécuritaires et efficaces que celles qui sont déjà offertes dans des territoires de compétence dont la réglementation est rigoureuse, comme les États-Unis et l’Union européenne. Pour en assurer l’accessibilité, il faut un système de réglementation canadien qui priorise les examens, les données provenant d’organismes de réglementation étrangers et des trajectoires de remboursement adaptées à la pédiatrie.
La prescription fondée sur des données probantes : des problèmes et des solutions
À l’heure actuelle, de nombreuses monographies de produit sont obsolètes, et l’industrie n’est ni contrainte de les mettre à jour ni encouragée à le faire [58]. Les prescripteurs et les dispensateurs possèdent divers outils pour les guider dans leurs choix de prescriptions dans un emploi conforme et non conforme (p. ex., le Compendium des produits et spécialités pharmaceutiques, les formulaires en milieu hospitalier, les directives cliniques et les services de souscription privés), mais il n’existe pas de ressource gratuite, unique, fondée sur des données probantes et continuellement mise à jour sur laquelle s’appuyer pour prendre des décisions pharmacologiques à l’égard des patients pédiatriques.
Il est impératif d’instaurer une référence nationale en ligne à l’égard des médicaments à usage pédiatrique et des normes sur les préparations magistrales afin de réduire les variations des traitements, de garantir des pratiques de prescription optimales à l’égard d’affections courantes et de partager les connaissances des pratiques exemplaires sur les thérapies émergentes de maladies pédiatriques rares et d’autres affections cliniques [59]. Cette ressource devrait permettre de signaler en temps réel les événements indésirables associés à des médicaments commercialisés ou des préparations magistrales. De tels signalements devraient susciter l’examen des données postcommercialisation de ces médicaments pour des emplois conformes et non conformes, et ainsi faciliter la collecte de données probantes sur le terrain [60] en vue d’évaluer les médicaments tout au long de leur cycle de vie.
Compte tenu de leur expérience dans la création de ressources sur les médicaments et les produits thérapeutiques, l’Association des pharmaciens du Canada, conjointement avec les Directeurs de pédiatrie du Canada, devrait diriger les efforts en vue de créer cette ressource, grâce à un financement de Santé Canada.
La recherche en pédiatrie : une approche ciblée, un financement et un cadre
Les budgets fédéraux de recherche devraient prévoir des portefeuilles affectés à la recherche sur les médicaments à usage pédiatrique proportionnels à la taille de la population et représentatifs du rendement du capital investi anticipé découlant de la recherche axée sur les enfants [61]. Dans le cas de maladies qui touchent principalement ou exclusivement les enfants (p. ex., certaines maladies neuromusculaires congénitales) ou qui se manifestent seulement pendant l’enfance (p. ex., affections inflammatoires systémiques), l’amélioration de l’état de santé des jeunes représente la trajectoire la plus rentable vers une population adulte en meilleure santé.
Le Canada est un chef de file reconnu de la pharmacologie clinique, de la méthodologie d’essais cliniques pédiatriques sur les médicaments et des services de santé pour la population. Des efforts coordonnés s’imposent pour soutenir les programmes de recherche en place, transposer des méthodes novatrices dans divers domaines de recherche et s’assurer que les organismes de réglementation et de remboursement comprennent les progrès relatifs à la méthodologie des essais et au développement des réseaux et les mettent en pratique.
Pour favoriser l’efficacité de la recherche, il faut éliminer les obstacles aux essais cliniques pédiatriques. Parmi les autres mesures, on peut réduire la duplication inutile des examens entre les comités d’éthique de la recherche, améliorer les plateformes de partage de la recherche et créer des normes pour renforcer le regroupement et la comparabilité des données. Santé Canada devrait éliminer les obstacles à la tenue d’études faisant appel à des médicaments correspondant aux normes des soins. Pour ce faire, il devrait réétiqueter activement les médicaments utilisés dans un emploi non conforme qui sont essentiels à la tenue d’essais cliniques en pédiatrie. Un investissement organisé et soutenu dans l’infrastructure des essais cliniques pédiatriques nationaux, à l’instar de celle établie par le Maternal Infant Child and Youth Research Network (MICYRN), mettra le Canada en bonne position pour devenir un chef de file international de la recherche en pédiatrie, qui attirera à la fois des recherches cliniques réalisées par l’industrie et des partenariats public-privé à grande échelle.
RECOMMANDATIONS
Afin que les enfants et les adolescents profitent d’un accès à des médicaments sécuritaires et efficaces, il est recommandé que le ministère de la Santé du Canada prenne les mesures suivantes :
- Créer et financer un conseil consultatif d’experts consacré à la pédiatrie permanent au sein du portefeuille fédéral de la santé. Relevant du sous-ministre de la Santé, ce conseil donnera des avis sur les activités de réglementation, de remboursement et de recherche liés aux médicaments et aux produits thérapeutiques pédiatriques.
- Exiger que Santé Canada 1) sollicite et examine de manière proactive les données pédiatriques relatives aux médicaments lorsqu’on en envisage ou en anticipe l’utilisation en pédiatrie; 2) établisse des trajectoires politiques pour accroître les soumissions de médicaments, d’indications et de formulations pédiatriques, et 3) travaille en collaboration avec les organismes d’évaluation des technologies de la santé à la création et à l’évaluation de normes et de critères de référence en pédiatrie, utilisées à la fois dans des contextes de réglementation et de remboursement.
- Exiger que Santé Canada 1) fasse la promotion de révisions et de décisions provenant de partenaires internationaux rigoureux pour soutenir la commercialisation efficiente des médicaments à usage pédiatrique et des formulations adaptées à la pédiatrie considérées comme prioritaires et 2) revoie le Programme d’accès spécial afin d’appuyer l’accès rapide aux médicaments essentiels pour les enfants et déterminer les cibles de commercialisation prioritaires au Canada.
- Financer la mise sur pied d’une ressource nationale complète en ligne et constamment actualisée pour appuyer des prescriptions uniformes et fondées sur des données probantes dans tous les centres et toutes les régions sociosanitaires du Canada.
- Investir dans une infrastructure pour la recherche et les essais cliniques sur les médicaments à usage pédiatrique afin d’assurer la congruence entre les activités prioritaires en matière de réglementation, de remboursement et de recherche.
Remerciements : Pour leur apport réfléchi et leur révision attentive, les auteurs tiennent à remercier le docteur Mike Dickinson, madame Tammy Clifford et madame Anne Tomalin. Pour leur évaluation critique et leurs ajouts importants, ils remercient également le docteur Jim Whitlock et madame Kathy Brodeur-Robb.
| Liste des organisations qui appuient la SCP | |
| Centre de formulations pédiatriques de la famille Rosalind et Morris Goodman du CHU Sainte-Justine Santé des enfants Canada Directeurs de pédiatrie du Canada Maternal Infant Child and Youth Research Network KidsCAN Trials Société canadienne de rhumatologie Association canadienne de néphrologie pédiatrique Association canadienne de neurologie pédiatrique |
Société canadienne de la pharmacologie et de la thérapeutique The C17 Council Canadian Pediatric Neuromuscular Group Académie canadienne de psychiatrie de l’enfant et de l’adolescent Association pour la microbiologie médicale et l’infectiologie Canada Association canadienne de médecine d’urgence Groupe canadien d’endocrinologie pédiatrique Association canadienne de cardiologie pédiatrique |
GROUPE DE TRAVAIL SUR LES MÉDICAMENTS ET LES PRODUITS THÉRAPEUTIQUES PÉDIATRIQUES
Charlotte Moore Hepburn1, Andrea Gilpin2, Julie Autmizguine, Avram Denburg, L. Lee Dupuis, Yaron Finkelstein, Emily Gruenwoldt, Shinya Ito, Geert ‘t Jong, Thierry Lacaze-Masmonteil, Deborah Levy, Stuart MacLeod, Steven P. Miller, Martin Offringa, Maury Pinsk, Barry Power, Michael Rieder, Catherine Litalien2
1Société canadienne de pédiatrie, Ottawa (Ontario); 2Le Centre de formulations pédiatriques de la famille Rosalind et Morris Goodman du CHU Sainte-Justine, Montréal (Québec)
Références
- Assemblée générale des Nations Unies. Convention relative aux droits de l’enfant. Le 20 novembre 1989. Recueil des Traités des Nations Unies. Vol. 1577, p. 3. www.refworld.org/cgi-bin/texis/vtx/rwmain/opendocpdf.pdf?reldoc=y&docid=50a627c72 (consulté le 29 avril 2018).
- Rieder M, Hawcutt D. Design and conduct of early phase drug studies in children: Challenges and opportunities. Br J Clin Pharmacol 2006;82(5):1308-14.
- Field MJ, Behrman RE (éd.). Ethical Conduct of Clinical Research Involving Children. Institute of Medicine Committee on Clinical Research Involving Children. Washington, DC: National Academies Press, 2004.
- Ward RM, Benjamin DK, Davis JM et coll. The need for pediatric drug development. J Pediatrics 2018;192(1):13-28.
- Hay WW, Gitterman DP, Williams DA, Dover GJ, Sectish TC, Schleiss MR. Child health research funding and policy: Imperatives and investments for a healthier world. Pediatrics 2010;125(6):1259-65.
- Zylke JW, Rivara FP, Bauchner H. Challenges to excellence in child health research: Call for papers. JAMA 2012;308(10):1040-1.
- Tishler CL, Reiss NS. Pediatric drug-trial recruitment: Enticement without coercion. Pediatrics 2011;127(5):949-54.
- Vitiello B, Jensen PS. Medication development and testing in children and adolescents. Current problems, future directions. Arch Gen Psychiatry 1997;54(9):871-6.
- Joseph PD, Craig JC, Caldwell PH. Clinical trials in children. Br J Clin Pharmacol 2015;79(3):357-69.
- Comité sénatorial permanent des affaires sociales, des sciences et de la technologie. Les produits pharmaceutiques sur ordonnance au Canada : Emploi non conforme à l’étiquette. Janvier 2014. https://sencanada.ca/content/sen/Committee/412/soci/rep/rep05jan14-f.pdf (consulté le 29 avril 2019).
- Stafford RS. Regulating off-label drug use — Rethinking the role of the FDA. N Engl J Med 2008;358(14):1427–9.
- Pandolfini C, Bonati M. A literature review on off-label drug use in children. Eur J Ped 2005;164(9):552-8.
- Yackey K, Stukus K, Cohen D, Kline D, Zhao S, Stanley R. Off-label medication prescribing patterns in pediatrics: An update. Hosp Pediatr 2019;9(3):186-93.
- Zito JM, Derivan AT, Kratochvil CJ, Safer DJ, Fegert JM, Greenhill LL. Off-label psychopharmacologic prescribing in children: History supports close clinical monitoring. Child Adolesc Psychiatry Ment Health 2008;2(1):24.
- Rawlence E, Lowey A, Tomlin S, Auyeung V. Is the provision of paediatric oral liquid unlicensed medicines safe? Arch Dis Child Educ Prac Ed 2018;103(6):310-3.
- Conseil des académies canadiennes. Le comité d’experts sur les produits thérapeutiques pour les nourrissons, les enfants et les adolescents. Améliorer les médicaments pour enfants au Canada, 2014. https://rapports-cac.ca/wp-content/uploads/2018/10/therapeutics_fullreportfr.pdf (consulté le 29 avril 2019).
- Secrétariat du Conseil du Trésor du Canada. Examens des règlements et modernisation de la réglementation. 2018. www.canada.ca/fr/secretariat-conseil-tresor/organisation/transparence/lois-reglements/consultation-modernisation-reglementation.html (consulté le 29 avril 2019).
- Gouvernement du Canada. Bureau des présentations et de la propriété intellectuelle (BPPI) : Comment les médicaments sont examinés au Canada. www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medicaments/feuillets-information/comment-medicaments-sont-examines-canada.html (consulté le 29 avril 2019).
- Santé Canada. Ligne directrice : Préparation des activités de réglementation des drogues en format Electronic Common Technical Document, le 14 mai 2015. www.canada.ca/content/dam/hc-sc/migration/hc-sc/dhp-mps/alt_formats/hpfb-dgpsa/pdf/prodpharma/prep_ectd_format-fra.pdf (consulté le 30 avril 2018).
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use. www.ich.org/home.html (consulté le 29 avril 2019).
- WorldAtlas, Society, Biggest Pharmaceutical Markets by Country, April 2017 www.worldatlas.com/articles/countries-with-the-biggest-global-pharmaceutical-markets-in-the-world.html (consulté le 13 mai 2018).
- Santé Canada. Ligne directrice : La protection des données en vertu de l’article C.08.004.1 du Règlement sur les aliments et drogues, le 16 mai 2017. www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medicaments/demandes-presentations/lignes-directrices/protection-donnees-vertu-article-08-004-1-reglement-aliments-drogues.html#a28 (consulté le 29 avril 2019).
- Peterson B, Hébert PC, MacDonald N, Rosenfield D, Stanbrook MD, Flegel K. Industry’s neglect of prescribing information for children. CMAJ 2011;183(9): 994-5.
- ‘T Jong GW, Eland IA, Sturkenboom MC, van den Anker JN, Stricker BH. Unlicensed and off label prescription of drugs to children: Population based cohort study. BMJ 2002;324(7349):1311-2.
- Bücheler R, Schwab M, Mörike K et coll. Off label prescribing to outpatient children in primary care in Germany: Retrospective cohort study. BMJ 2002;324(7349):1311-2.
- Corny J, Bailey B, Lebel D, Bussières JF. Unlicensed and off-label drug use in paediatrics in a mother-child tertiary care hospital. Paediatr Child Health 2016; 21(2):8387.
- Mulugeta YL, Zajicek A, Barrett J et coll. Development of drug therapies for newborns and children: The scientific and regulatory imperatives. Pediatr Clin N Am 2017;64(6):1185-96.
- Czaja A, Reiter PD, Schultz ML, Valuck R. Patterns of off-label prescribing in the pediatric intensive care unit and prioritizing future research. J Pediatr Pharmacol Ther 2015;20(3):186-96.
- Zito JM, Safer DJ, dosReis S, Gardner JF, Boles M, Lynch F. Trends in the prescribing of psychotropic medications to preschoolers. JAMA 2000;283(8):1025-30.
- Kimland E, Odlind V. Off-label drug use in paediatric patients. Clin Pharmacol Ther 2012;91(5): 796-801.
- Bellis JR, Kirkham JJ, Nunn AJ, Pirmohamed M. Adverse drug reactions and off-label and unlicensed medicines in children: A prospective cohort study of unplanned admissions to a paediatric hospital. Br J Clin Pharmacol 2014;77(3):545-53.
- Falconer JR, Steadman KJ. Extemporaneously compounded medicines. Aust Prescr 2017;40(1):5-8.
- Ivanovska V, Rademaker CM, van Dijk L, Mantel-Teeuwisse AK. Pediatric drug formulations: A review of challenges and progress. Pediatrics 2014;134(2):361-72.
- Bussières JF, Héraut MK, Duong MT et coll. Patient access to compounded drugs in pediatrics after discharge from a tertiary center. Pediatr Child Health 2017;22(Suppl 1):e29-e30.
- Lin D, Seabrook JA, Matsui DM, King SM, Rieder MJ, Finkelstein Y. Palatability, adherence and prescribing patterns of antiretroviral drugs for children with human immunodeficiency virus in Canada. Pharmacoepidemiol Drug Saf 2011;20(12):1246-52.
- Houston AR, Blais CM, Houston S, Ward BJ. Reforming Canada’s Special Access Programme (SAP) to improve access to off-patent essential medicines. Journal of the Association of Medical Microbiology and Infectious Disease Canada 2018;3(2):100-7.
- Crowe K. Second Opinion: Canadian families stunned by 3000% increase in price of life-saving drug. CBC News, March 10, 2018. www.cbc.ca/news/health/second-opinion-procysbi-cystagon-march10-1.4570152 (consulté le 29 avril 2019).
- Pollack A. Parental quest bears fruit in a kidney disease treatment. New York Times, April 30, 2103. www.nytimes.com/2013/05/01/business/fda-approves-raptor-drug-for-form-of-cystinosis.html (consulté le 31 janvier 2019).
- Gouvernement du Canada. Conseil d’examen du prix des médicaments brevetés : Rapport annuel 2017. www.pmprb-cepmb.gc.ca/CMFiles/Publications/Annual%20Reports/2018/2017_Annual_Report_Final_FR.pdf (consulté le 29 avril 2019).
- Gouvernement du Canada. Conseil d’examen du prix des médicaments brevetés. http://pmprb-cepmb.gc.ca/fr/accueil (consulté le 31 janvier 2019).
- Denburg AE, Ungar WJ, Greenberg M. Public drug policy for children in Canada. CMAJ 2017;189(30):E990-E994.
- MacLeod S. Les enquêtes sur les médicaments pour les enfants canadiens : Le rôle de la Société canadienne de pédiatrie. Paediatr Child Health 2003;8(4):237-40.
- Agence européenne des médicaments. Human regulatory, overview. Paediatric Regulation: www.ema.europa.eu/en/human-regulatory/overview/paediatric-medicines/paediatric-regulation (consulté le 29 avril 2019).
- Agence européenne des médicaments. Human regulatory, research and development/ Paediatric investigation plans. www.ema.europa.eu/en/human-regulatory/research-development/paediatric-medicines/paediatric-investigation-plans (consulté le 29 avril 2019).
- Commission européenne. État des médicaments pédiatriques dans l’Union – 10 ans du règlement pédiatrique de l’Union; Rapport de la Commission au parlement européen et au conseil. COM (2017) 626. https://ec.europa.eu/health/sites/health/files/files/paediatrics/docs/2017_childrensmedicines_report_fr.pdf (consulté le 31 janvier 2019).
- U.S. Food and Drug Administration. Pediatric Review Committee (PeRC). www.fda.gov/Drugs/DevelopmentApprovalProcess/DevelopmentResources/ucm607942.htm (consulté le 29 avril 2019).
- Avant D, Wharton GT, Murphy D. Characteristics and changes of pediatric therapeutic trials under the Best Pharmaceuticals for Children Act. J Pediatr 2018;192:8-12.
- U.S. Senate, Health, Education, Labor, and Pensions Committees. S.3239 – Research to Accelerate Cures and Equity for Children or the RACE for Children Act. www.congress.gov/bill/114th-congress/senate-bill/3239 (consulté le 29 avril 2019).
- Institute for Advanced Clinical Trials (I-ACT) for Children. www.iactc.org (consulté le 31 janvier 2019).
- European Medicines Agency. Partners and network. www.ema.europa.eu/en/partners-networks/networks/european-network-paediatric-research-european-medicines-agency-enpr-ema (consulté le 29 avril 2019).
- U.S. Food and Drug Administration. Best Pharmaceuticals for Children Act and Pediatric Research Equity Act. www.fda.gov/ScienceResearch/SpecialTopics/PediatricTherapeuticsResearch/ucm509707.htm (consulté le 29 avril 2019).
- Olski TM, Lampus SF, Gherarducci G, Saint Raymong A. Three years of paediatric regulation in the European Union. Eur J Clin Pharmacol 2011;67(3):245-52.
- McMahon AW, Dal Pan G. Assessing drug safety in children – The role of real world data. N Engl J Med 2018;378(23):2155-7.
- van der Lee JH, Wesseling J, Tanck MW, Offringa M. Efficient ways exist to obtain the optimal sample size in clinical trials in rare diseases. J Clin Epidemiol 2008;61(4):324-30.
- Gouvernement of Canada. Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa). https://laws.justice.gc.ca/PDF/2014_24.pdf (consulté le 13 mai 2019).
- National Academies of Sciences, Engineering, Medicine. Characterizing Uncertainty in the Assessment of Benefits and Risks of Pharmaceutical Products: Workshop in Brief (2014). www.nap.edu/catalog/21679/characterizing-uncertainty-in-the-assessment-of-benefits-and-risks-of-pharmaceutical-products (consulté le 29 avril 2019).
- Gilpin A, Autmizguine J, Allakhverdi Z et coll. A pan-Canadian study on the compounded medicines most in need of commercialized oral pediatric formulations. Paediatr Child Health 2018;23(Issue suppl 1):e53.
- Kelly LE, Ito S, Woods D et coll. A comprehensive list of items to be included on a pediatric drug monograph. J Pediatr Pharmacol Ther 2017;22(1): 48-59.
- van der Zanden TM, de Wildt SN, Liem Y et coll. Developing a paediatric drug formulary for the Netherlands. Arch Dis Child 2017;102(4):357-61.
- Santé Canada. Renforcer l’utilisation des données probantes du monde réel sur les médicaments, le 22 août 2018. www.canada.ca/fr/sante-canada/organisation/transparence/transparence-ouverture-en-matiere-reglementation/examens-reglementaire-materiel-medical/renforcer-utilization-donees-probantes-monde-reel-medicaments.html (consulté le 29 avril 2019).
- Osokogu OU, Dukanovic J, Ferrajolo C et coll. Pharmacoepidemiological safety studies in children: A systematic review. Pharmacoepidemiol Drug Saf 2016;25(8):861-70.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.