Document de principes
Les applications de l’échographie au point d’intervention en soins intensifs néonatals : une perspective canadienne
Affichage : le 30 juillet 2025
Auteur(s) principal(aux)
Michael Narvey MD, Nina Stein MD, Yasser Elsayed MD, Ph. D.; Société canadienne de pédiatrie, Comité d’étude du fœtus et du nouveau-né
Résumé
L’échographie au point d’intervention est un outil d’évaluation clinique portatif d’appoint qui, entre les mains de cliniciens formés, peut contribuer au diagnostic différentiel, éclairer les options thérapeutiques et améliorer les interventions clés. En situation d’urgence à l’unité de soins intensifs néonatals, elle peut sauver des vies lorsqu’elle est utilisée en temps réel pour l’examen d’une tamponnade cardiaque, d’un épanchement pleural ou d’un pneumothorax. Puisque l’intérêt pour ce type d’examen augmente, des stages postdoctoraux structurés sur le sujet ont été créés en médecine d’urgence et en soins intensifs au Canada, et de nombreux établissements nord-américains ont commencé à l’intégrer. Le présent document de principes porte sur l’état actuel de l’échographie néonatale au point d’intervention, y compris les difficultés à la déployer, propose un parcours de formation et contient des conseils d’utilisation axés sur les diagnostics et les diverses interventions.
Mots-clés : échographie; néonatal; POCUS
L’échographie au point d’intervention (POCUS) a d’abord été utilisée en médecine chez les adultes, mais son intérêt s’est beaucoup aiguisé en néonatalité ces dernières années. Elle peut être salvatrice lorsqu’elle est utilisée pour détecter rapidement un pneumothorax, un épanchement péricardique, une hémorragie interne, une lésion intestinale ou des urgences cardiovasculaires[1]. Elle ne remplace par l’imagerie habituelle exécutée et interprétée par un radiologue ou un cardiologue, mais ses images particulières peuvent contribuer à détecter un état physiopathologique et à intervenir rapidement. Grâce à la POCUS, les cliniciens traitants peuvent intégrer rapidement les données échographiques obtenues et restreindre les probabilités prétests relatives à un vaste éventail d’affections[1]-[4].
Pour garantir des pratiques sécuritaires, efficaces et homogènes, les programmes canadiens de POCUS doivent se doter de normes de formation et de soins. Ailleurs, il existe des cursus structurés pour réaliser ces objectifs, dont le détail (et les obstacles pour y parvenir) figure dans un document novateur sur la POCUS de l’American Academy of Pediatrics (AAP)[5].
Pour des questions de longueur et d’intégrité, certains tableaux et figures du présent document de principes renvoient aux originaux du document-cadre de l’American Academy of Pediatrics intitulé Use of Point-of-Care Ultrasonography in the NICU for Diagnostic and Procedural Purposes. Les numéros des tableaux et les figures du document de principes de la Société canadienne de pédiatrie ne correspondent pas à ceux du rapport technique de l’AAP.
De nombreux praticiens en soins intensifs néonatals peuvent acquérir une formation en POCUS, y compris les résidents en surspécialité, les résidents en pédiatrie, d’autres membres du personnel médical, les infirmières, les infirmières praticiennes et les inhalothérapeutes[1][6][7]. De plus en plus de données probantes révèlent que la POCUS, même utilisée comme intervention d’appoint, peut améliorer les résultats cliniques du nouveau-né, permettre d’adapter les recommandations physiologiques des soins et sauver des vies dans de nombreuses situations cliniques[6][7].
Le présent document de principes traite de l’état actuel de la POCUS néonatale, y compris certaines difficultés relatives à sa mise en œuvre, propose un parcours de formation et contient des conseils d’utilisation, notamment en matière de diagnostic et d’intervention.
Les caractéristiques d’un examen de POCUS
Il vaut mieux considérer la POCUS comme complément de l’examen physique parce qu’elle permet de détecter les caractéristiques physiopathologiques en temps réel et se distingue donc de l’échographie habituelle, effectuée par un radiologue. Les évaluations par POCUS réalisées par le clinicien au chevet du patient sont exécutées d’urgence pour circonscrire la physiopathologie, contrairement à l’imagerie accomplie en radiologie à un moment préétabli pour des besoins courants ou non urgents. Au Canada, l’imagerie collaborative en soins intensifs néonatals devrait s’inspirer de la relation entre les cardiologues pédiatres qui participent au déploiement de l’échocardiographie néonatale ciblée[6][7]. Selon ce modèle, les cardiologues pédiatres s’attachent à détecter les anomalies cardiaques structurelles, tandis que les personnes qui utilisent la POCUS ciblent les anomalies du fonctionnement cardiaque. Par ailleurs, bon nombre des mesures obtenues divergent entre les deux groupes, puisque les objectifs des évaluations sont différents. Le tableau 1 des directives de l’AAP sur la POCUS (en anglais) distingue le praticien de la POCUS néonatale du radiologue qui réalise des échographies.
Des scénarios cliniques sur l’utilisation de l’échographie au point d’intervention
La POCUS, qui contribue à confirmer l’étiologie de certains états néonatals critiques, est indiquée dans les exemples suivants pour déterminer si la stratégie de soins en cours est appropriée ou doit être modifiée :
- On ne sait pas vraiment pourquoi un nouveau-né ne répond pas aux stratégies de réanimation habituelles. Dans de tels cas, une POCUS pulmonaire, abdominale, crânienne et cardiaque ciblée peut être utile.
- L’oxygénation d’un nouveau-né qui ne répond pas aux stratégies d’assistance respiratoire, invasive ou non, se détériore. Dans ce cas, une POCUS pulmonaire, cardiaque et abdominale ciblée peut être utile.
- Les étapes de prise en charge initiales ne résolvent pas l’instabilité hémodynamique ou le choc, y compris l’hypotension, l’acidose métabolique ou lactique ou l’atteinte du fonctionnement rénal. Une POCUS abdominale, crânienne et cardiaque ciblée peut être utile.
- L’apparition aiguë d’une anémie soulève de fortes craintes d’hémorragie. La POCUS peut détecter des collections de sang dans l’espace intracrânien, péricardique, pleural, sous-capsulaire hépatique ou péritonéal.
Les applications diagnostiques
La POCUS est utilisée pour obtenir de l’information qui échapperait autrement à la détection pendant l’examen clinique.
Les affections pulmonaires
Un avantage important de l’échographie par rapport à la radiographie pulmonaire, c’est l’élimination de la radiation ionisante émise par la radiographie [9][10]. Un praticien compétent peut souvent omettre la radiographie de confirmation en toute confiance, si bien qu’essentiellement, la POCUS la remplace. Comme on l’a indiqué plus haut, la POCUS et la radiographie peuvent toutefois la compléter. La POCUS pulmonaire est utile pour détecter une consolidation, une atélectasie, un œdème pulmonaire, un épanchement pleural ou un pneumothorax. Les interfaces air-liquide peuvent orienter le clinicien vers certains diagnostics cliniques en fonction des configurations dévoilées par la sonde d’échographie. Par exemple :
- des lignes A sont présentes dans un poumon rempli d’air (réflexions horizontales des lignes pleurales du poumon plein d’air);
- des lignes B reflètent la présence de liquide interstitiel ou alvéolaire (lignes verticales s’étirant de la plèvre à partir du transducteur jusqu’à la fin de l’image visible).
Les irrégularités pleurales et les zones hypoéchogènes peuvent également refléter une consolidation. Les épanchements pleuraux peuvent être décelés par des collections anéchogènes au-dessus du diaphragme.
Le patient est généralement en décubitus dorsal pendant la POCUS pulmonaire. Après avoir modifié la profondeur et le grain de l’image, n’importe quelle sonde peut être utilisée pour bien laisser paraître les configurations, mais une sonde linéaire est souvent favorisée à cause de la clarté des images. Quatre configurations d’observation pulmonaire contribuent au score de gravité global, dont les valeurs oscillent entre un résultat minimal de 0 et un résultat maximal de 3 dans chaque zone. Puisque chaque poumon se divise en trois zones, le score peut varier entre 0 et un maximum de 18.
La figure 1 (ci-dessous) démontre les configurations habituelles et propose des interventions en cas d’affections courantes chez le nouveau-né. La figure 2, tirée du document de l’AAP sur la POCUS (en anglais), démontre les scores de la POCUS pulmonaire et prédit la réponse à des interventions thérapeutiques chez les nouveau-nés atteints d’hypoxémie. La figure 3, qui provient également du document de l’AAP sur la POCUS (en anglais), présente un algorithme d’interprétation de la POCUS pulmonaire en fonction de diverses affections pulmonaires néonatales[11][12].
Figure 1. Quatre configurations types observées à l’échographie pulmonaire

SDR syndrome de détresse respiratoire, TTN tachypnée transitoire du nouveau-né
Considérations particulières relatives au poumon :[11][13][14]
- Le syndrome de détresse respiratoire a un aspect différent de la tachypnée transitoire du nouveau-né (voir le tableau 2, scénario A, en anglais, qui correspond au tableau 1 du document de l’AAP sur la POCUS).
- Une fois le syndrome de détresse respiratoire diagnostiqué, la POCUS peut contribuer à déterminer l’intérêt d’administrer un surfactant au nouveau-né prématuré (voir la figure 4, ci-dessous)[10][15][16].
- Le pneumothorax est facile à détecter et a l’avantage d’être plus rapide à diagnostiquer que si l’on privilégie la radiographie traditionnelle.
Figure 4. Algorithme pour l’administration de surfactant guidée par la POCUS pulmonaire

AG âge gestationnel; ARI assistance respiratoire intermittente, CPAP pression positive continue, ÉGP échographie pulmonaire, FiO2 fraction d’oxygène dans l’air inspiré, INSURE intubation-surfactant-extubation, PEP pression expiratoire positive, SDR syndrome de détresse respiratoire, TMIS traitement mini-invasif au surfactant
Source : Traduction autorisée du Health Sciences Centre Winnipeg
Caractéristiques du pneumothorax à l’échographie :
- Aucun glissement pleural
- Présence de lignes A, mais pas de lignes B
- Signe du « point pulmonaire » qui sépare les tissus pulmonaires de l’accumulation d’air libre
- Présence de lignes parallèles horizontales détectées en mode M (qu’on appelle aussi « signe du code-barre »). Voir le tableau 2, scénario B, qui correspond au tableau 1 du document de l’AAP sur la POCUS (en anglais)[17].
Un pneumothorax peut être détecté grâce à ces signes, mais il faut aussi en mesurer le volume et déterminer s’il est nécessaire de procéder à un drainage thérapeutique avant la thoracentèse ou l’installation du drain thoracique.
- Des affections comme la pneumonie, l’hémorragie pulmonaire aiguë ou un œdème pulmonaire grave sont responsables d’une consolidation des segments du parenchyme pulmonaire. L’atélectasie (voir le tableau 2, scénario D, qui correspond au tableau 1 du document de l’AAP sur la POCUS, en anglais) peut produire un tableau clinique similaire, mais s’y ajoute une ligne pleurale anormale et des bronchogrammes aériques. La POCUS pulmonaire, utilisée pour évaluer des consolidations chez des enfants de divers âges, a une spécificité de 84 % par rapport à l’évaluation clinique et à la radiographie pulmonaire combinées[18].
- La POCUS pulmonaire peut détecter même de petits épanchements pleuraux, qu’on observe généralement dans des régions dépendantes et sous forme d’espaces anéchogènes ou d’espaces entre la plèvre pariétale et la plèvre viscérale. Elle peut également contribuer à déterminer les caractéristiques des liquides. La thoracentèse demeure la norme pour différencier les transsudats, les exsudats et le sang (hémorragie), mais le liquide peut également emprunter divers aspects selon le mécanisme d’accumulation (p. ex., anéchogène, granulaire, fibrineux, septé ou compartimenté)[1][5].
- Une POCUS des voies respiratoires peut évaluer la mobilité des cordes vocales[17]. Pour détecter la parésie ou la paralysie unilatérale ou bilatérale des cordes vocales, on peut placer la sonde linéaire à haute fréquence sur le plan transverse, dans le quadrant supérieur du cartilage thyroïdien (sous-mentonnier)[19]-[20].
- Il est également possible de visualiser le mouvement diaphragmatique à l’aide de la POCUS pulmonaire, en mode M (mouvement) ou B (imagerie bidimensionnelle) lorsqu’on soupçonne un dysfonctionnement du nerf phrénique, tant chez le nouveau-né qui respire spontanément que chez celui qui est intubé.
Les affections cardiaques
La POCUS cardiaque est devenue un élément fondamental du diagnostic et de la prise en charge du « nouveau-né qui décompense » dans les centres canadiens qui ont la capacité de l’utiliser. Les protocoles pour gérer ces cas ont été publiés[1].
La POCUS cardiaque exige une formation plus longue et une meilleure maîtrise de la technique. Le Canada dispose de deux programmes d’évaluation cardiaque néonatale primaire. Le premier vise à évaluer les soupçons de cardiopathie congénitale, de myocardiopathie ou de décompensation cardiaque liée aux arythmies. Le deuxième est le programme d’échocardiographie néonatale ciblée ou d’hémodynamie néonatale intégrée, qui consiste à procéder à une évaluation complète du fonctionnement cardiovasculaire. Le deuxième programme ne peut être effectué que par un néonatologiste qui a terminé un stage postdoctoral en échocardiographie néonatale ciblée et en hémodynamie, conformément aux directives du Collège royal des médecins et chirurgiens du Canada[5][20]-[22].
Les affections abdominales
La POCUS procure une imagerie en temps réel des viscères abdominaux afin d’examiner le péristaltisme, de détecter des quantités minimes à importantes d’ascite et de mesurer l’épaisseur de la paroi intestinale. Elle peut également évaluer la circulation sanguine de la paroi intestinale à l’aide du Doppler couleur afin de déterminer la présence d’une sous-perfusion ou d’une surperfusion dans les états inflammatoires, par exemple. La radiographie peut seulement fournir un cliché unidirectionnel du tractus gastro-intestinal. Aux rayons X, il peut être difficile de distinguer une véritable pneumatose de la présence d’air le long de la lumière intestinale[21]-[23]. La POCUS peut établir la gravité des lésions attribuables à l’entérocolite nécrosante, au syndrome d’entérocolite induite par les protéines alimentaires ou à l’ischémie intestinale[24].
Les marqueurs d’échographie intestinale peuvent être localisés ou généralisés dans la plupart des quadrants abdominaux[1][5][24]. Les résultats de la POCUS devraient toujours être intégrés aux observations cliniques et aux autres marqueurs d’examens, mais la POCUS peut détecter une ascite hémorragique associée à l’anémie[5], de même que des hémorragies sous-capsulaires hépatiques ou spléniques secondaires à un traumatisme ou à une maladie hémorragique du nouveau-né. L’imagerie devrait inclure les lobes hépatiques droit et gauche, la rate, les quatre quadrants abdominaux et l’intestin moyen dans deux plans perpendiculaires (sagittal et transverse)[25]. Le tableau 3, qui correspond au tableau 2 du document de l’AAP sur la POCUS (en anglais) décrit la sensibilité et la spécificité du diagnostic des affections intestinales, en tenant compte des considérations techniques. Les observations habituelles à la POCUS abdominale, indicatrices d’une lésion intestinale, figurent au tableau 4, ci-dessous[24]-[26].
| Tableau 4. Marqueurs d’échographie intestinale en cas de lésion intestinale | |
| Pneumatose kystique de l’intestin | |
| Forces | Considérations |
|
|
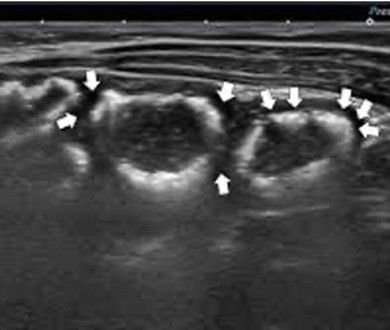 |
Les flèches indiquent où se trouve l’air dans la paroi intestinale |
| Gaz dans le système porte | |
| Forces | Considérations |
|
|
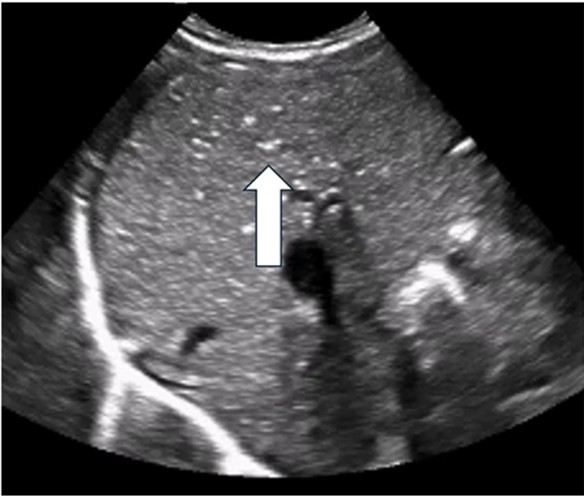 |
La flèche indique les gaz dans le système porte considérés comme des bulles échogènes dans le foie |
| Épaississement ou amincissement de la paroi intestinale | |
| Forces | Considérations |
|
|
|
|
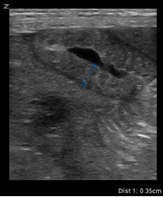
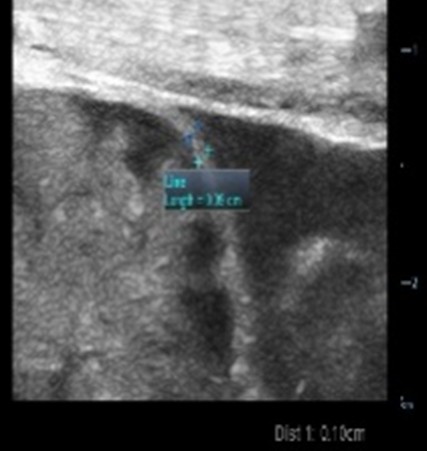 |
| Anses épaissies du grêle (0,35 cm) | Amincissement de la paroi colique |
| Liquides ou ascite péritonéaux | |
| Forces | Considérations |
|
|
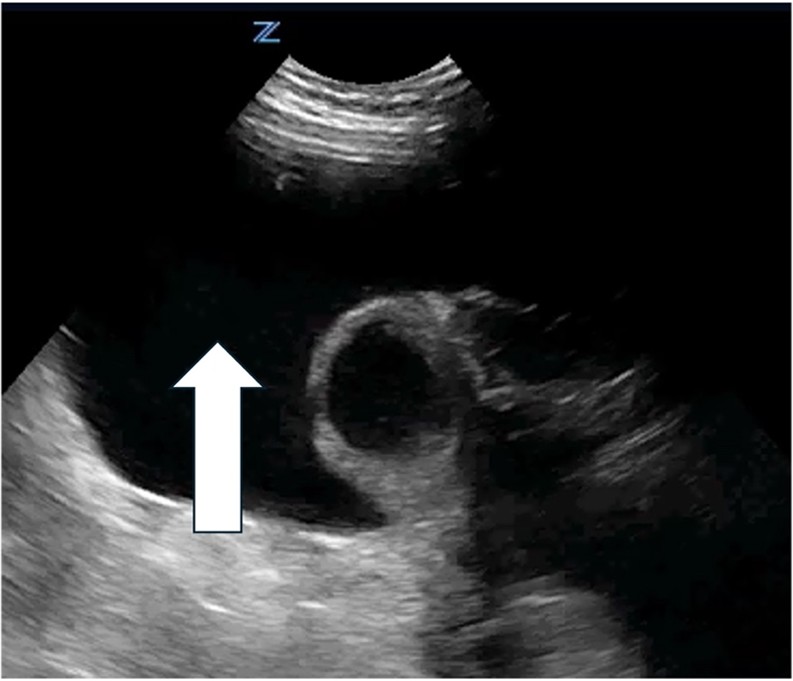 |
La flèche indique une collection de liquide péritonéal septé |
| Différenciation des couches de la paroi intestinale (qu’on appelle « signature » intestinale) | |
| Forces | Considérations |
|
|
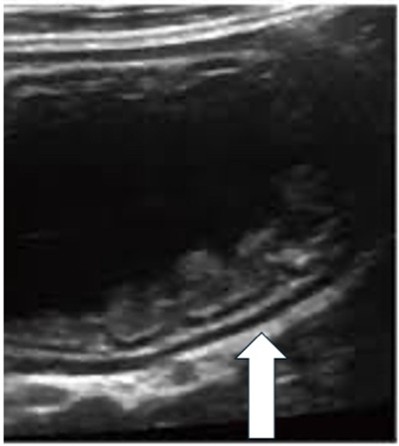 |
L’image magnifiée révèle cinq couches de la paroi intestinale, comportant deux couches hyoéchoïques, la muqueuse et la musculeuse. Suivent trois couches échogènes, c’est-à-dire l’interface entre la muqueuse et la lumière, la sous-muqueuse et la séreuse. |
| Hyperémie par Doppler couleur | |
| Forces | Considérations |
|
|
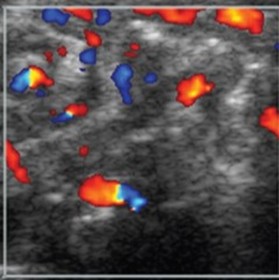 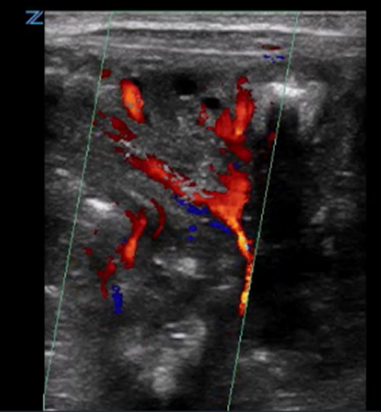 |
Première : L’image intestinale normale révèle une configuration tachetée de trois à neuf couleurs, indicatrice d’une perfusion normale Seconde : Hyperémie au motif Y |
| Lésion ischémique de la paroi intestinale par Doppler couleur | |
| Forces | Considérations |
|
|
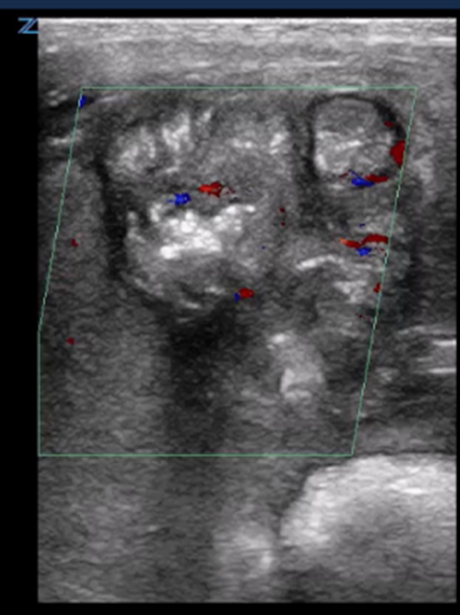 |
Le mouchetage couleur n’est pas clairement identifiable. |
| Anses intestinales dilatées fixes | |
| Forces | Considérations |
|
|
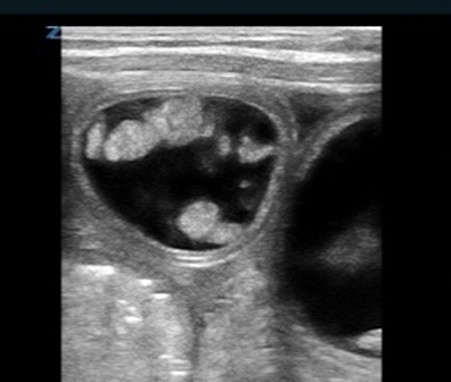 |
Anses dilatées du grêle |
| Pneumopéritoine | |
| Forces | Considérations |
|
|
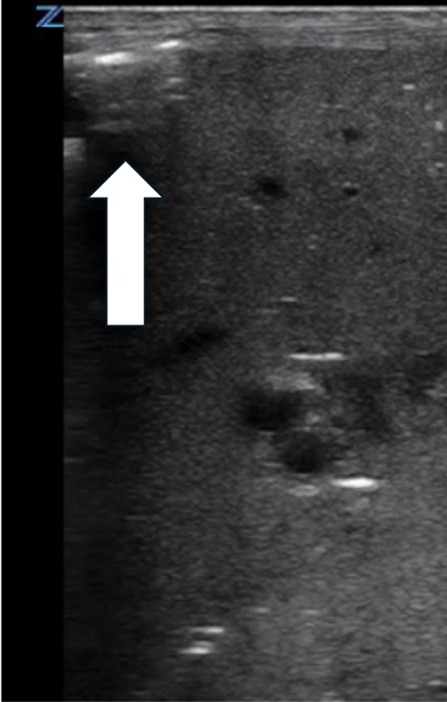 |
Petit pneumopéritoine qui n’a pas été vu aux rayons X |
D’autres marqueurs de l’échographie intestinale peuvent être détectés par la POCUS abdominale à l’aide du Doppler couleur, tels que l’absence de péristaltisme et l’accroissement ou la diminution de la circulation sanguine[24][25].
Quelle que soit l’application de la POCUS, il est essentiel de corréler les observations avec le contexte clinique du nouveau-né et de consulter en radiologie pour s’assurer de l’homogénéité des résultats.
Les affections crâniennes
Un radiologue devrait effectuer une échographie crânienne courante pour dépister et évaluer l’hémorragie intraventriculaire chez les nouveau-nés prématurés. Dans les cas aigus, en présence de soupçons d’hémorragie intracrânienne, il faut procéder à une POCUS crânienne d’urgence, en se servant de la fontanelle antérieure comme d’une « fenêtre acoustique » (voir le tableau 2, scénario H, qui correspond au tableau 1 du document de l’AAP sur la POCUS, en anglais[4][8][27].
Les affections urinaires
L’évaluation du volume d’urine dans la vessie peut confirmer une faible diurèse avant le cathétérisme ou la ponction suspubienne en vue d’une culture urinaire. Il est possible de mesurer la dimension de la vessie sur deux ou trois plans perpendiculaires, ainsi que d’en estimer le volume[2][28]. Le clinicien doit confirmer que la vessie du nouveau-né est pleine à l’aide de la POCUS avant de tenter une aspiration à l’aiguille, à la fois pour limiter la douleur et le nombre de tentatives et pour maximiser le débit d’urine[29].
Les protocoles diagnostiques
Le nouveau-né qui décompense
Une évaluation multiorganique systématique a été mise au point pour les nouveau-nés qui décompensent, à l’intention de tous les établissements dotés de compétences en POCUS. Elle tient compte des quatre systèmes organiques (poumon, cœur, abdomen et cerveau[1][8]) et peut être déployée en salle d’accouchement, dans les unités de soins intensifs néonatals canadiens, aux urgences et dans d’autres milieux de soins pédiatriques. La figure 5, qui correspond à la figure 4 du document de l’AAP sur la POCUS (en anglais) présente une approche graduelle et les interventions connexes[1].
Les applications interventionnelles
Le recours à la POCUS dans les unités néonatales est désormais considéré comme une pratique standard et sécuritaire dans de nombreux établissements.
L’accès vasculaire échoguidé
Le recours à la POCUS pour installer des cathéters centraux insérés par voie périphérique (CCIP) exige de la pratique et de l’habileté afin d’accéder aux petites veines des nouveau-nés[30]. Le positionnement de la pointe du cathéter était généralement déterminé par radiographie, mais la POCUS peut établir que les cathéters sont mal positionnés avec plus de précision, particulièrement chez les nouveau-nés de petit poids à la naissance[31]-[33].
La ponction lombaire
D’après l’imagerie obtenue à la fois dans l’axe long et dans l’axe court, la POCUS spinale fait appel à un transducteur linéaire pour établir l’emplacement optimal de l’aiguille en situant le cône médullaire et en déterminant à quelle distance de la peau insérer l’aiguille. Il existe une technique de ponction lombaire guidée par POCUS en temps réel[34].
L’aspiration de liquides (thoracocentèse, péricardiocentèse et paracentèse)
La visualisation optimale des points de collection de liquides à l’aide de la POCUS contribue à éviter des lésions aux organes adjacents[1][5][8].
Le positionnement de la sonde trachéale
L’évaluation des voies respiratoires par sonde d’échographie en position longitudinale peut contribuer à déterminer l’emplacement de la pointe distale de la sonde trachéale, même chez les nouveau-nés prématurés. La pointe de la sonde trachéale peut être évaluée en vue suprasternale afin de s’assurer qu’elle soit placée de un à deux centimètres au-dessus de la branche de l’artère pulmonaire droite[19][20].
Si la POCUS était à la disposition des équipes de transport, les pratiques et les résultats liés à la sonde trachéale pourraient s’améliorer en milieu rural ou éloigné.
Le déploiement du programme de POCUS
Il est possible d’entreprendre une formation sur la POCUS dans les centres où il n’y a pas de compétences locales grâce au modèle de formation simple et reproductible qui figure dans les directives de l’European Society of Paediatric and Neonatal Intensive Care sur l’utilisation de la POCUS chez les nouveau-nés et les enfants gravement malades[2]. Le soutien des rendez-vous hors site par des experts, le mentorat à distance par télésanté et la tenue d’ateliers dans des centres de formation reconnus constituent des premières étapes importantes vers le déploiement plus généralisé de la POCUS au Canada. Les établissements qui désirent intégrer la POCUS aux soins néonatals doivent se fixer des normes pour garantir l’homogénéité en matière d’acquisition et d’interprétation des images hors site. Les hôpitaux qui recourent à la POCUS en soins cliniques doivent standardiser le mode de consignation des résultats des images aux dossiers des patients.
Recommandations
- À l’unité de soins intensifs néonatals, le clinicien doit envisager d’utiliser l’échographie au point d’intervention (POCUS) pour compléter l’examen physique du nouveau-né, qu’il doit la considérer comme une forme d’imagerie distincte de celle exécutée par un radiologue.
- Le clinicien doit corréler les observations de la POCUS avec le contexte clinique du nouveau-né, les signes et les autres marqueurs d’examen, et consulter en radiologie pour s’assurer de l’homogénéité des soins.
- Dans les unités de soins intensifs néonatals canadiennes, le clinicien doit donner l’exemple d’une imagerie collaborative, conformément à la relation entre les cardiologues pédiatres qui participent à la mise en œuvre de l’échocardiographie néonatale ciblée. Les cardiologues fournissent une confirmation de la structure tandis que la POCUS s’intéresse au fonctionnement du cœur et de l’état hémodynamique général du nouveau-né.
- Selon l’hypothèse que le centre possède les compétences et la capacité nécessaires, le clinicien doit envisager une POCUS d’urgence dans les cas suivants :
- On ne sait pas exactement pourquoi un nouveau-né ne répond pas aux stratégies de réanimation habituelles.
- L’oxygénation se détériore malgré l’assistance respiratoire.
- Les étapes de prise en charge initiales n’atténuent pas l’instabilité hémodynamique ou le choc.
- Une anémie aiguë soulève des craintes d’hémorragie.
- Toujours selon l’hypothèse que le centre possède les compétences et la capacité nécessaires, le clinicien doit envisager la POCUS pour limiter la douleur du nouveau-né et les tentatives infructueuses tout en facilitant l’accès à l’insertion d’un cathéter central, à l’installation d’une sonde trachéale, à la ponction lombaire et à la position de l’aiguille pour aspirer l’urine ou d’autres liquides.
- Il est bon de recourir à la POCUS en cas de soupçon de pneumothorax, d’épanchement péricardique, d’hémorragie interne ou de lésion intestinale ou en présence d’urgences cardiovasculaires.
- Il est recommandé d’utiliser une sonde linéaire pour effectuer la POCUS pulmonaire afin de garantir une image claire.
- Lorsqu’une échographie de dépistage de l’hémorragie intraventriculaire chez un nouveau-né prématuré soulève des préoccupations, le clinicien doit effectuer une POCUS crânienne d’urgence et se servir de la fontanelle antérieure comme d’une « fenêtre acoustique ».
- Dans les cas d’affection abdominale, la POCUS permet d’établir la gravité des lésions attribuables à une entérocolite nécrosante, à un syndrome d’entérocolite induite par les protéines alimentaires ou à une lésion ischémique intestinale.
Remerciements
Le comité de la pédiatrie communautaire, le comité des soins aigus et le comité directeur de la section de la médecine néonatale et périnatale de la Société canadienne de pédiatrie, de même que des membres de l’Association canadienne des radiologues, ont révisé le présent document de principes.
COMITÉ D’ÉTUDE DU FŒTUS ET DU NOUVEAU-NÉ DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2023-2024)
Membres : Michael Narvey MD (président), Heidi Budden MD (représentante du conseil), Souvik Mitra MD M. Sc., Eugene Ng MD, Gabriel Altit MD, Nicole Radziminski MD, Anne-Sophie Gervais MD (membre résidente)
Représentants : William Ehman (Le Collège des médecins de famille du Canada), Chantal Nelson (Agence de la santé publique du Canada), Eric Eichenwald (American Academy of Pediatrics, comité d’étude du fœtus et du nouveau-né), Douglas Wilson (La Société des obstétriciens et gynécologues du Canada), Isabelle Milette (Association canadienne des infirmières et infirmiers en néonatologie), Emer Finan MBBCH (section de la médecine néonatole et périnatale de la SCP)
Auteurs principaux : Michael Narvey MD, Nina Stein MD, Yasser Elsayed MD, Ph. D.
Financement
Aucun financement n’a été accordé pour la préparation du présent manuscrit.
Conflits d’intérêts potentiels
Aucun auteur n’a de conflits d’intérêts à déclarer.
Références
- Elsayed Y, Wahab MGA, Mohamed A et coll. Point-of-care ultrasound (POCUS) protocol for systematic assessment of the crashing neonate—expert consensus statement of the international crashing neonate working group. Eur J Pediatr 2023;182(1):53-66. doi : 10.1007/s00431-022-04636-z
- Singh Y, Tissot C, Fraga MV et coll. International evidence-based guidelines on point of care ultrasound (POCUS) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Paediatric and Neonatal Intensive Care (ESPNIC). Crit Care 2020;24(1):65. doi : 10.1186/s13054-020-2787-9
- Brant JA, Orsborn J, Good R, Greenwald E, Mickley M, Toney AG. Evaluating a longitudinal point-of-care-ultrasound (POCUS) curriculum for pediatric residents. BMC Med Educ 2021;21(1):64. doi : 10.1186/s12909-021-02488-z
- Ecury-Goossen GM, Camfferman FA, Leijser LM, Govaert P, Dudink J. State of the art cranial ultrasound imaging in neonates. J Vis Exp 2015;(96):e52238. doi : 10.3791/52238
- Stewart DL, Elsayed Y, Fraga MV, Coley BD, Annam A, Milla SS; American Academy of Pediatrics, comité d'étude du fœtus et du nouveau-né, section de la radiologie. Clinical report: Use of point-of-care ultrasonography in the NICU for diagnostic and procedural purposes. Pediatrics 2022;150(6):e2022060052
- Elsayed Y, Sheldon J, Gigolyk S. The impact of respiratory therapist performed point-of-care lung ultrasound on the respiratory care in neonates, Manitoba experience, Canada. Am J Perinatol 2024;41(S 01):e1539-e1545. doi : 10.1055/s-0043-1768042
- Elsayed Y, Narvey M, Lashin A, Alammary D, Gigolyk S, Louis D. Point of care lung ultrasound service in neonatal intensive care: Five years of experience in Manitoba, Canada. J Perinatol 2022;42(9):1228-32. doi : 10.1038/s41372-022-01455-w
- Stewart DL, Elsayed Y, Fraga MV, Coley BD, Annam AA, Milla SS; American Academy of Pediatrics, comité d’étude du fœtus et du nouveau-né, section de la radiologie. Technical report: Use of point-of-care ultrasonography in the NICU for diagnostic and procedural purposes. Pediatrics 2022;150(6):e2022060053. doi : 10.1542/peds.2022-060053
- Escourrou G, De Luca D. Lung ultrasound decreased radiation exposure in preterm infants in a neonatal intensive care unit. Acta Paediatr 2016;105(5):e237-9. doi : 10.1111/apa.13369
- Raimondi F, Yousef N, Migliaro F, Capasso L, De Luca D. Point-of-care lung ultrasound in neonatology: Classification into descriptive and functional applications. Pediatr Res 2021;90(3):524-31. doi : 10.1038/s41390-018-0114-9
- Elsayed YN, Hinton M, Graham R, Dakshinamurti S. Lung ultrasound predicts histological lung injury in a neonatal model of acute respiratory distress syndrome. Pediatr Pulmonol 2020;55(11):2913-23. doi : 10.1002/ppul.24993
- Soliman RM, Elsayed Y, Said RN, Abdulbaqi AM, Hashem RH, Aly H. Prediction of extubation readiness using lung ultrasound in preterm infants. Pediatr Pulmonol 2021;56(7):2073-80. doi : 10.1002/ppul.25383
- Corsini I, Parri N, Ficial B, Dani C. Lung ultrasound in the neonatal intensive care unit: Review of the literature and future perspectives. Pediatr Pulmonol 2020;55(7):1550-62. doi : 10.1002/ppul.24792
- Abdelmawla M, Louis D, Narvey M, Elsayed Y. A lung ultrasound severity score predicts chronic lung disease in preterm infants. Am J Perinatol 2019;36(13):1357-61. doi : 10.1055/s-0038-1676975
- De Martino L, Yousef N, Ben-Ammar R, Raimondi F, Shankar-Aguilera S, De Luca D. Lung ultrasound score predicts surfactant need in extremely preterm neonates. Pediatrics 2018;142(3):e20180463. doi : 10.1542/peds.2018-0463
- Brat R, Yousef N, Klifa R, Reynaud S, Shankar Aguilera S, De Luca D. Lung ultrasonography score to evaluate oxygenation and surfactant need in neonates treated with continuous positive airway pressure. JAMA Pediatr 2015;169(8):e151797. doi : 10.1001/jamapediatrics.2015.1797
- Raimondi F, Rodriguez Fanjul J, Aversa S et coll. Lung ultrasound for diagnosing pneumothorax in the critically ill neonate. J Pediatr 2016;175:74-78.e1. doi : 10.1016/j.jpeds.2016.04.018
- Santos TM, Franci D, Coutinho CMG et coll. A simplified ultrasound-based edema score to assess lung injury and clinical severity in septic patients. Am J Emerg Med 2013;31(12):1656-60. doi : 10.1016/j.ajem.2013.08.053
- Chowdhry R, Dangman B, Pinheiro JMB. The concordance of ultrasound technique versus X-ray to confirm endotracheal tube position in neonates. J Perinatol 2015;35(7):481-4. doi : 10.1038/jp.2014.240
- de Kock SH, Otto SF, Joubert G. The feasibility of determining the position of an endotracheal tube in neonates by using bedside ultrasonography compared with chest radiographs. SAJCH 2015;9(1):3-5. doi : 10.7196/SAJCH.740
- Becker BA, Lahham S, Gonzales MA et coll. A prospective, multicenter evaluation of point-of-care ultrasound for small-bowel obstruction in the emergency department. Acad Emerg Med 2019;26(8):921-30. doi : 10.1111/acem.13713
- Cuna AC, Lee JC, Robinson AL, Allen NH, Foley JE, Chan SS. Bowel ultrasound for the diagnosis of necrotizing enterocolitis: A meta-analysis. Ultrasound Q 2018;34(3):113-8. doi : 10.1097/RUQ.0000000000000342
- Raghuveer TS, Lakhotia R, Bloom BT, Desilet-Dobbs DA, Zarchan AM. Abdominal ultrasound and abdominal radiograph to diagnose necrotizing enterocolitis in extremely preterm infants. Kansas J Med 2019;12(1):24-7. doi : 10.17161/kjm.v12i1.11707
- Elsayed Y, Seshia M. A new intestinal ultrasound integrated approach for the management of neonatal gut injury. Eur J Pediatr 2022;181(4):1739-49. doi : 10.1007/s00431-021-04353-z
- Elsayed Y, Louis D, Hinton M, Seshia M, Alvaro R, Dakshinamurti S. A novel integrated clinical-biochemical-radiological and sonographic classification of necrotizing enterocolitis. Am J Perinatol 2024;41(S 01):e3401-12. doi : 10.1055/s-0043-1778666
- Elsayed Y, Soylu H. Point-of-care abdominal ultrasound in pediatric and neonatal intensive care units. Eur J Pediatr 2024;183(5):2059-69. doi : 10.1007/s00431-024-05443-4
- van Wezel-Meijler G, Steggerda SJ, Leijser LM. Cranial ultrasonography in neonates: Role and limitations. Semin Perinatol 2010;34(1):28-38. doi : 10.1053/j.semperi.2009.10.002
- Miller LE, Stoller JZ, Fraga MV. Point-of-care ultrasound in the neonatal ICU. Curr Opin Pediatr 2020;32(2):216-27. doi : 10.1097/MOP.0000000000000863
- Kiernan SC, Pinckert TL, Keszler M. Ultrasound guidance of suprapubic bladder aspiration in neonates. J Pediatr 1993;123(5):789-91. doi : 10.1016/S0022-3476(05)80861-3
- Barone G, Pittiruti M, Ancora G, Vento G, Tota F, D’Andrea V. Centrally inserted central catheters in preterm neonates with weight below 1500 g by ultrasound-guided access to the brachio-cephalic vein. J Vasc Access 2021;22(3):344-52. doi : 10.1177/1129729820940174
- Fraga MV, Stoller JZ, Glau CL et coll. Seeing is believing: Ultrasound in pediatric procedural performance. Pediatrics 2019;144(5):e20191401. doi : 10.1542/peds.2019-1401
- Nguyen J. Ultrasonography for central catheter placement in the neonatal intensive care unit—A review of utility and practicality. Am J Perinatol 2016;33(6):525-30. doi : 10.1055/s-0035-1569987
- Katheria AC, Fleming SE, Kim JH. A randomized controlled trial of ultrasound-guided peripherally inserted central catheters compared with standard radiograph in neonates. J Perinatol 2013;33(10):791-4. doi : 10.1038/jp.2013.58
- Stoller JZ, Fraga MV. Real-time ultrasound-guided lumbar puncture in the neonatal intensive care unit. J Perinatol 2021;41(10):2495-8. doi : 10.1038/s41372-021-01152-0
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.