Document de principes
La prévention et le traitement des infections chez les enfants présentant une asplénie ou une hyposplénie
Affichage : le 6 novembre 2019 | Reconduit : le 21 novembre 2024
Auteur(s) principal(aux)
Marina I Salvadori, Victoria E Price; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Révisé par Nicole Le Saux, Marc Lebel, Dorothy Moore, Karina Top, Michelle Barton-Forbes, Ari Bitnun, Laura Sauve, Ruth Grimes
Résumé
Les enfants présentant une asplénie ou une hyposplénie sont vulnérables à un sepsis fulgurant. Les dispensateurs de soins qui s’occupent d’enfants présentant une asplénie doivent s’assurer des meilleurs résultats cliniques possible grâce à des stratégies préventives axées sur l’éducation des parents et des patients, la vaccination, la prophylaxie antibiotique et la prise en charge vigoureuse de l’infection présumée. La mise à jour du présent document de principes remplace le document de la SCP de 2014, car de nouveaux vaccins ont été mis en marché et l’information sur l’épidémiologie a évolué.
Mots clés : Antibiotic prophylaxis; Immunization; Sepsis; Splenectomy
Les enfants peuvent avoir une fonction splénique absente ou défaillante en raison de l’absence anatomique congénitale de la rate, de son ablation chirurgicale ou de problèmes médicaux qui rendent la fonction splénique déficiente ou inexistante. Au Canada, l’anémie falciforme est une cause courante de cette affection. L’absence de rate et une fonction splénique défaillante s’associent à un risque élevé de sepsis bactérien fulminant, particulièrement en présence de bactéries encapsulées. Les enfants splénectomisés de moins de 15 ans et les nourrissons présentant une asplénie congénitale sont plus à risque de sepsis fulgurant que les adultes après une splénectomie.[1] Les personnes atteintes de troubles sanguins sous-jacents, telles les hémoglobinopathies (p. ex., anémie falciforme, thalassémie majeure) ou la sphérocytose héréditaire, sont plus vulnérables que ceux qui ont subi une splénectomie après un traumatisme.[1] Les patients présentant une asplénie sont vulnérables à un sepsis fulgurant tout au long de leur vie, la fréquence la plus élevée s’observant dans les trois ans suivant la splénectomie ou pendant les trois premières années suivant la naissance lorsque l’asplénie est congénitale.[2] Les patients présentant une asplénie qui sont atteints d’un sepsis causé par des organismes encapsulés ont un taux de décès de 50 % à 70 %, le plus élevé s’observant chez les enfants de moins de deux ans.[3][4]
Chez les patients présentant une asplénie, la plupart des sepsis fulminants sont causés par des bactéries encapsulées par une capsule polysaccharidique. Le Streptococcus pneumoniae, l’organisme responsable du plus grand nombre de sepsis, est isolé dans au moins 50 % des cas. D’autres bactéries encapsulées (p. ex., l’Haemophilus influenzae de type b (Hib), le Neisseria meningitidis et les espèces de Salmonella moins courantes que le pneumocoque).[5] La morbidité du sepsis associé aux morsures de chat ou de chien attribuables aux espèces de Capnocytophaga est élevée.[6] D’autres causes de sepsis, comme l’infection à Escherichia coli ou, plus récemment, à Bordetella holmesii, ont été signalées.[7] Les patients présentant une asplénie sont également plus vulnérables à un paludisme grave ou fatal[8] et à une infection par le protozoaire Babesia.[9]
Les dispensateurs de soins qui soignent des enfants présentant une asplénie doivent s’assurer des meilleurs résultats cliniques possible grâce à des stratégies préventives : l’éducation des parents et des patients, la vaccination, la prophylaxie antibiotique et la prise en charge vigoureuse d’une infection présumée.
L’éducation des parents et des patients
Même si la vaccination et la prophylaxie antibiotique sont efficaces, ces mesures n’offrent pas une protection complète. Les enfants présentant une asplénie et leur famille doivent être informés du risque de sepsis et être appelés à consulter rapidement en cas de maladie ou de fièvre. Ce risque accru d’infection se poursuit à l’âge adulte. Il peut être difficile de diagnostiquer un sepsis après une splénectomie, et cette maladie peut provoquer un décès en quelques heures. Il convient donc de souligner régulièrement l’importance de la prophylaxie antibiotique.
Les patients vulnérables doivent porter un bracelet MedicAlert. En voyage, ils doivent avoir avec eux un avis de leur médecin précisant leur diagnostic, les risques connexes et la prise en charge suggérée en cas de maladie. Ils doivent savoir qu’ils risquent davantage une infection s’ils se font mordre par un animal, particulièrement par le Capnocytophaga canimorsus contenu dans les morsures de chiens, et se faire alors administrer les antibiotiques qui s’imposent, tels que l’amoxicilline-acide clavulanique.
La vaccination
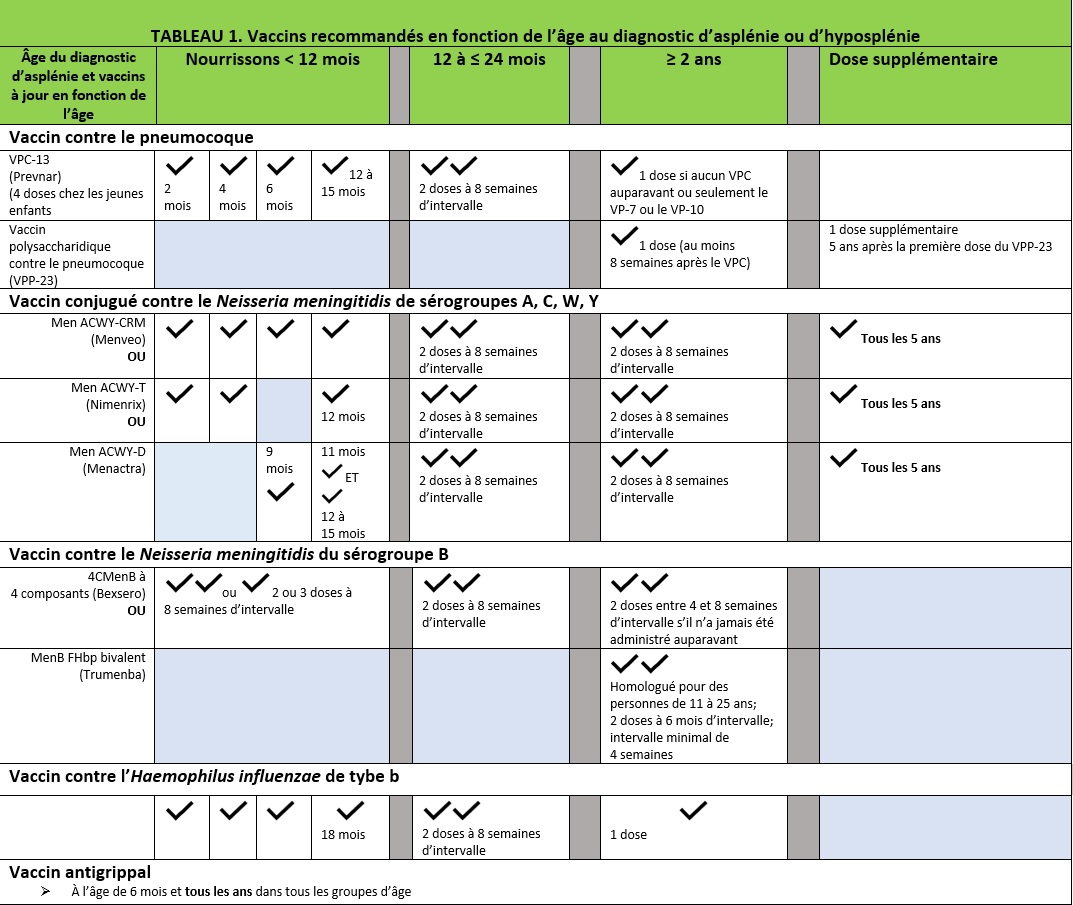
Tous les patients doivent recevoir tous les vaccins destinés aux enfants et aux adolescents aux âges recommandés. Cependant, en raison du risque de sepsis fulminant causé par les bactéries encapsulées, ils doivent absolument recevoir d’autres vaccins contre le S pneumoniae, le Hib et le N meningitidis, qui peuvent être administrés selon un calendrier devancé (voir le tableau 1).
Le pneumocoque
Tous les patients présentant une asplénie ou une hyposplénie doivent recevoir à la fois le vaccin antipneumococcique 13-valent et le vaccin polysaccharidique 23-valent. [10][11]
- Le calendrier de vaccination par le vaccin antipneumococcique conjugué (VPC-13 (Prevnar-13)) doit consister en une primovaccination de quatre doses administrées à deux, quatre, six et entre 12 et 15 mois. Les enfants de 12 à 24 mois qui n’ont jamais reçu le VPC-13 doivent en recevoir deux doses à au moins huit semaines d’intervalle. Les patients de plus de 24 mois n’ont besoin que d’une dose du VPC-13. Même s’ils ont déjà reçu les doses requises du VPC-7 ou du VPC-10, les enfants doivent se faire administrer une dose du VPC-13 dans les plus brefs délais.
- Le vaccin polysaccharidique (VPP-23 (Pneumovax)) doit être administré environ huit semaines après l’injection du nombre de doses appropriées du VPC-13 afin d’assurer une protection supplémentaire. Cet intervalle permet de « préparer » le patient à l’aide du vaccin protéique conjugué, suivi du vaccin polysaccharidique dont le spectre est plus large, mais qui est moins immunogène. Une dose de rappel du VPP-23 doit être administrée cinq ans après la première dose.
- Si un patient présentant une asplénie n’a reçu que le VPP-23, il doit recevoir une dose du VPC-13 un an après avoir reçu le VPP-23.
Le méningocoque
Tous les patients présentant une asplénie doivent se faire administrer le vaccin antiméningococcique conjugué quadrivalent (VMC4) contre les sérogroupes A, C, W et Y, de même qu’un vaccin contre le méningocoque du sérogroupe B, conformément au calendrier en fonction de l’âge au diagnostic d’asplénie ou d’hyposplénie.[12]
Les vaccins homologués au Canada contre les sérogroupes A, C, W et Y sont de marque Menveo (GlaxoSmithKline, Canada), et ce vaccin peut être administré sous licence à compter l’âge de deux mois, de marque Menactra (Sanofi Pasteur, Canada), administré sous licence à compter de l’âge de neuf mois, et de marque Nimenrix (Pfizer, Canada), administré sous licence à compter de l’âge de six semaines.
- Les nourrissons doivent recevoir le VMC4 dans le cadre d’une primovaccination de quatre doses à deux, quatre, six et entre 12 et 15 mois ou, si le vaccin Nimenrix est utilisé, de trois doses à l’âge de deux, quatre et 12 mois. Les enfants chez qui on diagnostique une asplénie ou une hyposplénie entre l’âge de 12 et 23 mois doivent recevoir deux doses du VMC à huit semaines d’intervalle. Les patients diagnostiqués après l’âge de deux ans doivent recevoir deux doses du VMC4 à huit semaines d’intervalle.
- Les patients vaccinés doivent recevoir le VMC4 tous les cinq ans, jusqu’à ce que la durée de son immunité soit mieux établie.Les vaccins homologués au Canada pour assurer une protection contre le sérogroupe B incluent un vaccin à quatre composants, de marque Bexsero (GlaxoSmithKline, Canada), qui peut être administré sous licence à compter de l’âge de deux mois, et un vaccin bivalent recombinant à lipoprotéine (rLP2086), de marque Trumenba (Pfizer, Canada). administré sous licence à compter de l’âge de dix à 25 ans.
- Les nourrissons et les enfants doivent recevoir le vaccin 4CMenB (Bexsero). Les nourrissons de deux à 11 mois doivent s’en faire administrer deux ou trois doses à huit semaines d’intervalle. Les enfants de 12 mois à dix ans doivent en recevoir deux doses à au moins huit semaines d’intervalle.
- Les enfants de 11 à 18 ans peuvent recevoir le vaccin 4CMenB (Bexsero) ou le vaccin bivalent recombinant (Trumenba) dans une série de deux doses à six semaines d’intervalle (et à un intervalle minimal de quatre semaines).
L’Haemophilus influenzae de type b (Hib)
- Le calendrier de vaccination recommandé contre le Hib est une primovaccination de trois doses administrées à deux, quatre et six mois, suivies d’une dose de rappel à l’âge de 18 mois.
- Tous les patients de cinq ans ou plus qui n’ont jamais été vaccinés contre le Hib ou qui en ont manqué au moins une dose doivent recevoir une dose du vaccin. Certains experts recommandent que tous les patients de plus de cinq ans présentant une asplénie reçoivent une dose supplémentaire du vaccin contre le Hib même s’ils avaient déjà reçu toutes les doses prévues.
- Les enfants présentant une asplénie qui sont atteints d’une infection à Hib mettant leur vie en danger doivent se faire vacciner contre le Hib, parce que l’infection ne confère pas de protection à vie.
La grippe
- Le vaccin annuel contre la grippe saisonnière est recommandé dès l’âge de six mois afin de réduire le risque d’infections bactériennes secondaires.
Les autres infections
- Tous les patients présentant une asplénie qui se rendent dans des pays en développement où les normes de salubrité alimentaire et d’approvisionnement en eau sont moins rigoureuses qu’au Canada sont vulnérables à une infection à salmonelle et doivent se faire vacciner contre le S typhi.[13]
Les contacts familiaux
- Les contacts familiaux de patients qui n’ont pas de rate doivent recevoir tous les vaccins en fonction de leur âge, de même que le vaccin annuel contre la grippe.
Le moment de la vaccination en cas de splénectomie non urgente
Lorsqu’un patient subit une splénectomie non urgente ou semi-urgente, certaines données indiquent une meilleure réponse aux vaccins s’il les reçoit au moins deux semaines avant l’opération. S’il n’est pas possible de respecter ce calendrier, il est optimal d’amorcer la vaccination au moins deux semaines après la splénectomie.[14] Cependant, lorsque les vaccins ne sont pas administrés avant la splénectomie, il faut soupeser soigneusement les avantages d’attendre deux semaines après l’opération par rapport à la possibilité que le patient ne se fasse pas vacciner. Pour cette raison, il est parfois préférable de vacciner l’enfant avant son congé de l’hôpital.
La prophylaxie antibiotique pour les enfants présentant une asplénie ou une hyposplénie
Les vaccins n’assurent pas une protection complète contre les infections par des bactéries encapsulées. C’est pourquoi la prophylaxie antibiotique est un deuxième aspect essentiel des soins. Au tableau 2, de l’information est présentée sur les doses de prophylaxie antibiotique à privilégier. Puisque le S pneumoniae est la principale cause d’infections graves chez les enfants présentant une asplénie ou une hyposplénie et qu’il s’associe à une mortalité importante, les patients de moins de cinq ans doivent tous prendre une prophylaxie antibiotique.[4][15]
Des controverses subsistent à l’égard de la durée de la prophylaxie antibiotique, y compris les maladies sous-jacentes et l’effet de la prophylaxie sur les pneumocoques pénicillinorésistants. La seule étude prospective contrôlée a révélé une réduction de 84 % des infections dans une population de patients atteints d’anémie falciforme. Ces observations ne s’appliquent pas nécessairement à tous les patients dont la fonction splénique est défaillante.
L’âge auquel mettre un terme à la prophylaxie antibiotique est le sujet le plus controversé de tous. Dans le Red Book 2018 de l’American Academy of Pediatrics, la prophylaxie est recommandée jusqu’à cinq ans, de même que pendant au moins un an chez les enfants de plus de cinq ans après la splénectomie, s’ils ont reçu tous les vaccins prévus contre le pneumocoque.[4] Le British Committee for Standards in Haematology de 2011 et les lignes directrices australiennes de 2017 recommandent de poursuivre la prophylaxie antibiotique, particulièrement chez les enfants de moins de 16 ans, en cas d’antécédents de pneumococcie invasive ou de splénectomie à cause d’un cancer hématologique. Ils recommandent également une prophylaxie antibiotique dans tous les groupes d’âge dans les deux ans suivant la splénectomie ou en cas de dysfonction immunitaire sous-jacente.[15][16]
Puisque la plupart des sepsis se déclenchent dans les deux ou trois ans suivant la splénectomie, le comité des maladies infectieuses et d’immunisation de la Société canadienne de pédiatrie recommande une prophylaxie antibiotique pendant au moins deux ans après une splénectomie et chez tous les enfants de moins de cinq ans. De plus, puisqu’on a vu des adultes souffrir de septicémie fulminante jusqu’à 65 ans après une splénectomie et que l’infection invasive à des pneumocoques résistants à la pénicilline n’est pas problématique chez les patients sous prophylaxie à long terme à la pénicilline, il est idéal de recommander la prophylaxie à vie dans tous les cas. Cependant, il faut tenir compte de l’adhésion du patient ou de sa famille et du degré d’accès aux soins médicaux, des taux de résistance actuels au pneumocoque et des épisodes antérieurs de sepsis au potentiel mortel au moment de prendre ou d’évaluer cette décision.
Les enfants qui ont eu ou qui sont présumés avoir eu une réaction de type anaphylactique à la pénicilline doivent être orientés immédiatement vers un allergologue pour vérifier le diagnostic ou pour effectuer des tests de provocation ou de désensibilisation, selon le cas.[17] La clarithromycine est un traitement de rechange recommandé, mais elle prévient moins bien la maladie invasive en raison d’un taux plus élevé de résistance du pneumocoque.
Les publications n’établissent pas clairement la durée optimale de la prophylaxie antibiotique chez les enfants qui subissent une splénectomie partielle ou présentent une asplénie fonctionnelle ou une polysplénie. Tant qu’il n’y aura pas de recommandations contraires, il semble plus sage de respecter les lignes directrices décrites pour les enfants qui subissent une splénectomie totale.
La prophylaxie contre le paludisme
Les enfants présentant une asplénie ou une hyposplénie doivent être informés qu’ils sont plus vulnérables à un paludisme grave et qu’ils doivent toujours obtenir des conseils en matière de voyage. Ils doivent également prendre une prophylaxie antipaludique adaptée à leur âge et au type de paludisme observé dans la région où ils se rendent. Ils doivent prendre des mesures préventives, y compris dormir sous une moustiquaire imprégnée d’insecticide ou dans des établissements climatisés, et utiliser un insectifuge. Dans le mois suivant leur retour d’une région impaludée, et jusqu’à un an par la suite, les patients fiévreux doivent en informer leur dispensateur de soins, afin que le paludisme soit inclus dans le diagnostic différentiel.[8][18]
Le traitement initial du sepsis présumé : une urgence médicale
Lorsqu’ils font une fièvre subite, qu’on s’inquiète d’une maladie fébrile non spécifique ou qu’ils sont mordus par un animal, les enfants présentant une asplénie doivent être vus immédiatement par un médecin. Chez les personnes présentant une asplénie ou une hyposplénie, le sepsis est une urgence médicale, car le décès peut survenir dans les quelques heures suivant l’apparition de la fièvre, même si les patients semblaient bien au départ. À moins qu’une source non bactérienne soit évidente, une hémoculture s’impose, sans toutefois retarder l’antibiothérapie. Tous les patients doivent recevoir de la ceftriaxone (100 mg/kg/dose, maximum de 2 g/dose). Si des pneumocoques de résistance intermédiaire ou élevée à la pénicilline sont prévalents, on administre à la fois de la ceftriaxone et de la vancomycine (60 mg/kg/jour en doses fractionnées toutes les six heures). Si le patient est traité en clinique ou en cabinet, on l’oriente immédiatement vers l’urgence la plus proche. La détérioration clinique peut être rapide même après l’administration d’antibiotiques. Il faut modifier les antibiotiques après l’obtention des résultats des hémocultures.
Si le patient a une allergie grave à la pénicilline ou aux céphalosporines, on peut utiliser de la vancomycine et de la ciprofloxacine. Il faut modifier les antibiotiques après l’obtention des résultats des hémocultures.
Recommandations
Pour prévenir et traiter les infections chez les enfants présentant une asplénie ou une hyposplénie, la Société canadienne de pédiatrie recommande les mesures suivantes :
- Les médecins expliquent aux patients et à leur famille les risques liés à l’asplénie et à l’hyposplénie.
- Les enfants qui présentent une asplénie ou une hyposplénie doivent recevoir tous les vaccins systématiques destinés aux enfants, dont certains selon un calendrier accéléré et un plus grand nombre de doses. Tous ces enfants, quel que soit leur âge, doivent recevoir les vaccins nécessaires pour être protégés contre le S pneumoniae, le N meningitidis, le Hib et la grippe saisonnière.
- Les patients doivent prendre une prophylaxie antibiotique jusqu’à l’âge d’au moins 60 mois, et plus longtemps s’ils présentent une pneumococcémie invasive. Il faut envisager une prophylaxie à vie.
- Les patients qui présentent une asplénie ou une hyposplénie doivent être considérés comme à haut risque d’infection bactérienne grave (en cas d’urgence médicale). Ils doivent porter un bracelet MedicAlert, être examinés rapidement en cas de fièvre et recevoir immédiatement une thérapie antimicrobienne, à moins qu’une source non bactérienne soit évidente.
Remerciements
Le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie a révisé la première version du présent document de principes.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SCP
Membres : Robert Bortolussi MD (président sortant); Natalie A Bridger MD; Jane C Finlay MD (membre sortante); Susanna Martin MD (représentante du conseil); Jane C McDonald MD; Heather Onyett MD; Joan L Robinson MD (présidente); Marina I Salvadori MD (membre sortante); Otto G Vanderkooi MD
Représentants : Upton D Allen MBBS, Groupe de recherche canadien sur le sida chez les enfants; Michael Brady MD, comité des maladies infectieuses, American Academy of Pediatrics; Charles PS Hui MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Nicole Le Saux MD, Programme canadien de surveillance active de la vaccination (IMPACT); Dorothy L Moore MD, Comité consultatif national de l’immunisation; Nancy Scott-Thomas MD, Le Collège des médecins de famille du Canada; John S Spika MD, Agence de la santé publique du Canada
Conseillère : Noni E MacDonald MD
Auteures principales : Marina I Salvadori MD, Victoria E Price MBChB MMED
Révisé par Nicole Le Saux MD, Marc Lebel MD, Dorothy Moore MD, Karina Top MD, Michelle Barton-Forbes MD, Ari Bitnun MD, Laura Sauve MD, Ruth Grimes MD
Références
- Holdwoth RJ, Irving AD, Cuschieri A. Postsplenectomy sepsis and its mortality rate: Actual versus perceived risks. Br J Surg 1991;78(9):1031-8.
- Price VE, Blanchette VS, Ford-Jones EL. The prevention and management of infections in children with asplenia or hyposplenia. Infect Dis Clin North Am 2007;21(3):697-710, viii-ix.
- Bisharat N, Omari H, Lavi I, Raz R. Risk of infection and death among post-splenectomy patients. J Infect 2001;43(3):182-6.
- American Academy of Pediatrics. Immunization in special circumstances In Kimberlin DW, Brady MT, Jackson MA, Long SS, éd. Redbook: 2018 Report of the Committee on Infectious Diseases, 31e éd. Itasca, IL: American Academy of Pediatrics:88-90.
- Quinti I, Paganelli R. Asplenia. In Sullivan KE, Stiehm ER, éd. Stiehm’s Immune Deficiencies. London, U.K.: Elsevier, 2015.
- Lion C, Escande F, Burdin JC. Capnocytophaga canimorsus infections in humans: Review of the literature and cases report. Eur J Epidemiol 1996;12(5):521-33.
- Tartof SY, Gounder P, Weiss D et coll. Bordetella holmesii bacteremia cases in the United States, April 2010-January 2011. Clin Infect Dis 2014;58(2):e39-43
- Bach O, Baier M, Pullwitt A et coll. Falciparum malaria after splenectomy: A prospective controlled study of 33 previously splenectomized Malawian adults. Trans R Soc Trop Med Hyg 2005;99(11):861-7.
- Krause PJ, Gewurz BE, Hill D et coll. Persistent and relapsing babesiosis in immunocompromised patients. Clin Infect Dis 2008;46(3):370-6.
- Agence de la santé publique du Canada. Guide canadien d’immunisation Partie 4 : Agents d’immunisation active, Vaccin contre le pneumocoque. www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-16-vaccin-contre-pneumocoque.html (consulté le 9 octobre 2019).
- Halasa NB, Shankar SM, Talbot TR et coll. Incidence of invasive pneumococcal disease among individuals with sickle cell disease before and after the introduction of the pneumococcal conjugate vaccine. Clin Infect Dis 2007;44(11):1428-33.
- Agence de la santé publique du Canada. Guide canadien d’immunisation Partie 4 : Agents d’immunisation active, Vaccin contre le méningocoque. www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-13-vaccin-contre-meningocoque.html (consulté le 9 octobre 2019).
- Agence de la santé publique du Canada. Guide canadien d’immunisation Partie 4 : Agents d’immunisation active, Vaccin contre la typhoïde. www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-23-vaccin-contre-typhoide.html (consulté le 9 octobre 2019).
- Shatz DV, Schinsky MF, Pais LB, Romero-Steiner S, Kirton OC, Carlone GM. Immune responses of splenectomized trauma patients to the 23-valent pneumococcal polysaccharide vaccine at 1 versus 7 versus 14 days after splenectomy. J Trauma 1998;44(5):765-6.
- Kanhutu K, Jones P, Cheng AC, Grannell L, Best E, Spelman D. Spleen Australia guidelines for the prevention of sepsis in patients with asplenia and hyposplenism in Australia and New Zealand. Intern Med J 2017;47(8):848-55.
- Davies JM, Lewis MP, Wimperis J, Rafi I, Ladhani S, Bolton-Maggs PH; British Committee for Standards in Haematology. Review of guidelines for the prevention and treatment of infection in patients with an abscent or dysfunctional spleen: Prepared on behalf of the British Committee for Standards in Haematology by a working party of the Haemato-Oncology task force. Br J Haematol 2011;155(3):308–17.
- Wong T, Atkinson A, t’Jong G, Rieder M, Chan E, Abrams E; Société canadienne de pédiatrie, section des allergies. L’allergie aux bêta-lactamines dans la population pédiatrique. Sous presse.
- Di Sabatino A, Carsetti R, Corazza GR. Post-splenectomy and hyposplenic states. Lancet 2011;378(9785):86-97.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


