Document de principes
Les stratégies de prévention du virus respiratoire syncytial pour la saison de maladies respiratoires virales 2024-2025
Affichage : le 7 novembre 2024
Auteur(s) principal(aux)
Jeannette L. Comeau MD M. Sc., Dorothy L. Moore MD, Michelle A. Barton MD; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Résumé
La prévention de l’infection par le virus respiratoire syncytial chez les jeunes enfants, notamment ceux les plus à risque d’une grave maladie, est un objectif important pour la santé publique. Auparavant, le palivuzimab était le seul agent de prévention offert au Canada, mais deux nouveaux agents ont été approuvés récemment. Le présent document donne un aperçu des plus récentes recommandations du Comité consultatif national de l’immunisation à l’égard de l’utilisation de ces agents, soit le nirsévimab, un anticorps monoclonal à longue durée d’action destiné aux nourrissons et aux jeunes enfants, et le vaccin VRSpreF, qui est administré pendant la grossesse.
Mots-clés : anticorps monoclonal du VRS; Comité consultatif national de l’immunisation (CCNI); nourrissons; vaccin contre le VRS; virus respiratoire syncytial (VRS)
Le virus respiratoire syncytial (VRS) est la principale cause de bronchiolite[1] et l’un des virus respiratoires les plus fréquents chez les nourrissons et les jeunes enfants. À l’âge de deux ans, la plupart des enfants ont été infectés[2]. Le VRS peut être responsable de graves infections pulmonaires, particulièrement chez les jeunes nourrissons, ce qui peut entraîner une hospitalisation, un séjour en soins intensifs et un décès.
Il n’y a pas de traitement visant expressément le VRS, mais certaines mesures pharmacologiques permettent de le prévenir. Le palivizumab (SYNAGISMD) est un anticorps monoclonal approuvé par Santé Canada depuis 2002 et recommandé par le Comité consultatif national de l’immunisation (CCNI) depuis 2003 pour prévenir les infections par le VRS dans un groupe particulier de nourrissons à haut risque[3][4]. Il doit leur être administré toutes les quatre à six semaines pendant la saison du VRS (généralement quatre doses entre novembre et mars).
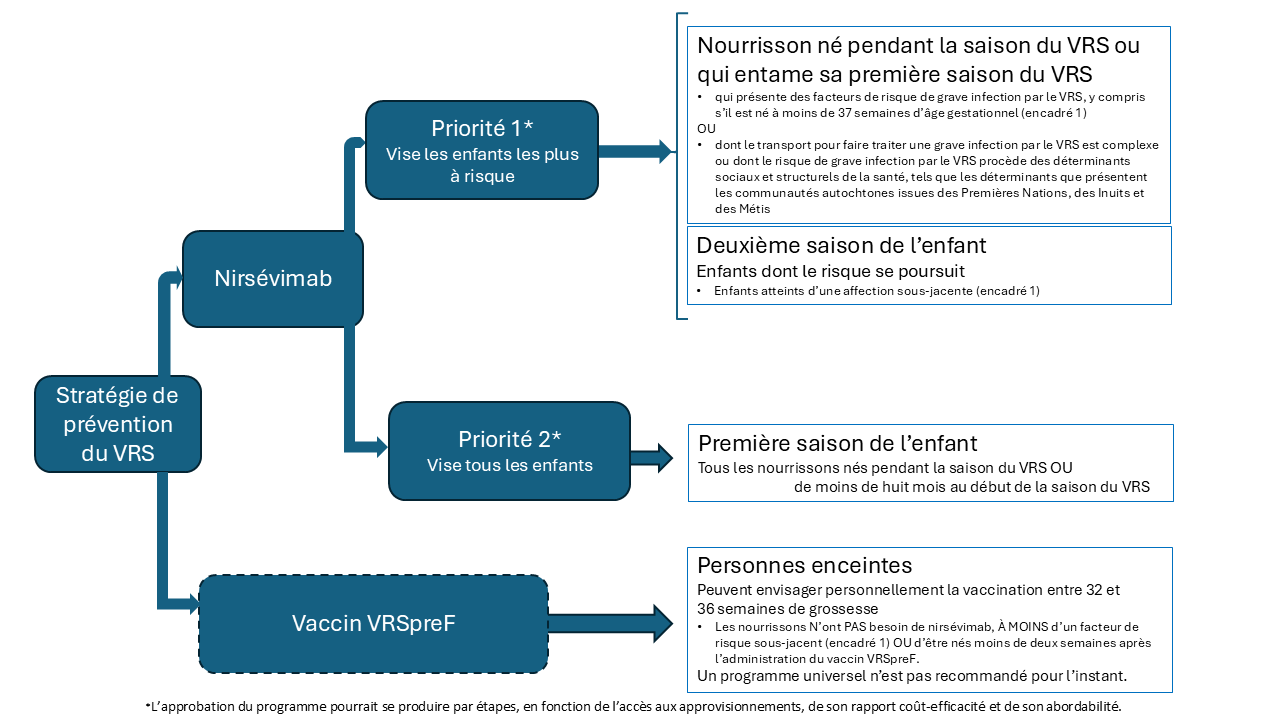
Étant donné le fardeau important de l’infection par le VRS, notamment le risque de résultats cliniques indésirables chez les jeunes nourrissons et les répercussions qui en découlent dans le système de santé canadien, le CCNI recommande de s’orienter vers un programme de prévention universel du VRS pour tous les nourrissons (figure 1).
Deux stratégies ont récemment été approuvées et recommandées pour prévenir une grave infection à VRS chez les nourrissons[5] :
- Le nirsévimab (BEYFORTUSMD; Sanofi Pasteur Ltée) : Cet anticorps monoclonal est administré une fois pendant la saison du VRS et offre une protection passive directe conférée par les anticorps pendant toute cette période.
- Le vaccin VRSpreF (ABRYSVOMD; Pfizer Canada) : Ce vaccin est administré au cours du troisième trimestre de la grossesse (entre 32 et 36 semaines de grossesse) afin de fournir aux nourrissons une protection passive par transfert transplacentaire des anticorps au fœtus.
Les pédiatres et les autres professionnels de la santé qui s’occupent de nourrissons et de jeunes enfants ont des rôles importants à jouer à la fois pour prendre position en faveur de la vaccination et pour la promouvoir, conjointement avec d’autres stratégies de prévention contre de graves infections. Les programmes provinciaux et territoriaux de prévention du VRS au moyen de ces nouveaux agents sont en voie d’être mis en œuvre au Canada, mais les professionnels de la santé devraient préconiser de prioriser les nourrissons les plus vulnérables.
À l’heure actuelle, le CCNI recommande le nirsévimab de préférence au vaccin VRSpreF, en fonction de son efficacité déclarée (y compris la durée de la protection) et des données d’innocuité. Cette préférence pourrait être réévaluée lorsque de nouvelles données deviendront disponibles. Au moment où le CCNI a publié ses recommandations en mai 2024[5], l’efficacité du nirsévimab pour prévenir une infection par le VRS exigeant une hospitalisation se situait entre 76,8 % et 81 % au bout de 150 jours[6][7], et celle du vaccin VRSpreF, à 57 % au bout de 180 jours[8].
QUI DEVRAIT RECEVOIR DES ANTICORPS MONOCLONAUX (PALIVIZUMAB/NIRSÉVIMAB)?
Le palivizumab est recommandé depuis 2003 pour les nourrissons à haut risque, et son utilisation se limite généralement aux nourrissons prématurés (de moins de 33 semaines d’âge gestationnel) et aux enfants âgés de moins de 24 mois atteints d’une cardiopathie congénitale ou d’une maladie pulmonaire chronique. En raison du calendrier d’administration du palivizumab, la plupart des nourrissons et des jeunes enfants doivent en recevoir quatre doses au cours de la saison du VRS[3]. Les programmes actuels relatifs au palivizumab demeurent recommandés dans les régions sociosanitaires où le nirsévimab n’a pas encore été approuvé.
Le nirsévimab est un anticorps monoclonal à longue durée d’action qui offre une protection soutenue pendant une seule saison du VRS, et ce, après l’administration d’une dose unique. En mai 2024, le CCNI a publié une déclaration dans laquelle il recommandait de prioriser le nirsévimab, comme suit :
Priorité 1
Les nourrissons à risque d’une grave infection par le VRS ou, s’ils en sont atteints, qui risquent de se heurter à d’importantes limites d’accès aux soins critiques nécessaires, y compris :
- les nourrissons nés pendant la saison du VRS ou qui entament leur première saison du VRS et :
- qui présentent des facteurs de risque de grave infection par le VRS (voir l’encadré 1);
- qui sont nés avant 37 semaines d’âge gestationnel;
- dont le transport pour faire traiter une grave infection par le VRS est complexe ou dont le risque de grave infection par le VRS procède des déterminants sociaux et structurels de la santé, tels que les déterminants que présentent les communautés autochtones issues des Premières Nations, des Inuits et des Métis;
- les nourrissons qui entament leur deuxième saison du VRS et dont l’état de santé les maintient à risque continu de grave infection par le VRS (voir l’encadré 1).
Priorité 2
- Si le prix du nirsévimab confère un bon rapport coût-efficacité à cette stratégie de prévention, le CCNI recommande d’administrer ce produit à tout nourrisson de moins de huit mois qui entame la première saison du VRS (ou naît pendant cette période), dans le cadre des programmes de vaccination universels.
|
Encadré 1. Définition des nourrissons à risque accru de grave infection par le VRS |
|
Nourrissons à risque accru de grave infection par le VRS pendant leur première saison du VRS |
|
• Naissance à moins de 37 semaines d’âge gestationnel* • Maladie pulmonaire chronique, y compris la dysplasie bronchopulmonaire exigeant une ventilation assistée, une oxygénothérapie ou un traitement médical chronique dans les six mois précédant le début de la saison du VRS • Fibrose kystique avec atteinte respiratoire, retard de croissance ou ces deux caractéristiques • Maladie cardiaque chronique importante sur le plan hémodynamique • Grave immunodéficience • Graves anomalies congénitales des voies respiratoires qui nuisent à l’évacuation des sécrétions respiratoires • Maladie neuromusculaire qui nuit à l’évacuation des sécrétions respiratoires • Trisomie 21 |
|
Nourrissons continuant de courir un risque de grave infection par le VRS pendant leur deuxième saison du VRS |
|
• Tous les enfants énumérés ci-dessus, sauf les nourrissons nés à moins de 37 semaines d’âge gestationnel* et ceux ayant la trisomie 21 qui ne sont pas atteints de l’une des autres affections énumérées ci-dessus. |
*Même si les nourrissons prématurés de moins de 37 semaines d’âge gestationnel sont admissibles à recevoir du nirsévimab, ce n’est pas le cas pour le palivizumab, puisque les nourrissons prématurés de plus de 33 semaines d’âge gestationnel n’y sont pas admissibles[5].
La priorisation préconisée par le CCNI est dérivée d’une analyse économique reposant sur des modèles, qui évalue l’administration du nirsévimab à tous les nourrissons et qui n’atteignait pas le seuil de rapport coût-efficacité alors accepté. Cependant, seul le recours à la priorité 1 respecte ce seuil dans la recommandation actuelle du CCNI. Si le coût du nirsévimab diminuait, il se pourrait qu’un programme universel destiné aux nourrissons présente un rapport coût-efficacité acceptable.
Selon les données probantes tirées de la première année d’utilisation du nirsévimab aux États-Unis[9], ce médicament prévenait les hospitalisations attribuables au VRS chez les nourrissons avec une efficacité de 90 % au cours de leur première saison du VRS. Dans la communauté de Galicie, en Espagne, l’efficacité du nirsévimab a été établie à 82 %[10].
Les études qui comparent le nirsévimab au palivizumab ou à un placebo n’ont révélé aucune différence importante pour ce qui est des effets indésirables graves[5].
QUI DEVRAIT RECEVOIR LE VACCIN VRSpreF?
Le vaccin VRSpreF, approuvé pour être administré pendant la grossesse, peut offrir une protection aux nourrissons pendant leurs quelques premiers mois de vie grâce au transfert transplacentaire des anticorps. Il a une courte fenêtre d’administration, entre 32 à 36 semaines de grossesse, et son efficacité est plus élevée s’il est administré au moins deux semaines avant l’accouchement[5].
Pour l’instant, le CCNI ne recommande pas de programme de vaccination universelle par le vaccin VRSpreF pendant la grossesse, mais chaque personne enceinte peut envisager de le recevoir afin d’éviter que leur nourrisson contracte une grave infection par le VRS au cours de ses quelques premiers mois de vie. Lorsque plus de données et d’information deviendront disponibles, les recommandations du CCNI au sujet de la vaccination de la mère contre le VRS pourraient changer. L’information fondée sur des données probantes pour éclairer les décisions entourant le vaccin VRSpreF devrait être transmise par des dispensateurs de soins prénatals.
Lorsque le vaccin VRSpreF est administré pendant la grossesse, les nourrissons n’ont pas besoin de recevoir de nirsévimab, à moins qu’ils :
- respectent les critères médicaux de risque accru de grave infection par le VRS (encadré 1) OU
- soient nés moins de deux semaines après l’administration du vaccin VRSpreF.
Chez les personnes enceintes, la douleur au point d’injection, les céphalées et les myalgies sont les principaux effets indésirables du vaccin VRSpreF [5]. Pour ce qui est de ses effets potentiels sur le fœtus, lorsque le vaccin VRSpreF a été administré pendant la grossesse dans le cadre d’études cliniques, il n’a pas entraîné d’augmentation des graves effets indésirables systémiques chez les nourrissons par rapport à un placebo. Cependant, un déséquilibre de naissances prématurées a été observé entre les personnes qui ont reçu le vaccin VRSpreF et celles à qui un vaccin placebo a été administré[5].
Figure 1. Sommaire des stratégies de prévention du VRS (adaptées de la déclaration du CCNI)
CONCLUSION
Le VRS peut être responsable d’une grave maladie respiratoire entraînant une hospitalisation chez les jeunes nourrissons et représente un fardeau important pour le système de santé. Les nouveaux vaccins contre le VRS et les anticorps monoclonaux à longue durée d’action constituent des stratégies de prévention prometteuses qui peuvent réduire considérablement le fardeau des infections par le VRS. Cependant, ces mesures ne sont pas offertes partout au Canada, puisque l’achat des produits et la décision de les administrer incombent aux provinces et aux territoires.
Les pédiatres et autres professionnels de la santé ont un rôle crucial à jouer par des prises de position pour un accès équitable aux anticorps monoclonaux et aux vaccins contre le VRS. Ils devraient se tenir informés des agents disponibles dans leur région sociosanitaire, prodiguer des conseils au sujet des décisions individuelles qui maximisent la protection contre le VRS et soutenir ces décisions. Il est essentiel de prioriser les enfants les plus à risque de grave infection par le VRS, y compris ceux qui habitent dans les régions du Grand Nord, les régions éloignées et les régions rurales du Canada, où les avantages potentiels et le rapport coût-efficacité de ces mesures sur la santé sont probablement les plus élevés. Tant qu’ils n’auront pas intégré le nirsévimab à leur programme de prévention, les provinces et les territoires devraient continuer d’offrir le palivizumab aux nourrissons à haut risque de grave infection par le VRS.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2024-2025)
Membres : Michelle Barton MD (présidente), Laura Sauvé MD (présidente sortante), Eugene Ng MD (représentant du conseil), Sean Bitnun MD, Sergio Fanella MD, Justin Penner MD, Jeannette Comeau MD M. Sc.
Auteures principales : Jeannette L. Comeau MD M. Sc., Dorothy L. Moore MD, Michelle A. Barton MD
Représentants : Dorothy L. Moore MD (Comité consultatif national de l’immunisation), Sean Bitnun MD (Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida), Isabelle Viel-Thériault MD (Comité consultatif de la médecine tropicale et de la médecine des voyages), Marina Salvadori MD (Agence de la santé publique du Canada), Sean O’Leary (American Academy of Pediatrics, comité des maladies infectieuses), Rupeena Purewal MD (Programme canadien de surveillance active de l’immunisation), Cora Constantinescu MD (Association pour la microbiologie médicale et l’infectiologie Canada, comité de pédiatrie)
Financement
Aucun financement n’a été accordé pour la préparation du présent manuscrit.
Conflits d’intérêts potentiels
La docteure Jeannette Comeau a déclaré être cochercheuse d’études cliniques sur des vaccins (sans rétribution financière directe) pour GlaxoSmithKline Inc., ModernaTX Inc., Merck & Co. Inc., Sanofi Pasteur Inc., VBI Vaccines Inc., Pfizer, Medical R&D Inc., MedImmune LLC et Janssen Research & Developement LLC. Aucun autre conflit d’intérêts n’a été déclaré.
Références
- Friedman JN, Rieder MJ, Walton JM; Société canadienne de pédiatrie, comité de la pharmacologie, comité des soins aigus. La bronchiolite : recommandations pour le diagnostic, la surveillance et la prise en charge des enfants de un à 24 mois. Mise à jour le 30 novembre 2021. https://cps.ca/fr/documents/position/bronchiolitis1
- Zylbersztejn A, Pembrey L, Goldstein H et coll. Respiratory syncytial virus in young children: Community cohort study integrating serological surveys, questionnaire and electronic health records, Born in Bradford cohort, England, 2008 to 2013. Euro Surveill 2021;26(6):2000023. doi : 10.2807/1560-7917.ES.2021.26.6.2000023
- Agence de la santé publique du Canada. Déclaration d’un comité consultatif (DCC) – Comité consultatif national de l’immunisation (CCNI) : Utilisation recommandée du palivizumab pour réduire les complications de l’infection par le virus respiratoire syncytial chez les nourrissons. Juin 2022. https://publications.gc.ca/collections/collection_2022/aspc-phac/HP40-308-2022-fra.pdf (consulté le 27 octobre 2024).
- Robinson JL, Le Saux N; Société canadienne de pédiatrie, comité des maladies infectieuses et d’immunisation. Prévenir les hospitalisations pour l’infection par le virus respiratoire syncytial. Paediatr Child Health 2015;20(6):327-33. doi : 10.1093/pch/20.6.321
- Agence de la santé publique du Canada. Déclaration d’un comité consultatif (DCC) – Comité consultatif national de l’immunisation (CCNI) : Déclaration sur la prévention de la maladie causée par le virus respiratoire syncytial chez les nourrissons. Le 17 mai 2024. https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/vaccines-immunization/national-advisory-committee-immunization-statement-prevention-respiratory-syncytial-virus-disease-infants/ccni-declaration-2024-05-17.pdf (consulté le 24 octobre 2024).
- Muller WJ, Madhi SA, Seoane Nuñez B et coll. Nirsevimab for prevention of RSV in term and late-preterm infants. N Engl J Med 2023;388(16):1533-4. doi : 10.1056/NEJMc2214773
- Griffin MP, Yuan Y, Takas T et coll. Single-dose nirsevimab for prevention of RSV in preterm infants. N Engl J Med 2020;383(5):415-25. doi : 10.1056/NEJMoa1913556. (Erratum in N Engl J Med 2020;383(7):698. doi : 10.1056/NEJMx200019)
- Kampmann B, Madhi SA, Munjal I et coll. Bivalent prefusion F vaccine in pregnancy to prevent RSV illness in infants. N Engl J Med 2023;388(16):1451-64. doi : 10.1056/NEJMoa2216480
- Moline HL, Tannis A, Toepfer AP et coll. Early estimate of nirsevimab effectiveness for prevention of respiratory syncytial virus–associated hospitalization among infants entering their first respiratory syncytial virus season — New Vaccine Surveillance Network, October 2023–February 2024. MMWR Morb Mortal Wkly Rep 2024;73(9):209–14. doi : 10.15585/mmwr.mm7309a4
- Ares-Gómez S, Mallah N, Santiago-Pérez MI et coll. Effectiveness and impact of universal prophylaxis with nirsevimab in infants against hospitalisation for respiratory syncytial virus in Galicia, Spain: Initial results of a population-based longitudinal study. Lancet Infect Dis 2024;24(8):817-28 doi : 10.1016/S1473-3099(24)00215-9
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


