Point de pratique
Les infections à Salmonella chez les enfants canadiens
Affichage : le 3 décembre 2018 | Mise à jour : le 1 décembre 2023 | Reconduit : le 21 novembre 2024
Auteur(s) principal(aux)
Joan L Robinson; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Paediatr Child Health 2019 24(1):51. (Résumé) 
Résumé
Les infections à Salmonella non typhiques (SNT) sont surtout transmises par des aliments ou de l’eau contaminés ou par contact avec des animaux porteurs (notamment des reptiles) et se manifestent par de la diarrhée. Les antibiotiques ne limitent ni la gravité ni la durée de la diarrhée et peuvent accroître l’incidence de portage de SNT. Ils ne doivent donc être utilisés qu’en cas de bactériémie ou d’infection invasive présumée ou démontrée. La fièvre typhoïde ou paratyphoïde se révèle par une bactériémie dans les 60 jours suivant un voyage vers des pays pauvres en ressources, accompagnée de fièvre et de divers troubles abdominaux. Ainsi, des hémocultures sont indiquées en cas de fièvre inexpliquée et d’histoire de voyage pertinente. Lorsque les hémocultures sont positives ou qu’on n’en a pas encore obtenu les résultats et que l’enfant est malade, la ceftriaxone est indiquée. Il est souvent possible de passer à des antibiotiques par voie orale (généralement de l’azithromycine) après que les hémocultures sont devenues négatives et que l’état de l’enfant s’est amélioré.
Mots-clés : Non-typhoidal Salmonella; Typhoid/paratyphoid fever
Il existe deux types d’infection à Salmonella : l’infection à Salmonella non typhique et celle à Salmonella typhique.
Le genre Salmonella comporte deux espèces (enterica et bongori) qui se divisent en sept sous-espèces englobant environ 2 500 sérotypes (qu’on appelle sérovars ou souches), dont seuls le S typhi et le S paratyphi provoquent la typhoïde (ou fièvre entérique). Il est à souligner que, malgré son nom, le S typhimurium est une SNT.
L’épidémiologie et la présentation clinique
Infection à SNT : De nombreuses espèces animales peuvent être porteuses asymptomatiques de SNT [1]. Chez les humains, les sources courantes d’infection sont le contact avec des animaux (notamment les reptiles) et la consommation d’aliments ou d’eau contaminés par des SNT d’origine humaine ou animale. La volaille, les œufs (qui peuvent être contaminés même s’ils sont intacts, à cause de la présence de SNT dans l’oviducte de la pondeuse), les produits laitiers, le bœuf haché et les fruits et légumes font partie des aliments souvent contaminés [1]. Même des fruits et légumes à la peau épaisse, comme le melon, peuvent être une source de contamination, probablement lorsque la surface sale est coupée. Les graines peuvent être contaminées et infecter toute une récolte [2]. Les tomates peuvent absorber des SNT si elles sont plongées dans de l’eau contaminée [3].
La période d’incubation dure généralement de 12 à 48 heures, mais elle peut atteindre sept jours [1]. D’ordinaire, les patients ont des diarrhées non sanglantes, accompagnées ou non de vomissements et de fièvre. Les autres manifestations cliniques sont énoncées au tableau 1. La maladie disséminée touche surtout les enfants immunodéprimés, aspléniques ou âgés de moins de trois mois.
Fièvre typhoïde ou paratyphoïde : Les humains sont les hôtes primaires. L’infection est généralement contractée en Asie (et, dans une moindre mesure, en Afrique) à partir d’eau ou d’aliments contaminés par les excréments d’un porteur ou à partir d’un contact direct avec une personne infectée.
La période d’incubation habituelle est de sept à 14 jours (plage de trois à 60 jours) [4]. La fièvre typhoïde ou paratyphoïde est une infection invasive se révèle par une bactériémie et qui peut se transformer en sepsis et en défaillance multi-organique. Il arrive souvent que le diagnostic ne soit pas envisagé immédiatement, parce que les enfants présentent des symptômes non spécifiques, telles que la fièvre et les manifestations abdominales. L’atteinte du système réticuloendothélial finit par causer une hépatomégalie ou une splénomégalie. On remarque une éruption maculaire (taches rosées) sur l’abdomen dans environ 30 % des cas [4]. Les autres manifestations cliniques sont exposées au tableau 1. La formation d’abcès est beaucoup moins courante qu’en cas d’infection à SNT [5].
| Tableau 1 – Les manifestations cliniques de l’infection à Salmonella | ||
| Non typhique | Typhique | |
| Infection asymptomatique | Courante | Incidence inconnue |
| Gastroentérite aiguë | La plupart des patients ont des nausées, des vomissements et de la diarrhée (non sanglante, qui persiste de trois à sept jours) accompagnés ou non de fièvre. | La plupart des patients ont des douleurs abdominales. La constipation accompagnée d’une histoire de diarrhée récente est courante. |
| Saignement gastro-intestinal | Très rare | Chez environ 10 % des adultes et des enfants hospitalisés [4]. |
| Perforation intestinale | Très rare | Rare, touche surtout l’iléon terminal [4]. |
| Porteur chronique (>12 mois) | Très rare chez les enfants. Les calculs biliaires représentent un facteur de risque. | Très rare chez les enfants. Les calculs biliaires représentent un facteur de risque. |
| Bactériémie (maladie disséminée) | Se déclare dans environ 6 % à 8 % des cas de tout âge [1][2], évolue rarement jusqu’à l’état de choc. | Décelée dans environ 80 % des cas [2], mais probablement toujours présente. L’évolution vers l’état de choc est plus courante qu’en cas d’infection à Salmonella non typhique. |
| Atteinte du système nerveux central (maladie disséminée) | Méningite ou abcès cérébral surtout avant l’âge d’un an. L’encéphalopathie est rare. | Comme l’infection à Salmonella non typhique, mais l’encéphalopathie est plus courante et l’abcès cérébral, très rare. |
| Atteinte cardiaque ou vasculaire (maladie disséminée) | Endocardite ou artérite (surtout chez les adultes). | Myocardite et endocardite (rare). |
| Ostéomyélite (maladie disséminée) | Surtout en cas d’anémie falciforme. | Rare. |
| Arthrite septique (maladie disséminée) | Surtout en cas d’anémie falciforme. | Rare. |
| Arthrite réactive | Rare chez les enfants [13]. | Non décrite. |
| Infection urinaire | Difficile à distinguer de l’urine contaminée. Description d’abcès rénaux. | Très rare, mais peut provoquer la formation de calculs urinaires [14]. |
| Infection néonatale par transmission périnatale | Rare [15]. | Rare [4]. |
| Il y a de rares déclarations d’anémie, de coagulation intravasculaire disséminée et d’atteinte des poumons, des tissus musculaires ou des tissus mous, d’atteinte hépatobiliaire, splénique ou génitale, particulièrement chez les adultes atteints d’une infection typhique [4]. | ||
Le diagnostic
Salmonella non typhique : Les coprocultures sont généralement positives et doivent être prélevées chez tous les enfants ayant une diarrhée non sanglante grave ou persistante ou une diarrhée sanglante.
Il faut demander des hémocultures lorsque les selles contiennent des SNT et que l’enfant est fiévreux ou immunodéprimé. La réponse inflammatoire à la bactériémie à Salmonella chez les nourrissons peut être minime [4]. C’est pourquoi les hémocultures sont également recommandées pour les enfants non fiévreux âgés de moins de trois mois [6] et peut-être jusqu’à l’âge de six mois lorsque leurs selles contiennent la SNT.
Fièvre typhoïde ou paratyphoïde : Il faut prélever des hémocultures chez tous les enfants qui se mettent à faire de la fièvre sans raison dans les deux mois suivant leur retour d’un pays pauvre en ressources. La bactériémie est généralement faible, si bien que le prélèvement d’un volume suffisant de sang et l’obtention de deux hémocultures accroîtront le rendement. Les coprocultures sont positives chez seulement 30 % des patients [4], car l’infection intestinale est souvent résolue au moment du prélèvement. Les patients dont les coprocultures sont positives, mais dont les hémocultures sont négatives ont probablement tous eu une bactériémie à un moment ou à un autre.
La prise en charge
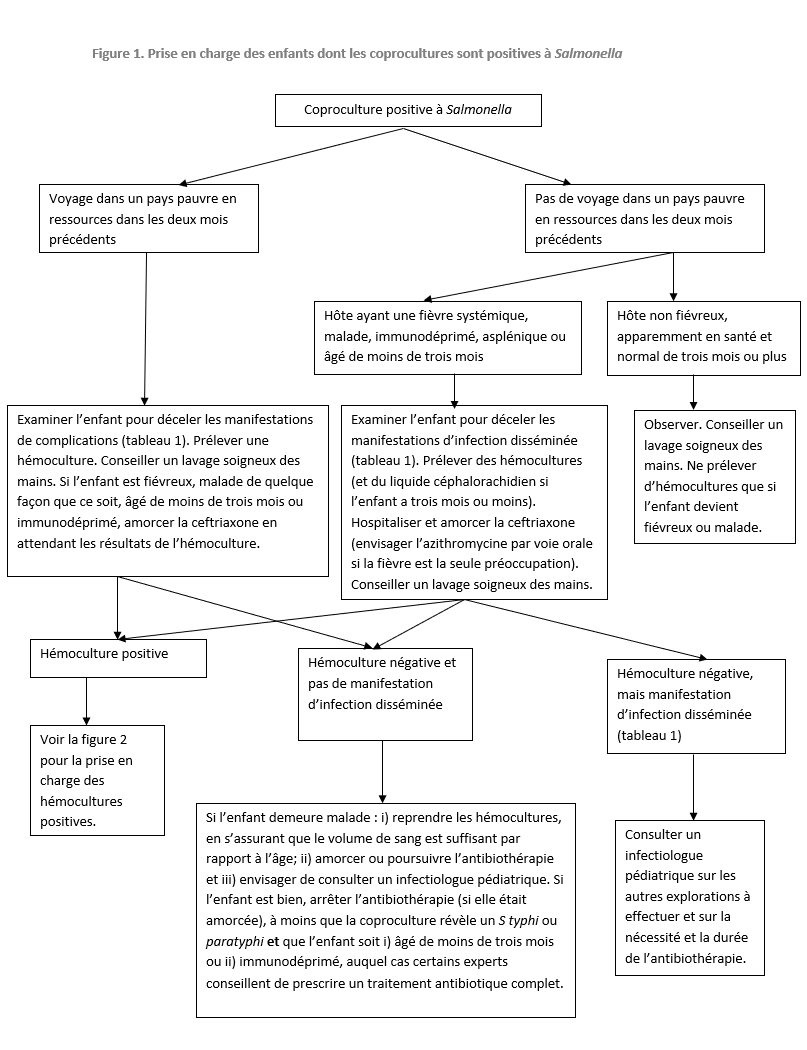
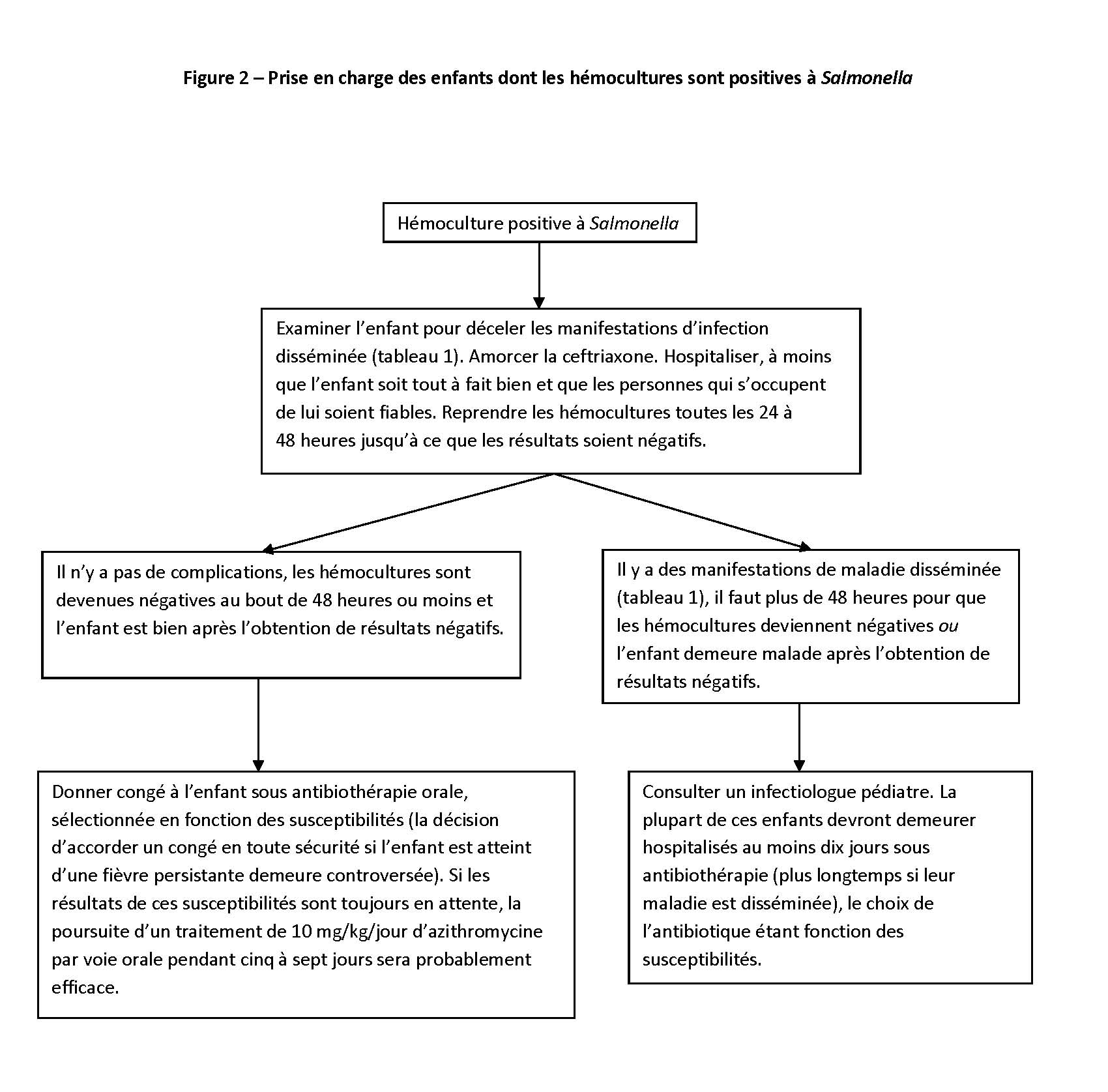
Salmonella non typhique – voir les figures 1 et 2 pour la prise en charge initiale. Les autres points à envisager s’établissent comme suit :
- Les antibiotiques ne réduisent pas la gravité ni la durée de la diarrhée et peuvent accroître l’incidence de portage; ainsi ils ne doivent être utilisés qu’en cas de bactériémie ou d’infection invasive présumée ou démontrée.
- Les études publiées sur l’azithromycine sont limitées à la fièvre typhoïde ou paratyphoïde, mais compte tenu de la forte efficacité de ce médicament et de la simplicité de son administration, il est également recommandé en cas de bactériémie à SNT [7] (figure 2).
- Les patients qui font de la diarrhée doivent être considérés comme contagieux. Ils ne doivent pas travailler à la manipulation d’aliments avant la disparition complète des symptômes. La réglementation sur la fréquentation du milieu de garde malgré la persistance des symptômes dépend des régions sociosanitaires. Il n’est jamais nécessaire de surveiller le moment où les selles deviennent négatives à la SNT. En effet, le portage asymptomatique persiste souvent pendant des mois chez les jeunes enfants, mais les porteurs asymptomatiques ne devraient pas être empêchés de participer à quelque activité que ce soit.
- Pour trouver la source et ainsi éviter d’autres cas dans un même ménage, il faut poser des questions à la famille sur l’exposition à des « friandises » pour animaux qui contiennent de la viande crue. La famille doit être invitée à se départir des reptiles domestiques ou, du moins, s’assurer que ceux-ci ne se trouvent jamais dans la cuisine ou dans la baignoire.
- La santé publique est automatiquement avisée de toutes les cultures positives afin d’accélérer le dépistage des éclosions. L’espèce de Salmonella donne un indice de son origine.
Fièvre typhoïde ou paratyphoïde – voir les figures 1 et 2 pour la prise en charge initiale. Les autres points à envisager s’établissent comme suit :
- Jusqu’à récemment, la ciprofloxacine était souvent utilisée comme traitement dégressif. Bien que son utilisation ne soit pas approuvée avant la puberté, elle constitue une possibilité de traitement par voie orale qui assure la destruction intracellulaire et serait plus efficace que l’ampicilline, la céfixime [4] ou le triméthoprime-sulfaméthoxazole. Cependant, la résistance est devenue courante, et il ne faut utiliser des quinolones que si les isolats sont déclarés comme susceptibles. L’azithromycine est devenue le médicament de première intention parce qu’elle assure aussi une destruction intracellulaire [8] et qu’elle provoque beaucoup moins de résistance.
- La durée du traitement microbien est controversée. En cas de fièvre typhoïde ou paratyphoïde non compliquée, le Comité consultatif de la médecine tropicale et de la médecine des voyages du Canada recommande un traitement de sept jours à l’azithromycine, de trois à sept jours aux quinolones, de sept à 14 jours à la céfixime, de dix à 14 jours à la ceftriaxone et de 14 jours à l’amoxicilline ou au triméthoprime-sulfaméthoxazole [9]. On ne connaît pas clairement la durée totale d’un traitement dégressif par voie orale.
- On observe des rechutes dans un maximum de 17 % des cas, généralement dans un délai de quatre semaines [10]. Ces rechutes seraient attribuables à une maladie résiduelle dans le système réticuloendothélial plutôt qu’à une antibiorésistance. Le taux de rechute est peut-être plus faible après un traitement de cinq à sept jours à l’azithromycine qu’après un traitement aux quinolones ou à la ceftriaxone [11], probablement parce que l’azithromycine possède une excellente pénétration tissulaire et intracellulaire et une longue demi-vie [4]. La prise en charge optimale des rechutes n’est pas clairement établie.
- D’ordinaire, la fièvre persiste de six à huit jours après le début de l’antibiothérapie [4]. Elle n’est pas une contre-indication au passage des antibiotiques par voie orale ou au congé hospitalier, pourvu que l’enfant soit autrement bien.
- La réglementation varie selon les provinces ou les territoires, mais en général, il faut obtenir de deux à trois coprocultures négatives prises à 24 heures d’intervalle sur un nombre de jours donné après la fin de l’antibiothérapie pour que les personnes qui manipulent des aliments, les travailleurs de la santé et les enfants aux couches puissent reprendre le travail ou recommencer à fréquenter le milieu de garde. Il faudra peut-être obtenir des cultures d’urine si les patients ont habité dans une région où la schistosomiase est endémique, car la liaison entre la Salmonella et le Schistosoma favorise la survie prolongée du S typhi ou du S paratyphi, ainsi que des bactériuries intermittentes [12].
La prévention
Salmonella non typhique : Il est capital d’adopter une manipulation sécuritaire des aliments à la maison (www.cps.ca/documents/position/foodborne-infections) et un bon lavage des mains après un contact avec des animaux (particulièrement les bébés volailles, les reptiles et les grenouilles). Certains experts recommandent que les enfants d’âge préscolaire n’aient pas de contact avec ces animaux. La vaccination de la volaille semble avoir eu des conséquences importantes au Royaume-Uni [10], mais demeure volontaire au Canada.
Fièvre typhoïde ou paratyphoïde : Lors d’un voyage dans des pays pauvres en ressources, il est essentiel de choisir soigneusement les aliments et les boissons consommés et de pratiquer une bonne hygiène des mains (www.canada.ca/fr/sante-publique/services/ccmtmv/declaration-diarrhee-voyageur.html#a52).
Tous les enfants de 24 mois et plus qui se rendent en Asie du Sud (Afghanistan, Bangladesh, Bhoutan, Inde, Népal, Maldives, Pakistan et Sri Lanka) doivent se faire vacciner contre la typhoïde [12]. Il n’y a pas de vaccin homologué pour les enfants plus jeunes. La vaccination est à envisager pour les voyageurs vers d’autres pays pauvres en ressources s’ils sont susceptibles d’être exposés à des aliments ou de l’eau contaminés et qu’ils sont atteints d’achlorhydrie, d’asplénie ou d’anémie falciforme ou qu’ils sont immunodéprimés. Les contacts familiaux des porteurs doivent également être vaccinés.
Les vaccins suivants sont offerts au Canada (voir www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-23-vaccin-contre-typhoide.html pour obtenir plus d’information sur les doses) :
- Vaccin vivant oral : Vivotif – homologué pour les personnes de cinq ans et plus; dose de rappel recommandée au bout de sept ans
- Vaccin parentéral inactivé : TYPHERIX ou TYPHIM Vi – homologué pour les personnes de deux ans et plus; dose de rappel recommandée au bout de trois ans
- Vaccin parentéral inactivé combiné au vaccin contre l’hépatite A : ViVAXIM – homologué pour les personnes de 16 ans et plus; dose de rappel contre la typhoïde recommandée au bout de trois ans
Les trois vaccins ne sont efficaces qu’à environ 50 % pour le S typhi. On pense que seuls les vaccins oraux offrent une certaine protection contre le S paratyphi.
|
|
|
|
Remerciements
Le comité des soins aigus et le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie ont révisé le présent point de pratique. Des représentants de l’Association pour la microbiologie médicale et l’infectiologie Canada l’ont également révisé; nous les en remercions.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres : Michelle Barton-Forbes MD; Natalie A. Bridger MD; Shalini Desai MD; Michael Forrester MD; Ruth Grimes MD (représentante du conseil); Charles Hui (membre sortant); Nicole Le Saux MD (présidente); Joan L. Robinson MD (présidente sortante); Otto G. Vanderkooi MD (membre sortant)
Représentants : Upton D Allen MBBS, Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida chez les enfants; Tobey Audcent MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Carrie Byington MD, comité des maladies infectieuses, American Academy of Pediatrics; Fahamia Koudra MD, Le Collège des médecins de famille du Canada; Marc Lebel MD, Programme canadien de surveillance active de l’immunisation (IMPACT); Jane McDonald MD, Association pour la microbiologie médicale et l’infectiologie Canada; Dorothy L. Moore MD, Comité consultatif national de l’immunisation; Howard Njoo MD, Agence de la santé publique du Canada
Conseillère : Noni E. MacDonald MD
Auteure principale : Joan L. Robinson MD
Références
- Pegues DA, Miller SI. Salmonella species. In: Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 8e éd. Philadelphie, PA: Elsevier, 2015:2559-68.
- Sadler-Reeves L, Aird H, de Pinna E et coll. The occurrence of Salmonella in raw and ready-to-eat bean sprouts and sprouted seeds on retail sale in England and Northern Ireland. Lett Appl Microbiol 2016;62(2):126-9.
- van Dyk BN, de Bruin W, du Plessis EM, Korsten L. Microbiological food safety status of commercially produced tomatoes from production to marketing. J Food Prot 2016;79(3):392-406.
- Crump JA, Sjölund-Karlsson M, Gordon MA, Parry CM. Epidemiology, clinical presentation, laboratory diagnosis, antimicrobial resistance, and antimicrobial management of invasive Salmonella infections. Clin Microbiol Rev 2015;28(4):901-37.
- Harris JB, Ryan ED. Enteric fever and other causes of fever and abdominal symptoms. In: Bennett JE, Dolin R, Blaser MJ. Mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases, 8e éd. Philadelphie, PA: Elsevier, 2015:1270-82.
- Geme JW, Hodes HL, Marcy SM et coll. Consensus: Management of Salmonella infection in the first year of life. Pediatr Infect Dis J 1988;7(9):615-21.
- Salmonella Infections. In: Kimberlin DW, Brady MT, Jackson MA, Long SS, éd. Red Book: 2015 Report of the Committee on Infectious Diseases, 30e éd. Elk Grove Village, IL: American Academy of Pediatrics, 2015:695-702.
- Trivedi NA, Shah PC. A meta-analysis comparing the safety and efficacy of azithromycin over the alternate drugs used for treatment of uncomplicated enteric fever. J Postgrad Med 2012;58(2):112-8.
- Agence de la santé publique du Canada. Déclaration concernant les voyageurs internationaux et la typhoïde : une déclaration d’un Comité consultatif (DCC) du Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV). http://publications.gc.ca/site/fra/9.642858/publication.html
- Bula-Rudas FJ, Rathore MH, Maraqa NF. Salmonella infections in childhood. Adv Pediatr 2015;62(1):29-58.
- Butler T. Treatment of typhoid fever in the 21st century: Promises and shortcomings. Clin Microbiol Infect 2011;17(7):959-63.
- Barnhill AE, Novozhilova E, Day TA, Carlson SA. Schistosoma-associated Salmonella resist antibiotics via specific fimbrial attachments to the flatworm. Parasit Vectors 2011;28;4:123.
- Keithlin J, Sargeant JM, Thomas MK, Fazil A. Systematic review and meta-analysis of the proportion of non-typhoidal Salmonella cases that develop chronic sequelae. Epidemiol Infect 2015;143(7):1333-51.
- Değirmenci T, Arı A, Kozacıoğlu Z, Örs B, Günlüsoy B. Salmonella typhi isolated from urine culture before percutaneous nephrolithotomy: A case report. Urol J 2014;11(1):1350-2.
- Rai B, Utekar T, Ray R. Preterm delivery and neonatal meningitis due to transplacental acquisition of non-typhoidal Salmonella serovar montevideo. BMJ Case Rep 2014;2014:pii: bcr2014205082.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.