Document de principes
L’allergie aux protéines du lait de vache chez les nourrissons et les enfants
Affichage : le 25 juin 2024
Auteur(s) principal(aux)
Pushpa Sathya MD, Tanis R. Fenton Dt.P., Ph.D., Comité de nutrition et de gastroentérologie
Résumé
L’allergie aux protéines du lait de vache (APLV) est une réaction à médiation immunitaire aux protéines du lait de vache qui peut toucher de multiples systèmes organiques, y compris le tractus gastro-intestinal. Une réaction induite par les immunoglobulines E (IgE) entraîne l’apparition rapide de symptômes allergiques faciles à reconnaître. Cependant, des réactions tardives (non induites par les IgE ou les cellules) ou mixtes (induites par les IgE et les cellules) entraînent une série de symptômes qui ressemblent à d’autres affections et dont le moment d’apparition et la gravité sont très variables. Il est difficile de déterminer si les symptômes sont attribuables à une APLV à médiation immunitaire, à une réaction non immunologique au lait de vache ou à autre chose que l’exposition au lait de vache, mais il est essentiel d’y parvenir pour proposer une prise en charge efficace. Le tableau clinique de l’APLV non induite par les IgE peut varier, mais cette affection, généralement autorésolutive, disparaît entre l’âge de un et six ans. Il faut éviter les batteries de dosages des immunoglobulines G (IgG) pour déceler les intolérances alimentaires spécifiques aux antigènes qui ne reposent pas sur des données probantes, parce qu’elles peuvent entraîner un surdiagnostic de prétendues intolérances alimentaires. Le surdiagnostic d’APLV peut être responsable de la surutilisation de préparations fortement hydrolysées, ce qui a des répercussions financières importantes pour les familles. Le présent document de principes, qui traite de l’APLV non induite par les IgE ou les cellules, aide les professionnels de la santé à distinguer et reconnaître les diverses réactions au lait de vache, aborde le rôle des tests diagnostiques et fournit des recommandations de prise en charge en fonction des données probantes exemplaires.
Mots-clés : allergie aux protéines du lait de vache (APLV); entéropathie induite par les protéines alimentaires (EIPA); épreuve de provocation orale; intolérance au lait de vache; préparation à base d’acides aminés (PAA); préparation fortement hydrolysée (PFH); proctocolite allergique induite par les protéines alimentaires (PAIPA); syndrome d’entérocolite induite par les protéines alimentaires (SEIPA)
INTRODUCTION ET DÉFINITIONS
L’ingestion de lait de vache peut provoquer des réactions aux symptômes variés qui peuvent ressembler à des affections non apparentées. Le diagnostic de ces réactions est compliqué par la non-uniformité de la terminologie pour les décrire, ce qui suscite de la confusion auprès des cliniciens tout autant que des familles. Le présent document de principes traite de l’allergie aux protéines de lait de vache (APLV) non induite par les immunoglobulines E (IgE), mais il est important de définir des termes courants comme « intolérance au lait de vache », souvent confondu avec l’APLV et ses divers sous-types.
L’intolérance au lait de vache
L’intolérance au lait de vache est une réponse indésirable non immunologique au lait de vache attribuable à une carence enzymatique en lactase. La carence en lactase est rare chez les nourrissons. Elle se développe généralement à la fin de l’enfance ou à l’âge adulte, et les symptômes se limitent au tractus gastro-intestinal. L’intolérance au lait de vache est une affection bénigne responsable de la digestion inappropriée du lactose, et, par conséquent, de l’intolérance au lactose. La maldigestion et la malabsorption du lactose provoquent la fermentation du lactose non digéré par les bactéries du côlon, de même que la production d’hydrogène, de dioxyde de carbone et d’acide lactique, qui, à leur tour, entraînent un ou plusieurs des symptômes suivants : douleurs abdominales, ballonnements, flatulences et diarrhées aqueuses. La gravité des symptômes dépend de la quantité de lactose ingérée par rapport à l’activité de la lactase intestinale. Pour traiter l’intolérance au lactose, il suffit de réduire la consommation de lait de vache ou d’y ajouter des agents hydrolysants[1].
L’allergie aux protéines du lait de vache
L’APLV, qui désigne des réactions indésirables à médiation immunitaire à une ou plusieurs protéines du lait de vache (PLV)[2][3], est surtout observée pendant l’enfance. Elle peut être immédiate (induite par les IgE), tardive (non induite par les IgE ou les cellules) ou mixte (induite par les IgE et non induite par les IgE ou les cellules) (figure 1)[4]-[6]. Le tableau clinique est variable et peut toucher de multiples systèmes organiques, y compris le tractus gastro-intestinal, le système respiratoire et la peau. Les réactions peuvent être légères, modérées, graves ou avoir un potentiel mortel.
Les PLV sont composées de deux principales fractions de protéines : la caséine (de 76 % à 86 %) et le lactosérum (ou petit-lait, de 14 % à 24 %), lui-même constitué de bêta-lactoglobuline, d’alpha-lactalbumine, d’albumine sérique et d’immunoglobulines sériques. De ces éléments, la caséine et la bêta-lactoglobuline sont les deux protéines les plus allergènes et les plus résistantes à la chaleur, mais le degré de sensibilité personnelle à chacune d’elle est variable[1]. Les protéines du lait ingéré sont dégradées par les acides gastriques et les enzymes digestives de la lumière intestinale. Lorsque la muqueuse intestinale est exposée à ces antigènes du lait de vache, les cellules présentatrices d’antigènes interagissent avec les lymphocytes T et B. En cas d’APLV, les lymphocytes T et B activés des follicules lymphoïdes migrent par le système lymphatique et les vaisseaux sanguins vers d’autres organes, déclenchent une réaction inflammatoire dans l’organe ciblé, un accroissement de la perméabilité intestinale et des manifestations cliniques.
La classification des réactions indésirables au lait de vache (figure 1)
- Réaction induite par les IgE (immédiate) : Réaction anaphylactique touchant de multiples systèmes et se manifestant par de l’urticaire, un angiœdème des lèvres et des yeux, des vomissements, des sibilances[4] ou une hypotension.
- Réaction non induite par les IgE ou les cellules (tardive): Il n’y a généralement pas d’IgE induites par les aliments, et la réaction gastro-intestinale après l’exposition aux aliments se fait tardivement et peut être chronique[5].
a) Proctocolite allergique induite par les protéines alimentaires (PAIPA) – saignements rectaux avec ou sans mucus
b) Entéropathie induite par les protéines alimentaires (EIPA) – diarrhée et retard staturopondéral
c) Syndrome d’entérocolite induite par les protéines alimentaires (SEIPA) – diarrhée, vomissements et léthargie
3. Réaction mixte induite par les IgE ou non induite par les IgE ou les cellules (tardive) : Les symptômes sont tardifs et dépendent de l’étendue de l’infiltration éosinophile des organes touchés[6].
a) Œsophagite à éosinophiles – vomissements ou dysphagie
b) Gastroentérites allergiques à éosinophiles – diarrhée ± saignements rectaux
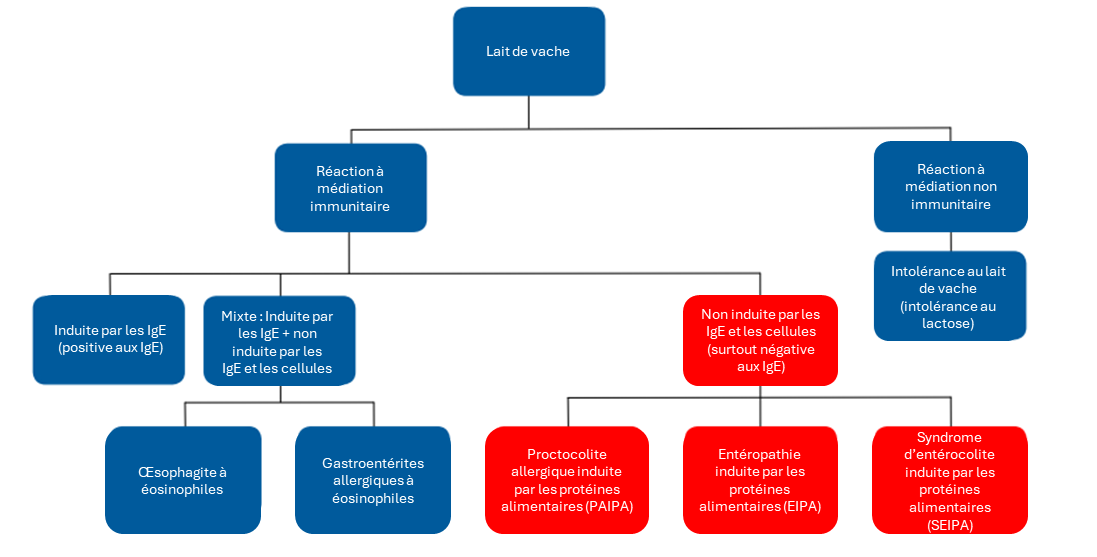
Figure 1. Classification des réactions indésirables au lait de vache
Le présent document de principes traite de l’APLV non induite par les IgE et les cellules. Les réactions induites par les IgE et les réactions mixtes induites par les IgE et non induites par les IgE en dépassent la portée.
L’ÉPIDÉMIOLOGIE
Les PLV sont la principale cause d’allergie chez les nourrissons et les enfants de moins de trois ans, mais la prévalence déclarée d’APLV varie largement en fonction de la population à l’étude. Bien que de 5 % à 15 % des nourrissons présentent des symptômes évocateurs de réactions indésirables aux PLV[7], les estimations de la véritable prévalence d’APLV se situent entre 2 % et 7,5 %[2]. Les études populationnelles rendent compte d’une prévalence de 1,9 % à 4,9 % chez les jeunes enfants[8] et de moins de 1 % chez les enfants de plus de six ans. L’incidence déclarée d’APLV chez les nourrissons allaités exclusivement oscille entre 0,4 % et 0,5[9][10].
La prévalence déclarée des sous-types d’APLV est tout aussi variable. Dans une vaste cohorte de nouveau-nés israéliens, la prévalence de PAIPA s’établissait à 0,16 %[11]. En revanche, une récente étude observationnelle prospective réalisée par des pédiatres américains auprès de nouveau-nés en santé présentant du sang occulte a signalé une incidence cumulative de PAIPA de 17 %, ce qui a donné lieu à un surdiagnostic[12]. L’EIPA est relativement peu courante et mal définie[13]. Une étude finlandaise a établi une prévalence d’EIPA au lait de vache de 2,2 % chez des enfants plus âgés[14].
Le SEIPA, observé et défini officiellement au milieu des années 1970[15], est maintenant considéré comme une maladie rare dont l’incidence cumulative se situe entre 0,015 % et 0,7 % chez les enfants[16]-[18]. L’incidence de SEIPA s’établissait à 15,4 cas sur 10 000 enfants de moins de 24 mois par année[17]. Dans une cohorte prospective de naissances dans un seul hôpital sur une période de deux ans, l’incidence cumulative de nourrissons atteints du SEIPA induit par le lait de vache s’établissait à trois cas sur 1 000 nouveau-nés (0,34 %)[18][19].
D’autres maladies atopiques touchent de 40 % à 60 % des enfants ayant un SEIPA[16][20][21], et de 40 % à 50 % de ceux ayant une EIPA ou une PAIPA[12][14]. Tant l’EIPA que le SEIPA ont été signalés chez des nourrissons ayant le syndrome de Down, dont l’évolution peut être prolongée[22] en raison de déficits immunitaires intrinsèques[23].
L’ÉVALUATION DES NOURRISSONS ET DES ENFANTS CHEZ QUI ON SOUPÇONNE UNE ALLERGIE AUX PROTÉINES DU LAIT DE VACHE NON INDUITE PAR LES IMMUNOGLOBULINES E
L’APLV non induite par les IgE désigne un spectre de maladies chez le nourrisson, se manifeste par des symptômes gastro-intestinaux tardifs et est formé de trois entités, la PAIPA, l’EIPA et le SEIPA[5], chacune étant dotée de caractéristiques particulières[3]. La PAIPA et le SEIPA se situent à des extrémités opposées du spectre de gravité. Les symptômes, qui peuvent être légers, modérés ou graves, siègent principalement dans le système gastro-intestinal et s’associent à un risque de prise de poids insuffisante attribuable à la diarrhée chronique, aux vomissements, au refus de s’alimenter et aux saignements rectaux. Les systèmes cutané et respiratoire peuvent être touchés chez les enfants ayant un SEIPA atypique. Les principaux déclencheurs sont les PLV et le soja, mais les œufs, le blé, le riz et d’autres aliments peuvent également en être responsables[24][25].
Les nourrissons qui sont allaités exclusivement et sont atteints d’une APLV non induite par les IgE ont tendance à présenter des symptômes légers à modérés[7]; les symptômes graves ou au potentiel mortel sont rares dans cette population[26]. L’APLV non induite par les IgE est essentiellement un diagnostic clinique, à l’exception de l’EIPA, qui doit être confirmée par voie histologique. La résolution des symptômes est constatée à l’évitement de l’aliment responsable. Une anamnèse attentive, y compris l’histoire atopique du nourrisson ou de l’enfant et de sa famille et un examen physique approfondi, est essentielle pour distinguer les diverses présentations phénotypiques et déterminer les affections qui ne sont pas liées à l’exposition au lait de vache. Dans les cas de PAIPA, on observe une histoire familiale d’atopie chez 60 % des membres de la parenté au premier degré et dans les cas de SEIPA, chez 80 % d’entre eux[16][17][27].
Les résultats des dosages d’IgE sont négatifs chez la plupart des nourrissons et des enfants atteints d’une APLV non induite par les IgE, et le risque de multiples allergies alimentaires est peu probable[28]. Cependant, quelques enfants atteints de dermatite atopique, d’asthme ou de rhinoconjonctivite sont plus vulnérables à une APLV positive aux IgE (p. ex., un SEIPA atypique). Étant donné l’absence de tests pour diagnostiquer l’APLV non induite par les IgE et les symptômes non spécifiques qui ressemblent à une multitude d’autres affections, il est important de s’attarder à l’exactitude du diagnostic et de soupeser les avantages et les risques des interventions envisagées.
La proctocolite allergique induite par les protéines alimentaires
On peut observer la PAIPA chez les nourrissons allaités et alimentés par des préparations commerciales. Selon une récente méta-analyse, jusqu’à 50 % des nourrissons atteints d’une PAIPA sont allaités[29][30]. Des symptômes comme des traînées de sang dans les selles ou une hématochézie peuvent se manifester dans les deux à huit premières semaines de vie, induites par une inflammation localisée du côlon distal chez des nourrissons qui semblent autrement en bonne santé[27][29]. Une infiltration à éosinophiles dense de la muqueuse rectosigmoïde est présente, mais on ne sait pas pourquoi la réponse inflammatoire se situe dans le côlon distal[27].
Il n’est pas nécessaire d’obtenir un bilan de laboratoire en cas de PAIPA chez le nourrisson, même en présence d’anémie, d’éosinophilie périphérique ou d’hypoalbuminémie[31][32]. La réponse à l’élimination des produits laitiers et du soja du régime alimentaire est le seul test diagnostique nécessaire, car les dosages des IgE sériques et de radiollergosorbent relatifs (RAST) à certains aliments sont souvent négatifs.
La plupart des nourrissons atteints de PAIPA présenteront une résolution progressive de leurs symptômes au plus tard trois jours après avoir retiré du régime alimentaire de la mère la protéine responsable ou avoir adopté une préparation hypoallergène, même s’il peut falloir jusqu’à deux semaines avant de parvenir à une résolution complète[29][33]. La colonoscopie accompagnée d’une biopsie n’est pas utile, à moins d’une ambiguïté diagnostique.
L’entéropathie induite par les protéines alimentaires
L’EIPA touche surtout l’intestin grêle, ce qui entraîne une malabsorption et un retard staturopondéral[5]. Elle se caractérise par de la diarrhée chez le nourrisson, souvent accompagnée de vomissements et de distension abdominale[31][32]. L’infiltration de lymphocytes T spécifiques au lait de vache (les lymphocytes T CD8+ cytotoxiques en particulier) dans le jéjunum est responsable d’une malabsorption[27]. Les éléments distinctifs incluent une malabsorption accompagnée d’une stéatorrhée chez jusqu’à 80 % des nourrissons et l’absence des symptômes aigus en cas de SEIPA[13].
Des tests de laboratoire, une gastroscopie et une biopsie s’imposent pour confirmer le diagnostic d’EIPA et le distinguer d’autres causes de retard staturopondéral et de diarrhée chez le nourrisson (p. ex., l’infection, la maladie cœliaque et l’insuffisance pancréatique attribuables à la fibrose kystique). Les tests de laboratoire peuvent révéler une éosinophilie périphérique, une carence en vitamines liposolubles, une anémie, une hypoprotéinémie et un temps de coagulation prolongé[13][34][35]. L’analyse des selles révèle une malabsorption des graisses chez 80 % des patients[13]. Les biopsies jéjunales démontrent une atrophie villeuse et une hyperplasie fovéolaire (des cryptes).
Le syndrome d’entérocolite induite par les protéines alimentaires
Le SEIPA causé par le lait de vache et le soja est rare chez les nourrissons allaités exclusivement, même si on l’a signalé dans quelques rapports de cas[36][37]. Les nourrissons et les jeunes enfants présentant un SEIPA éprouvent des symptômes[34][38] de gravité variable, mais qui se caractérisent par des vomissements répétés, des diarrhées aqueuses et parfois sanglantes, une pâleur et une léthargie[39]. L’infiltration des lymphocytes T spécifiques aux aliments et l’inflammation sont responsables d’un accroissement de la perméabilité intestinale, qui entraîne des mouvements de liquides dans le tractus gastro-intestinal et un influx croissant d’antigènes[27]. On estime que 15 % des nourrissons éprouvent des symptômes graves, y compris la déshydratation, le choc hypovolémique et l’acidose métabolique, qui peuvent être confondus avec une entérite infectieuse ou un sepsis. Le moment et l’âge d’apparition des symptômes, leur gravité et les déclencheurs alimentaires peuvent également varier[27].
Aux États-Unis et en Europe, les aliments les plus responsables du SEIPA sont le lait de vache, le soja et les grains[40][41], mais ce syndrome peut également être attribuable au riz, au poulet, à la viande rouge, aux fruits, au maïs, au blé, aux pommes de terre, aux patates douces et aux champignons[39][42][43]. L’avoine, les œufs et les fruits de mer (poissons et crustacés) en sont souvent les déclencheurs chez les enfants plus âgés[44].
Le SEIPA aigu causé par les PLV ou le soja se manifeste chez les nourrissons âgés de deux à sept mois, et les symptômes se déclarent de une à quatre heures après l’ingestion de l’aliment responsable[45][46]. Dans plus de 95 % des cas, les vomissements profus et répétés en sont le syndrome caractéristique, qui peuvent également être associés à de la pâleur, de la léthargie et de la diarrhée chez 25 % à 50 % des nourrissons de cinq à dix heures après l’ingestion. Chez 15 % des nourrissons, les symptômes sont graves et peuvent se détériorer jusqu’à provoquer un choc hypovolémique, une hypothermie, une méthémoglobinémie et une acidémie, dans un tableau clinique évocateur de sepsis. Cependant, ils disparaissent généralement dans les 24 heures suivant l’élimination de l’aliment déclencheur[46].
Le SEIPA chronique attribuable aux PLV ou au soja peut être plus insidieux chez certains nourrissons âgés de moins de quatre mois alimentés par des préparations commerciales, l’ingestion quotidienne de la protéine alimentaire responsable entraînant des symptômes tardifs qui se déclarent jusqu’à 24 heures après l’ingestion. Les vomissements intermittents, les diarrhées aqueuses chroniques et les retards staturopondéraux font partie des symptômes[15]. Les symptômes graves peuvent inclure la déshydratation et le choc, la léthargie, la cyanose, l’hypotension, l’hypothermie et la méthémoglobinémie[26], trop peu reconnue comme manifestation possible de SEIPA[47]. Les symptômes s’atténuent dans les trois à dix jours suivant le retrait de la préparation responsable et l’adoption d’une préparation hypoallergène[46].
En cas de SEIPA atypique, certains enfants ayant un SEIPA peuvent obtenir des résultats positifs aux IgE spécifiques à la protéine responsable[48][49]. Ils semblent plus vulnérables à une allergie induite par les IgE, et leur évolution est plus lente[34][45].
Le SEIPA peut être difficile à diagnostiquer, car c’est une affection peu connue, aux symptômes non spécifiques, qui peut ressembler à une gastroentérite virale, une anaphylaxie ou un sepsis. C’est un diagnostic clinique, et une anamnèse approfondie en est l’outil diagnostique le plus important. Selon des critères diagnostiques plus récents fondés sur des données probantes, les vomissements répétitifs (un critère majeur) sont la caractéristique fondamentale d’un SEIPA aigu, et au moins trois critères mineurs doivent s’y ajouter pour confirmer le diagnostic[46]. Le diagnostic différentiel inclut le sepsis, la gastroentérite infectieuse, l’entérocolite nécrosante, l’occlusion intestinale, les erreurs innées du métabolisme, la maladie cœliaque, les maladies inflammatoires de l’intestin, la maladie gastro-intestinale à éosinophiles et l’anaphylaxie[21][50].
Il n’y a pas de tests précis pour diagnostiquer le SEIPA, mais le nourrisson qui semble malade doit être soumis à des examens, y compris un hémogramme, des gaz sanguins et des analyses biochimiques pour dépister l’anémie, la leucocytose accompagnée de neutrophilie, l’éosinophilie, la thrombocytose, l’acidose sans trou anionique, la méthémoglobinémie et l’hypoalbuminémie[39]. Le bilan de laboratoire est généralement normal après la résolution de la réaction causée par le SEIPA. Certains cas de SEIPA, qu’on appelle « SEIPA atypique », sont accompagnés d’une sensibilisation IgE[51]. Cependant, la plupart des enfants ayant un SEIPA obtiennent un résultat négatif à l’intradermoréaction et aux IgE spécifiques aux aliments. Une épreuve de provocation orale sous supervision médicale est la norme diagnostique, mais n’est pas recommandée en cas d’histoire clinique classique[46][52]. Cependant, elle peut contribuer à déterminer si, avec l’âge, le SEIPA a disparu chez l’enfant.
Il faut également éviter d’autres examens diagnostiques non démontrés (tels qu’une batterie de dosages des IgG pour déceler les intolérances alimentaires spécifiques aux antigènes) parce qu’ils ne reposent pas sur des données probantes et qu’ils peuvent entraîner un surdiagnostic de prétendues intolérances alimentaires[53[54].
LA PRISE EN CHARGE DES NOURRISSONS ET DES ENFANTS ATTEINTS D’UNE ALLERGIE AUX PROTÉINES DU LAIT DE VACHE NON INDUITE PAR LES IMMUNOGLOBULINES E
Il existe des directives fondées sur des données probantes sur l’utilisation de produits alimentaires pour traiter l’APLV non induite par les IgE[55]-[59] et des directives pratiques pour contribuer à une prise en charge efficace des nourrissons et des enfants ayant une APLV[8][25][60][61]. La stratégie la plus sûre consiste à éviter rigoureusement les PLV. Tant le besoin d’administrer une préparation pour nourrisson que le meilleur choix de préparation à administrer dépendent de l’âge de l’enfant et de la présence d’autres allergies alimentaires. La plupart des nourrissons et des enfants ayant une APLV tolèrent une préparation fortement hydrolysée (PFH), et moins de 10 % des nourrissons ont besoin d’une préparation à base d’acides aminés (PAA)[62].
Le mécanisme exact de l’acquisition de la tolérance n’est pas clair[7]. L’évolution naturelle des allergies alimentaires gastro-intestinales non induites par les IgE est généralement favorable; les nourrissons les plus touchés y deviennent tolérants au cours de leurs premières années de vie, et la plupart des cas sont résolus avant l’âge scolaire[30]. À l’âge d’un an, 50 % des enfants sont devenus tolérants, plus de 75 % le sont à l’âge de trois ans, et plus de 90 % à l’âge de six ans[63]. Les éliminations prolongées d’aliments sont à éviter parce qu’elles peuvent nuire à la qualité de vie et à la croissance tout en engageant des coûts inutiles pour les familles.
En cas de PAIPA chez les nourrissons allaités, il faut envisager l’élimination empirique des produits laitiers et du soja, qui sont les principaux allergènes dans le régime de la mère, sur une période de deux semaines[64]. D’autres déclencheurs sont possibles, tels que les œufs et le maïs, qui peuvent être éliminés du régime de la mère si les symptômes ne disparaissent pas après l’élimination des produits laitiers et du soja[39]. Il est fortement recommandé d’obtenir le counseling d’une diététiste diplômée spécialisée en pédiatrie pour s’assurer de répondre aux besoins nutritionnels du nourrisson, ainsi que d’éviter les sources d’allergènes cachées. Il est important de soutenir les mères qui allaitent et d’enrichir leur régime par 500 mg de calcium deux fois par jour et par de la vitamine D (en fonction de leur lieu de résidence et de l’évaluation nutritionnelle de leur régime ). Si les symptômes du nourrisson persistent, il est recommandé de lui donner d’abord une PFH, les PAA étant réservées aux moins de 10 % de nourrissons qui ne répondent pas aux PFH.
En cas de PAIPA chez les nourrissons alimentés par des préparations commerciales, le régime d’élimination commence par l’administration d’une PFH, dont l’efficacité est démontrée chez les nourrissons ayant une APLV[8][56], même si une PAA peut être indiquée pour certains nourrissons dont les symptômes persistent plus de deux à quatre semaines. Les autres sources de lait animal (p. ex., lait de chèvre ou de brebis) doivent être rigoureusement évitées en raison de leur transréactivité élevée et de leur inadéquation nutritionnelle[56][65][66]. Les préparations à base de soja font partie des solutions envisagées chez les nourrissons de plus de six mois lorsque la PFH n’est pas acceptée ou tolérée, pourvu que la tolérance aux protéines de soja ait été établie[60]. Une méta-analyse des suppléments probiotiques n’a pas révélé de résolution rapide de l’hématochézie, mais leur prise était associée à un taux plus élevé de tolérance aux PLV au bout de trois ans[67].
En général, les symptômes de PAIPA s’atténuent dans les 72 heures suivant l’élimination de l’aliment responsable, mais il peut falloir jusqu’à deux semaines avant que les selles se normalisent. La plupart des nourrissons tolèrent les PLV à l’âge d’un an, et le problème persiste rarement après l’âge de deux ans[12][31]. On peut reprendre l’épreuve de provocation au lait de vache pasteurisé frais pour évaluer la tolérance aux PLV à l’âge d’un an, car la plupart des enfants y deviennent tolérants à l’âge de un ou deux ans[68]-[70].
En cas d’EIPA chez les nourrissons allaités qui présentent un retard staturopondéral, les cliniciens doivent envisager l’élimination empirique du lait de vache et du soja du régime de la mère pendant deux à quatre semaines. Si les symptômes ne s’atténuent pas OU si le nourrisson est alimenté par une préparation commerciale, une PAA est recommandée[32]. Il est important de surveiller la croissance du nourrisson et s’il a des carences nutritionnelles.
Il faut des semaines avant que les symptômes d’EIPA disparaissent une fois la protéine responsable éliminée, parce que l’atteinte villeuse et la malabsorption peuvent être prononcées. Il est recommandé de reprendre l’épreuve de provocation au lait de vache pasteurisé frais pour évaluer la tolérance aux PLV après l’âge d’un an, car la plupart des enfants y deviennent tolérants à l’âge de un à deux ans[68]-[70]. Si le nourrisson n’y est pas tolérant à l’âge d’un an, on peut envisager de reprendre l’épreuve à la maison à l’âge de 18 mois. Pour rassurer les parents, les dispensateurs de soins peuvent leur annoncer que le pronostic est favorable à long terme, car la plupart des nourrissons deviennent tolérants à la protéine responsable avant l’âge de deux ou trois ans[24].
En cas de SEIPA, il existe des directives consensuelles internationales récentes sur le diagnostic et la prise en charge[46][52]. Le SEIPA aigu est une urgence médicale qui exige une réanimation liquidienne énergique ainsi que la prise de stéroïdes et d’ondansétron (qui comporte un risque de prolongation de l’intervalle QT) chez les nourrissons ayant un choc hypovolémique[39].
Chez les nourrissons allaités, le SEIPA symptomatique est rare. Le SEIPA aigu léger à modéré peut être résolu par une réhydratation orale ou l’allaitement à la maison. Si le nourrisson réagit à l’allaitement, il est recommandé d’éliminer les produits laitiers et le soja du régime de la mère. Si les symptômes ne disparaissent pas, il faut arrêter l’allaitement, et il est alors recommandé d’utiliser une PFH. Pour éviter les récidives aiguës récurrentes, la mère doit s’abstenir rigoureusement d’ingérer les protéines alimentaires responsables.
Chez les nourrissons ayant un SEIPA qui sont alimentés par une préparation commerciale, l’Organisation mondiale contre les allergies (World Allergy Organization) recommande d’utiliser une PFH[8], et de 10 % à 20 % des nourrissons ont besoin d’une PAA[29][41]. L’American Academy of Pediatrics (AAP)[55] et l’European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN)[60] recommandent toutes deux d’administrer une PAA aux nourrissons ayant un SEIPA qui présentent un retard staturopondéral[8][46][71]. Il est recommandé d’éviter rigoureusement tous les produits laitiers, y compris les formes chauffées ou cuites au four de l’allergène responsable. Une approche raisonnable consiste à commencer par administrer une PFH et à envisager d’adopter plutôt une PAA si les symptômes ne disparaissent pas ou si la croissance n’a pas repris au bout de deux semaines.
En général, le SEIPA aigu se résorbe au bout de quelques heures grâce à la réhydratation, mais il faut de quelques jours à deux semaines avant la résolution d’un SEIPA chronique. Chez la plupart des enfants, le SEIPA disparaît avec l’âge. Le taux global de résolution se situe entre 50 % et 90 % à l’âge de six ans[29][41], ces variations dépendant du type d’aliment et du lieu de résidence[72][73]. Une série d’études rétrospectives réalisées aux États-Unis fait état d’un taux de résolution du SEIPA lié au lait de vache ou au soja de 35 % à l’âge de deux ans, de 70 % à l’âge de trois ans et de 85 % à l’âge de cinq ans[41]. Les nourrissons ayant un SEIPA atypique et une sensibilisation IgE concomitante présentent une évolution plus lente[20] et risquent d’acquérir une allergie alimentaire induite par les IgE[41].
Une épreuve de provocation orale doit être effectuée sous étroite supervision du médecin de 12 à 18 mois après la dernière réaction pour évaluer si le SEIPA est résolu[46][74]. Il est important d’assurer un suivi pour éviter des restrictions alimentaires inutiles et des carences alimentaires.
Pour résumer, en raison des symptômes non spécifiques de l’APLV non induite par les IgE et de l’absence de modalités de tests précises, le diagnostic est difficile à poser. Cependant, le fait de connaître les trois sous-types de cette affection et les récents critères diagnostiques du SEIPA peut contribuer au dépistage de cette allergie et à sa prise en charge. L’évaluation des risques de sous-diagnostic et de surdiagnostic de l’APLV devrait faire partie du bilan clinique. L’arrêt prématuré de l’allaitement, la surutilisation de PFH ou de PAA coûteuses et la crainte des réactions allergiques de la part des parents en sont des conséquences qui ne sont pas faciles à contrer. Les médecins peuvent contribuer à atténuer ces risques par des explications réfléchies et un soutien aux parents et aux proches, tout en établissant une collaboration au plan thérapeutique.
RECOMMANDATIONS
- Il est important d’utiliser une terminologie uniforme appropriée auprès des familles. L’allergie aux protéines du lait de vache (APLV) ne doit pas être confondue avec l’intolérance au lait de vache, qui est rare chez les nourrissons.
- La proctocolite allergique induite par les protéines alimentaires (PAIPA) est le principal sous-type d’APLV non induite par les immunoglobulines E (IgE) chez les nourrissons allaités ou alimentés par une préparation commerciale. Le clinicien doit faire preuve de prudence pour éviter le surdiagnostic d’APLV et une surutilisation de préparations hydrolysées, laquelle peut avoir d’importantes répercussions financières pour certaines familles.
- Éviter l’élimination prolongée d’aliments lors de la prise en charge des allergies alimentaires non induites par les IgE, car des risques nutritionnels y sont associés.
- Il n’y a pas de test précis pour diagnostiquer l’APLV non induite par les IgE, sauf la biopsie de l’intestin grêle pour confirmer une entéropathie induite par les protéines alimentaires (EIPA). Éviter d’utiliser des tests diagnostiques non démontrés (batteries de dosages des IgG pour déceler les intolérances alimentaires spécifiques aux antigènes), qui peuvent être responsables de prétendues intolérances alimentaires.
- Lorsque le diagnostic est incertain, orienter les nourrissons vers un gastroentérologue pédiatre pour éviter la surutilisation de préparations hydrolysées.
- Chez les nourrissons allaités ayant une PAIPA, encourager l’allaitement tout en éliminant les produits laitiers et le soja du régime de la mère. L’orientation en diététique peut contribuer à déterminer les sources cachées d’allergènes et à répondre aux besoins nutritionnels de la mère. Si les symptômes persistent, envisager d’utiliser une préparation fortement hydrolysée (PFH).
- Chez les nourrissons ayant une APLV qui sont alimentés par une préparation commerciale, envisager une PFH. En cas de SEIPA grave accompagné d’un retard staturopondéral, il est recommandé d’administrer une préparation à base d’acides aminés.
- En cas de PAIPA et d’EIPA, envisager de reprendre l’épreuve de provocation au lait de vache pasteurisé frais à la maison après l’âge d’un an.
- En cas de syndrome d’entérocolite induite par les protéines alimentaires (SEIPA), effectuer une épreuve de provocation orale sous la supervision étroite d’un médecin de 12 à 18 mois après la dernière réaction pour évaluer si le syndrome a bien disparu.
Remerciements
Le comité directeur de la section des allergies et le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie ont révisé le présent document de principes.
LE COMITÉ DE NUTRITION ET DE GASTROENTÉROLOGIE DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (mars 2022)
Membres : Belal Alshaikh MD, Pushpa Sathya MD, Gina Rempel MD, Ana Sant’Anna MD (présidente), Rilla Schneider MD (membre résidente), Christopher Tomlinson MD (membre sortant), Linda Casey MD (membre sortante), Eddy Lau MD (représentant du conseil)
Représentantes : Subhadeep Chakrabarti (Santé Canada), Jennifer McCrea (Santé Canada), Tanis R. Fenton Dt.P., Ph. D. (Les diététistes du Canada), Laura N. Haiek MD, M. Sc. (Comité canadien pour l’allaitement)
Auteures principales : Pushpa Sathya MD, Tanis R. Fenton, Dt.P., Ph. D.
Références
- Bahna SL. Cow’s milk allergy versus cow’s milk intolerance. Ann Allergy Asthma Immunol 2002;89(6 Suppl 1):56-60. doi : 10.1016/s1081-1206(10)62124-2.
- Hill DJ, Firer MA, Shelton MJ, Hosking CS. Manifestations of milk allergy in infancy: Clinical and immunologic findings. J Pediatr 1986;109(2):270-6. doi : 10.1016/s0022-3476(86)80384-5.
- Tordesillas L, Berin MC, Sampson HA. Immunology of food allergy. Immunity 2017;47(1):32-50. doi : 10.1016/j.immuni.2017.07.004.
- Waserman S, Bégin P, Watson W. IgE-mediated food allergy. Allergy Asthma Clin Immunol 2018;14(Suppl 2):55. doi : 10.1186/s13223-018-0284-3.
- Caubet JC, Szajewska H, Shamir R, Nowak-Węgrzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol 2017;28(1):6-17. doi : 10.1111/pai.12659.
- Koutri E, Papadopoulou A. Eosinophilic gastrointestinal diseases in childhood. Ann Nutr Metab 2018;73(Suppl 4):18-28. doi : 10.1159/000493668.
- Host A. Frequency of cow’s milk allergy in childhood. Ann Allergy Asthma Immunol 2002;89(6 Suppl 1):33-7. doi : 10.1016/s1081-1206(10)62120-5.
- Fiocchi A, Brozek J, Schünemann H et coll. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) guidelines. World Allergy Organ J 2010;3(4):57-161. doi : 10.1097/WOX.0b013e3181defeb9.
- Jakobsson I, Lindberg T. A prospective study of cow’s milk intolerance in Swedish infants. Acta Pediatr Scand 1979;68(6):853-9. doi : 10.1111/j.1651-2227.1979.tb08223.x.
- Saarinen KM, Juntunen-Badman K, Järvenpää AL et coll. Supplementary feeding in maternity hospitals and the risk of cow’s milk allergy: A prospective study of 6209 infants. J Allergy Clin Immunol 1999;104(2 Pt 1):457-61. doi : 10.1016/s0091-6749(99)70393-3.
- Elizur A, Cohen M, Goldberg MR et coll. Cow’s milk associated rectal bleeding: A population based prospective study. Pediatr Allergy Immunol 2012;23(8):766-70. doi : 10.1111/pai.12009.
- Martin VM, Virkud YV, Seay H et coll. Prospective assessment of pediatrician-diagnosed food protein-induced allergic proctocolitis by gross or occult blood. J Allergy Clin Immunol Pract 2020;8(5):1692-99.e1. doi : 10.1016/j.jaip.2019.12.029.
- Savilahti E. Food induced malabsorption syndromes. J Pediatr Gastroenterol Nutr 2000;30 Suppl):S61-6. doi : 10.1097/00005176-200001001-00010.
- Kokkonen J, Haapalahti M, Tikkanen S, Karttunen R, Savilahti E. Gastrointestinal complaints and diagnosis in children: A population-based study. Acta Pediatr 2004;93(7):880-6.
- Powell GK. Milk- and soy-induced enterocolitis of infancy. Clinical features and standardization of challenge. J Pediatr 1978;93(4):553-60. doi : 10.1016/s0022-3476(78)80887-7.
- Nowak-Wegrzyn A, Warren CM, Brown-Whitehorn T, Cianferoni A, Schultz-Matney F, Gupta RS. Food protein-induced enterocolitis syndrome in the US population-based study. J Allergy Clin Immunol 2019;144(4):1128-30. doi : 10.1016/j.jaci.2019.06.032.
- Mehr S, Frith K et coll. Food protein-induced enterocolitis syndrome in Australia: A population-based study, 2012-2014. J Allergy Clin Immunol 2017;140(5):1323-30. doi : 10.1016/j.jaci.2017.03.027.
- Alonso SB, Ezquiaga JG, Berzal PT et coll. Food protein-induced allergic enterocolitis syndrome: Increased prevalence of the great unknown—results of the PREVALE study. J Allergy Clin Immunol 2019;143(1):430-3. doi : 10.1016/j.jaci.2018.08.045.
- Katz Y, Goldberg MR, Rajuan N, Cohen A, Leshno M. The prevalence and natural course of food protein-induced enterocolitis syndrome to cow’s milk: A large-scale, prospective population-based study. J Allergy Clin Immunol 2011;127(3):647-53.e1-3. doi : 10.1016/j.jaci.2010.12.1105.
- Maciag MC, Bartnikas LM, Schirer SH et coll. A slice of food protein-induced enterocolitis syndrome (FPIES): Insights from 441 children with FPIES as provided by caregivers in the International FPIES Association. J Allergy Clin Immunol Pract 2020;8(5):1702-9. doi : 10.1016/j.jaip.2020.01.030.
- Barasche J, Stollar F, Bergmann MM, Caubet JC. Severely altered-consciousness status and profuse vomiting in infants: Food protein-induced enterocolitis syndrome (FPIES), a challenging diagnosis. Pediatr Emerg Care 2018;34(10):e187-9. doi : 10.1097/PEC.0000000000000921.
- Wakiguchi H, Hasegawa S, Kaneyasu H et coll. Long-lasting non-IgE-mediated gastrointestinal cow’s milk allergy in infants with Down syndrome. Pediatr Allergy Immunol 2015;26(8):821-3. doi : 10.1111/pai.12351.
- Kusters MAA, Verstegen RHJ, Gemen EFA, de Vries E. Intrinsic defect of the immune system in children with Down syndrome: A review. Clin Exp Immunol 2009;156(2):189-93. doi : 10.1111/j.1365-2249.2009.03890.x.
- Feuille E, Nowak-Węgrzyn. Food protein-induced enterocolitis syndrome, allergic proctocolitis, and enteropathy. Curr Allergy Asthma Rep 2015;15(8):50. doi : 10.1007/s11882-015-0546-9.
- Abrams EM, Hildebrand KJ, Chan ES. Non-IgE-mediated food allergy: Evaluation and management. Pediatr Child Health 2021;26(3):173-81. doi : 10.1093/pch/pxaa131.
- De Greef E, Hauser B, Devreker T, Veereman-Wauters G, Vandenplas Y. Diagnosis and management of cow’s milk protein allergy in infants. World J Pediatr 2012;8(1):19-24. doi : 10.1007/s12519-012-0332-x.
- Labrosse R, Graham F, Caubet JC. Non-IgE-mediated gastrointestinal food allergies in children: An update. Nutrients 2020;12(7):2086. doi : 10.3390/nu12072086.
- Saarinen KM, Pelkonen AS, Mäkelä MJ, Savilahti E. Clinical course and prognosis of cow’s milk allergy are dependent on milk-specific IgE status. J Allergy Clin Immunol 2005;116(4):869-75. doi : 10.1016/j.jaci.2005.06.018.
- Lake AM, Whitington PF, Hamilton SR. Dietary protein-induced colitis in breast-fed infants. J Pediatr 1982;101(6):906-10. doi : 10.1016/s0022-3476(82)80008-5.
- Lozinsky AC, de Morais MB. Eosinophilic colitis in infants. J Pediatr (Rio J) 2014;90(1):16-21. doi : 10.1016/j.jped.2013.03.024.
- Kuitunen P, Visakorpi JK, Savilahti E, Pelkonen P. Malabsorption syndrome with cow’s milk intolerance. Clinical findings and course in 54 cases. Arch Dis Child 1975;50(5):351-6. doi : 10.1136/adc.50.5.351.
- Iyngkaran N, Robinson MJ, Prathap K, Sumithran E, Yadav M. Cow’s milk protein-sensitive enteropathy. Combined clinical and histological criteria for diagnosis. Arch Dis Child 1978;53(1):20-6. doi : 10.1136/adc.53.1.20.
- Lake AM. Food-induced eosinophilic proctocolitis. J Pediatr Gastroenterol Nutr 2000;30 (Suppl):S58-60. doi : 10.1097/00005176-200001001-00009.
- Caubet JC, Ford LS, Sickles L et coll. Clinical features and resolution of food protein-induced enterocolitis syndrome: 10-year experience. J Allergy Clin Immunol 2014;34(2):382-9. doi : 10.1016/j.jaci.2014.04.008.
- Boyce JA, Assa’ad AN, Burks AW et coll. Guidelines for the diagnosis and management of food allergy in the United States: Summary of the NAIAD-sponsored expert panel report. J Allergy Clin Immunol 2010;126(6):1105-18. doi : 10.1016/j.jaci.2010.10.008.
- Tan J, Campbell D, Mehr S. Food protein-induced enterocolitis syndrome in an exclusively breast-fed infant – an uncommon entity. J Allergy Clin Immunol 2012;129(3):873-4. doi : 10.1016/j.jaci.2011.12.1000.
- Baldo F, Bevacqua M, Corrado D et coll. FPIES in exclusively breastfed infants: Two case reports and review of the literature. Ital J Pediatr 2020;46(1):144. doi : 10.1186/s13052-020-00910-8.
- Michelet M, Schluckebier D, Petit LM, Caubet JC. Food protein-induced enterocolitis syndrome – A review of the literature with focus on clinical management. J Asthma Allergy 2017:10:197-207. doi : 10.2147/JAA.S100379.
- Mehr S, Kakakios A, Frith K, Kemp AS. Food protein-induced enterocolitis syndrome: 16-year experience. Pediatrics 2009;123(3):e459-64. doi : 10.1542/peds.2008-2029.
- Levy Y, Danon YL. Food protein-induced enterocolitis syndrome – not only due to cow’s milk and soy. Pediatr Allergy Immunol 2003;14(4):325-9. doi : 10.1034/j.1399-3038.2003.00039.x.
- Wang KY, Lee J, Cianferoni A et coll. Food protein-induced enterocolitis syndrome food challenges: Experience from a large referral centre. J Allergy Clin Immunol Pract 2019;7(2):444-50. doi : 10.1016/j.jaip.2018.09.009.
- Mehr S, Kakakios AM, Kemp AS. Rice: A common and severe cause of food protein-induced enterocolitis syndrome. Arch Dis Child 2009;94(3):220-3. doi : 10.1136/adc.2008.145144.
- Katz Y, Goldberg MR. Natural history of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol 2014;14(3):229-39. doi : 10.1097/ACI.0000000000000053.
- Garcia MR, Jimenez Diaz F. Food protein-induced enterocolitis syndrome (FPIES): Our experience. J Allergy Clin Immunol 2012;129(2 Suppl):AB34.
- Nowak-Węgrzyn A, Katz Y, Mehr SS, Koletzko S. Non-IgE-mediated gastrointestinal food allergy. J Allergy Clin Immunol 2015;135(5):1114-24. doi : 10.1016/j.jaci.2015.03.025.
- Nowak-Węgrzyn A, Chehade M, Groetch ME et coll. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary—Workgroup report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol 2017;139(4):1111-26.e4. doi : 10.1016/j.jaci.2016.12.966.
- Feuille E, Menon NR, Huang F, Greenhawt M, Nowak-Węgrzyn A. Knowledge of food protein-induced enterocolitis syndrome among general pediatricians. J Allergy Clin Immunol 2017;119(3):291-2.e.3. doi : 10.1016/j.anai.2017.07.001.
- Nowak-Węgrzyn A, Sampson HA, Wood RA, Sicherer SH. Food protein-induced enterocolitis syndrome caused by solid food proteins. Pediatrics 2003;111(4 Pt 1):829-35. doi : 10.1542/peds.111.4.829.
- Banzato C, Piacentini GL, Comberiati P, Mazzei F, Boner AL, Peroni DG. Unusual shift from IgE-mediated milk allergy to food protein-induced enterocolitis syndrome. Eur Ann Allergy Clin Immunol 2013;45(6):209-11.
- Fiocchi A, Claps A, Dahdah L, Brindisi G, Dionisi-Vici C, Martelli A. Differential diagnosis of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol 2014;14(3):246-54. doi : 10.1097/ACI.0000000000000057.
- Sicherer SH, Eigenmann PA, Sampson HA. Clinical features of food protein-induced enterocolitis syndrome. J Pediatr 1998;133(2):214-9. doi : 10.1016/s0022-3476(98)70222-7.
- Cherian S, Varshney P. Food protein-induced enterocolitis syndrome (FPIES): Review of recent guidelines. Curr Allergy Asthma Rep 2018;18(4):28. doi : 10.1007/s11882-018-0767-9.
- Kelso JM. Unproven diagnostic tests for adverse reactions to foods. J Allergy Clin Immunol Pract 2018;6(2):362-5. doi : 10.1016/j.jaip.2017.08.021.
- Myszkowska D, Zapata B, Bulanda M, Czarnobilska E. Non-IgE mediated hypersensitivity to food products or food intolerance—Problems of appropriate diagnostics. Medicina (Kaunas) 2021;57(11):1245. doi : 10.3390/medicina57111245.
- American Academy of Pediatrics, comité de nutrition. Hypoallergenic infant formulas. Pediatrics 2000;106(2 Pt1):346-9.
- Høst A, Koletzko B, Dreborg S et coll. Dietary products used in infants for treatment and prevention of food allergy. Joint statement of the European Society for Paediatric Allergology and Clinical Immunology (ESPACI) Committee on Hypoallergenic Formulas and the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) Committee on Nutrition. Arch Dis Child 1999;81(1):80-4. doi : 10.1136/adc.81.1.80.
- Fenton MJ. Guidelines for the diagnosis and management of food allergy in the United States. Clin Transl Allergy 2011;1(S1):S10. doi :10.1186/2045-7022-1-S1-S10.
- Sampson HA, Aceves S, Bock SA et coll. Food allergy: A practice parameter update—2014. J Allergy Clin Immunol 2014;134(5):1016-25.e43. doi : 10.1016/j.jaci.2014.05.013.
- Dupont C, Chouraqui JP, de Boissieu D et coll. Dietary treatment of cows’ milk protein allergy in childhood: A commentary by the Committee on Nutrition of the French Society of Pediatrics. Br J Nutr 2012;107(3):325-38. doi : 10.1017/S0007114511004831.
- Koletzko S, Niggemann B, Arato A et coll. Diagnostic approach and management of cow’s-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr 2012;55(2):221-9. doi : 10.1097/MPG.0b013e31825c9482.
- Vandenplas Y, Koletzko S, Isolauri E et coll. Guidelines for the diagnosis and management of cow’s milk protein allergy in infants. Arch Dis Child 2007;92(10):902-8. doi : 10.1136/adc.2006.110999.
- De Boissieu D, Dupont C. Allergy to extensively hydrolyzed cow’s milk proteins in infants: Safety and duration of amino acid-based formula. J Pediatr 2002;141(2):271-3. doi : 10.1067/mpd.2002.126299.
- Host A, Halken S, Jacobsen HP, Christensen AE, Herskind AM, Plesner K. Clinical course of cow’s milk protein allergy/intolerance and atopic diseases in childhood. Pediatr Allergy Immunol 2002;13 (Suppl 15):23-8. doi : 10.1034/j.1399-3038.13.s.15.7.x.
- Camargo LS, Da Silveira JAC, Taddei JA, Neto UF. Allergic proctocolitis in infants: Analysis of the evolution of nutritional status. Arq Gastroenterol 2016;53(4):262-6. doi : 10.1590/S0004-28032016000400010.
- Restani P. Gaiaschi A, Plebani A et coll. Cross-reactivity between milk proteins from different animal species. Clin Exp Allergy 1999;29(7):997-1004. doi : 10.1046/j.1365-2222.1999.00563.x.
- Spuergin P, Walter M, Schiltz E, Deichmann K, Forster J, Mueller H. Allergenicity of alpha-caseins from cow, sheep, and goat. Allergy 1997;52(3):293-8. doi : 10.1111/j.1398-9995.1997.tb00993.x.
- Qamar S, Deshmukh M, Patole S. Probiotics for cow’s milk protein allergy: A systematic review of randomized controlled trials. Eur J Pediatr 2019;178(8): 1139-49. doi : 10.1007/s00431-019-03397-6.
- Kokkonen J, Haapalahti M, Laurila K, Karttunen TJ, Mäki M. Cow’s milk protein-sensitive enteropathy at school age. J Pediatr 2001;139(6):797-803. doi : 10.1067/mpd.2001.118882.
- Kokkonen J, Tikkanen S, Savilahti E. Residual intestinal disease after milk allergy in infancy. J Pediatr Gastroenterol Nutr 2001;32(2):156-61. doi : 10.1097/00005176-200102000-00012.
- Walker WA. Cow’s milk protein-sensitive enteropathy at school age: A new entity or a spectrum of mucosal immune responses with age. J Pediatr 2001;139(6):765-6. doi : 10.1067/mpd.2001.120265.
- Venter C, Groetch M. Nutritional management of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol 2014;14(3):255-62. doi : 10.1097/ACI.0000000000000054.
- Nowak-Węgrzyn A, Assa’ad AH, Bahna SL, Bock SA, Sicherer SH, Teuber SS. Work Group report: Oral food challenge testing. J Allergy Clin Immunol 2009;123(6 Suppl):S365-83. doi : 10.1016/j.jaci.2009.03.042.
- Caubet JC, Cianferoni A, Groetch M, Nowak-Węgrzyn A. Food protein-induced enterocolitis syndrome. Clin Exp Allergy 2019;49(9):1178-90. doi : 10.1111/cea.13415.
- Hill DJ, Murch SH, Rafferty K, Wallis P, Green CJ. The efficacy of amino acid-based formula in relieving the symptoms of cow’s milk allergy: A systematic review. Clin Exp Allergy 2007;37(6):808-22. doi : 10.1111/j.1365-2222.2007.02724.x.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.


