Point de pratique
Des approches pour dépister la tuberculose chez les enfants et les adolescents
Affichage : le 14 décembre 2018 | Reconduit : le 11 janvier 2024
Auteur(s) principal(aux)
Nicole Le Saux; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Mise à jour par : Michelle Barton MD, Ari Bitnun MD
Résumé
Le présent point de pratique vise à encadrer les examens à amorcer lorsqu’on soupçonne une infection à Mycobacterium tuberculosis chez les enfants. Le fardeau de la tuberculose est élevé dans certaines régions du Canada, les populations autochtones étant les plus à risque. La tuberculose peut se déclarer sous forme de maladie aiguë ou subaiguë, et l’infection primaire ou réactivée peut être responsable d’une maladie pulmonaire ou multisystémique. Les tests cutanés à la tuberculine et les tests de libération de l’interféron gamma peuvent confirmer un soupçon diagnostique, mais peuvent être négatifs dans 10 % à 30 % des cas de tuberculose. Il est possible d’éradiquer la tuberculose au Canada, mais pour ce faire, il faudra améliorer les déterminants sociaux de la santé, qui font partie des principaux facteurs de propagation de l’infection dans les populations à risque.
Mots-clés : fin du contact; infection tuberculeuse latente; Mycobacterium tuberculosis; tuberculose; vaccin bacille Calmette-Guérin
Le présent point de pratique explique quand soupçonner la tuberculose chez les enfants et les adolescents et comment amorcer les examens. Les directives à jour de la 8ᵉ édition des Normes canadiennes pour la lutte antituberculeuse, une analyse détaillée de l’épidémiologie et de la prise en charge de la tuberculose pédiatrique au Canada publiée en 2022, sont intégrées au présent document[1].
Il faut toujours envisager la tuberculose chez les enfants et les adolescents autochtones qui habitent ou ont habité dans des régions présentant des facteurs de risque (p. ex., maisons surpeuplées, mal ventilées, telles qu’on les observe dans de nombreuses communautés autochtones où la tuberculose est endémique depuis des décennies). La tuberculose devrait également être envisagée à la fois chez les enfants nés à l’étranger et de parents nés à l’étranger, s’ils proviennent d’un pays où le fardeau de la tuberculose est élevé (https://www.stoptb.org/resources/interactive-tb-data). L’incidence globale de la tuberculose au Canada entre 2010 et 2020 se situait entre 4,5 et 4,9 cas sur 100 000 habitants, mais a atteint un pic en 2021, à 251 cas sur 100 000 habitants. En 2019, l’incidence avait reculé à 188,7 cas sur 100 000 habitants, puis à 70 cas sur 100 000 habitants pendant la première année de la pandémie[1]-[3].
L’infection tuberculeuse latente (ITBL) signifie que la bactérie Mycobacterium tuberculosis (Mtb) est « en dormance », si bien que la personne infectée est asymptomatique et non contagieuse[4]. En revanche, la tuberculose active est indicatrice d’une réplication bactérienne, c’est-à-dire que la personne infectée est généralement symptomatique.
Le vaccin bacille Calmette-Guérin (BCG) est un vaccin vivant atténué généralement administré à la naissance aux nouveau-nés des régions sociosanitaires canadiennes où le taux de tuberculose à frottis positif est élevé[6]. Il est contre-indiqué pour les nouveau-nés qui présentent une histoire familiale d’immunodéficience ou chez qui on présume une immunodépression[6][7].
L’exposition à la tuberculose et l’infection par la tuberculose
L’exposition se produit souvent dans les maisons où les membres respirent l’air qui contient des gouttelettes aérosolisées de Mtb, provenant généralement des expectorations d’un adulte ou d’un adolescent (p. ex., parent, grand-parent, frère ou sœur). L’exposition peut également se produire pendant un événement sportif ou une rencontre communautaire, en milieu scolaire ou en milieu de garde.
Les cas sources atteints d’une maladie cavitaire sont hautement contagieux, et le risque de transmission est plus élevé lorsque les expectorations contiennent une forte densité de Mtb (lorsqu’on observe des bacilles dans le frottis d’expectoration)[8]⁻[14]. Au tableau 1 sont présentés certains faits saillants sur l’anamnèse et la signification clinique correspondante.
L’infection à Mycobacterium tuberculosis (Mtb)
La primo-infection est établie lorsque les bacilles Mtb sont inhalés et répliqués dans les alvéoles pulmonaires, où ils sont absorbés par les macrophages et provoquent la formation de granulomes et d’une lymphadénopathie hilaire médiastinale. Le foyer parenchymateux est appelé foyer de Ghon, alors que le complexe de Ghon inclut une lymphadénopathie hilaire adjacente. Cette infection initiale peut provoquer la propagation du Mtb à d’autres ganglions lymphatiques ou la transmission hématogène à d’autres organes. Au fil du temps, les granulomes peuvent se calcifier, mais le Mtb est susceptible de demeurer viable même s’il est en dormance [4].
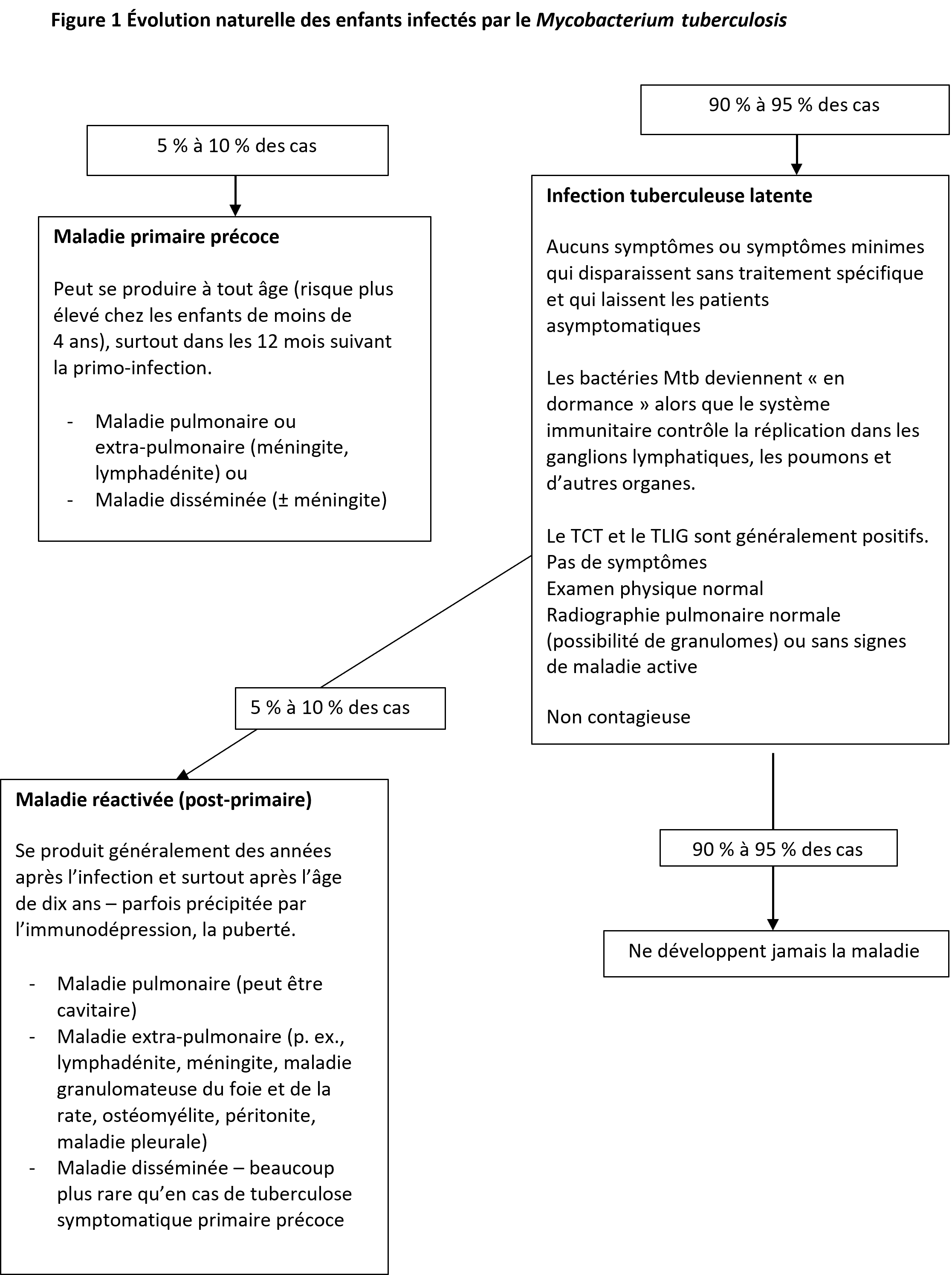
De 90 % à 95 % des enfants atteints d’une primo-infection à Mtb ont des symptômes minimes ou sont asymptomatiques. Ils ne développent pas de maladie clinique et sont porteurs de bactéries viables, mais en dormance. Cet état infectieux est généralement qualifié d’ITBL. À la figure 1 est décrite l’évolution naturelle des enfants infectés par le Mtb.
|
|
La tuberculose primaire précoce
De 5 % à 10 % des enfants infectés par le Mtb ont une maladie primaire pulmonaire ou extra-pulmonaire, et la majorité (un pourcentage estimatif de 90 %) présente des symptômes cliniques dans l’année suivant la primo-infection[15]. Les nourrissons et les enfants de moins de cinq ans sont particulièrement vulnérables.
Les manifestations pulmonaires
Les manifestations pulmonaires peuvent être aiguës et imiter celles de la pneumonie ou être indolentes et prendre la forme de sibliances ou de symptômes subaigus[15]. Pour poser un diagnostic, il faut obtenir à la fois des radiographies de profil et des radiographies postéro-antérieures, car la lymphadénopathie hilaire est souvent plus facile à visualiser de profil. D’ordinaire, les radiographies révèlent une pneumonite focale ou des opacités subtiles en « verre dépoli », généralement accompagnées d’une lymphadénopathie hilaire, médiastinale ou sous-carinaire [16]-[18]. La tomodensitométrie pulmonaire, avec ou sans contraste, est plus sensible et plus spécifique pour dépister la tuberculose pulmonaire, mais cette technique expose le patient à une radiation et même à une sédation [19]-[21].
La tuberculose disséminée ou extra-pulmonaire
Lorsque le système immunitaire ne parvient pas à contenir l’infection pulmonaire précoce, une maladie disséminée s’ensuit. Les nourrissons courent un risque particulièrement élevé [22].
Dans ce contexte, les symptômes constitutionnels peuvent être prédominants, y compris la perte de poids, une anorexie, une fièvre prolongée ou récurrente et la léthargie ou l’irritabilité. Les présentations syndromiques incluent la pneumonie, la méningite, les infections ostéoarticulaires ou un sepsis qui ne répond pas aux antibiotiques. De multiples organes peuvent être touchés, particulièrement le poumon, le cerveau, la rétine, le foie, la rate, la moelle osseuse et les muscles, ce qui complique le diagnostic. Des nodules miliaires ou un aspect « d’arbre en bourgeons » à la radiographie pulmonaire sont classiques, mais un aspect alvéolaire diffus ou un syndrome de détresse respiratoire aiguë peuvent également se manifester[16][17]. En cas de méningite, le liquide céphalorachidien révèle généralement une pléocytose avec prédominance lymphocytaire. L’imagerie par résonance magnétique peut être utile. Puisque la tuberculose néonatale (congénitale) est souvent disséminée, le diagnostic est souvent retardé lorsque la mère n’est pas diagnostiquée.
La réactivation de la tuberculose
On estime que chez 5 % à 10 % des enfants ayant une ITBL, l’infection en dormance finit par être réactivée et déclencher des signes et symptômes de la maladie. Autrement désignée maladie « post-primaire », la réactivation peut se manifester de nombreuses années après la primo-infection.
Même si la réactivation peut se déclarer chez des jeunes enfants en santé, elle est plus fréquente chez les adultes ou les adolescents. En plus de la probabilité de facteurs génétiques individuels, on constate d’autres facteurs de risque, y compris l’immunosuppression (p. ex., l’infection par le virus de l’immunodéficience humaine ou le diabète), la malnutrition ou les médicaments (particulièrement les stéroïdes ou les produits biologiques)[15][23]. Les enfants et les adolescents atteints d’une réactivation pulmonaire peuvent présenter des infiltrats ou une maladie cavitaire de type « adulte », souvent dans les zones pulmonaires apicales et supérieures. D’autres manifestations sont également possibles : pleurésie tuberculeuse, lymphadénite, lésions tuberculeuses du système nerveux central, abcès hépatiques ou spléniques, infections ostéoarticulaires et (dans une moindre mesure) maladie disséminée.
Les tests de laboratoire
Lorsqu’on soupçonne une tuberculose sur le plan clinique, il est essentiel d’effectuer des cultures. Celles-ci permettent de poser un diagnostic définitif, de vérifier la résistance aux médicaments et de relier des cas par empreinte moléculaire.
Les prélèvements pour la microbiologie
L’inhalation d’une solution saline hypertonique peut provoquer la production d’expectorations. Chez les enfants incapables d’expectorer, il est possible de prélever des aspirats gastriques à jeun trois matins consécutifs pour les utiliser en culture[18][24]. Le site Web du Curry International Tuberculosis Centre décrit la marche à suivre, en anglais (www.currytbcenter.ucsf.edu/products/pediatric-tuberculosis-guide-gastric-aspirate-procedure). Une bronchoscopie pourrait être nécessaire pour obtenir des prélèvements.
Les prélèvements de liquide ou de tissu appropriés doivent être envoyés en laboratoire dans des contenants stériles (sans formaline) pour la coloration ou la culture des bacilles acido-alcoolo-résistants et peut-être un test d’amplification de l’acide nucléique. Les écouvillons ne sont pas des échantillons appropriés. Les tests peuvent être transférés à des laboratoires accrédités, dont les protocoles varient[25]. Puisque la qualité des échantillons est variable, un résultat négatif de frottis ou de culture n’exclut pas un diagnostic de tuberculose s’il est compatible sur le plan clinique.
Tous les patients atteints de la tuberculose doivent subir une sérologie du virus de l’immununodéficience humaine.
Le test cutané à la tuberculine et le test de libération de l’interféron gamma
La tuberculine est un dérivé protéinique purifié du Mtb inactivé par la chaleur. Lorsqu’elle est injectée par voie intradermique dans le cadre d’un test cutané à la tuberculine (TCT), une réaction d’hypersensibilité de type IV (urticaire) se produit si le receveur a été infecté par le Mtb ou s’il est porteur d’antigènes à réaction croisée venant de mycobactéries non tuberculeuses ou du vaccin BCG[26][27]. Les seuils d’induration du TCT indicateurs d’une éventuelle infection sont exposés dans les Normes canadiennes pour la lutte antituberculeuse, mais en général, ils sont d’au moins 5 mm pour les personnes immunodéprimées et pour les contacts des cas, et d’au moins 10 mm pour les autres. Seulement 1 % des personnes qui ont reçu le vaccin BCG à la naissance ou peu de temps après présenteront un TCT de 10 cm ou plus après l’âge de dix ans. Ainsi, un TCT de cette dimension ne devrait généralement pas être attribué à un ancien vaccin BCG[28]. Les nourrissons ou les jeunes enfants chez qui on soupçonne une tuberculose active peuvent même présenter une induration de 0 mm ou de moins de 5 mm.
Les tests de libération de l’interféron gamma (TLIG) QuantiFERON-TB Gold In-Tube et T-Spot.TB sont des essais sanguins in vitro qui évaluent la réponse immunitaire en mesurant l’interféron gamma que libèrent les lymphocytes T en réponse aux antigènes spécifiques du Mtb. Lors de ces tests, les antigènes du BCG n’entraînent pas de réaction croisée, et la réactivité aux mycobactéries non tuberculeuses est minime. Ainsi, la spécificité est supérieure à 95 %, par rapport à 60 % pour le TCT[29].
Le TLIG et le TCT peuvent tous deux donner des résultats faussement négatifs en cas d’immunosuppression. Ils peuvent aussi être négatifs chez 10 % à 30 % enfants atteints de tuberculose, surtout en cas de maladie milaire, mais le TLIG peut également donner un résultat faussement positif après un récent TCT[29]. Aucun des deux tests ne distingue l’ITBL de la tuberculose active, car dans les deux situations, l’enfant ou l’adolescent est infecté [26][27]. Chez les enfants de deux ans et plus, on croyait que le TCT et le TLIG avaient la même sensibilité et la même spécificité pour diagnostiquer l’ITBL. Cependant, le TLIG est plus spécifique que le TCT, particulièrement chez les personnes qui ont reçu le vaccin BCG, ce qui limite la nécessité d’effectuer d’autres tests et d’amorcer un traitement si le TLIG est négatif. Peu d’études portent sur les enfants de moins de deux ans, mais le TCT est probablement plus sensible que le TLIG. Puisque la maladie risque davantage d’évoluer dans ce groupe, le TCT, qui est plus sensible, est recommandé de préférence au TLIG. Il est toutefois essentiel de faire preuve de jugement clinique dans chaque situation[27][30]. Les autorités provinciales et territoriales en matière de santé paient ou non le TLIG, en fonction des indications.
Les répercussions pour la santé publique
L’incidence élevée de tuberculose dans les populations autochtones du Canada est un grave problème de santé publique. Il est capital de tenir compte des déterminants sociaux actuels et passés pour offrir des soins de qualité et adaptés à la culture et pour aborder la tuberculose dans une perspective politique.
Il est important d’administrer rapidement une prophylaxie aux enfants et aux adultes atteints d’une ITBL pour éviter la progression vers la tuberculose active et la transmission subséquente de Mtb. Les examens et le traitement subséquent des contacts symptomatiques de cas de tuberculose doivent être effectués rapidement pour limiter la transmission. La tuberculose active doit être déclarée aux autorités sanitaires locales dans les 48 heures suivant le diagnostic afin d’en prévenir la transmission. En général, lorsque le frottis des sécrétions respiratoires d’un cas de référence est positif, la personne atteinte est isolée à l’hôpital ou à la maison jusqu’à ce que trois frottis d’expectoration soient négatifs ou, si les premiers frottis sont négatifs, après l’administration d’un traitement observé directement pendant deux semaines.
Lorsque le cas de référence est un enfant atteint d’une maladie primaire, la recherche des contacts consiste d’abord et avant tout à dépister le cas source, qui est généralement un adulte ou un adolescent, car d’ordinaire, les jeunes enfants atteints d’une maladie primaire ne sont pas contagieux[31].
Lorsqu’un enfant ou un adolescent est considéré comme contact d’un cas de référence, il est essentiel d’effectuer une anamnèse et un examen physique, de demander une radiographie pulmonaire et de procéder à un TCT initial. Il faut également obtenir les sensibilités pharmacologiques du cas de référence. Les contacts de moins de cinq ans dont le TCT initial est inférieur à 5 mm doivent recevoir une prophylaxie préventive (ou transitoire) à l’aide d’un médicament considéré comme efficace pour traiter la souche du cas source. Un deuxième TCT est effectué de huit à dix semaines après le dernier contact (parfois appelé « fin du contact »), alors que le cas de référence était encore contagieux. Un enfant de cinq ans ou plus dont le TCT initial est inférieur à 5 mm doit subir un TCT de huit à dix semaines après la fin du contact, même si la prophylaxie transitoire n’est pas recommandée dans ce groupe d’âge.
Chez les contacts de moins de cinq ans dont le TCT est inférieur à 5 mm de huit à dix semaines après la fin du contact, on peut cesser la prophylaxie transitoire. Ceux de cinq ans ou plus qui ne présentent pas de symptômes et dont l’examen physique et la radiographie pulmonaire semblent normaux, mais dont le TCT initial ou le TCT après la fin du contact est de 5 mm ou plus, doivent être traités pour une infection latente[28][32]⁻[34].
Le traitement
Pour éviter une réactivation, les personnes atteintes d’une ITBL reçoivent généralement un traitement à l’isoniazide, à la rifampine ou à la rifapentine-isoniazide, en collaboration avec les autorités locales de santé publique[32]⁻[35]. Lorsque les patients sont atteints d’une tuberculose active, on entreprend généralement une quadrithérapie, conformément aux Normes canadiennes pour la lutte antituberculeuse et en consultation avec des infectiologues ou des pneumologues[36][37].
Addenda
Le Redbook 2024 de l’American Academy of Pediatrics recommande d’utiliser soit un test de libération de l’interféron gamma (TLIG), soit un test cutané à la tuberculine (TCT) pour dépister la tuberculose chez tous les enfants, même ceux de moins de deux ans. Cette recommandation repose sur les données disponibles, selon lesquelles les résultats des TLIG sont aussi bons chez les enfants de moins de deux ans que chez ceux de deux ans et plus. Cependant, les deux tests doivent être effectués chez les nourrissons atteints de tuberculose congénitale, à cause de leur faible sensibilité dans cette population. Lorsqu’on soupçonne une tuberculose congénitale chez les jeunes nourrissons atteints d’un sepsis ou d’une pneumonie réfractaire aux antibiotiques (p. ex., dont la mère présente des facteurs de risque de tuberculose ou est atteinte d’une tuberculose génitale connue), le TLIG et le TCT doivent tous deux être effectués pour accroître la sensibilité [38].
Remerciements
Le comité de la pédiatrie communautaire, le comité de la santé des Premières Nations, des Inuits et des Métis et le groupe de travail des enfants néo-canadiens de la Société canadienne de pédiatrie ont révisé le présent point de pratique. L’auteure remercie également le docteur Ian Kitai, spécialiste de la tuberculose au sein de la division d’infectiologie du Hospital for Sick Children de Toronto, en Ontario.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SCP
Membres : Michelle Barton-Forbes MD; Sean Bitnun MD; Natalie A. Bridger MD; Shalini Desai MD (membre sortante); Michael Forrester MD (membre résident); Ruth Grimes MD (représentante du conseil); Nicole Le Saux MD (présidente); Otto G. Vanderkooi MD
Représentants : Upton D. Allen MBBS, Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida chez les enfants; Tobey Audcent MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Carrie Byington MD, comité des maladies infectieuses, American Academy of Pediatrics; Fahamia Koudra MD, Le Collège des médecins de famille du Canada; Marc Lebel MD, Programme canadien de surveillance active de l’immunisation (IMPACT); Jane McDonald MD, Association pour la microbiologie médicale et l’infectiologie Canada; Dorothy L. Moore MD, Comité consultatif national de l’immunisation; Howard Njoo MD, Agence de la santé publique du Canada
Conseillère : Noni E. MacDonald MD
Auteure principale: Nicole Le Saux MD
Mise à jour : Michelle Barton MD, Ari Bitnun MD
Références
- Dwilow R, Hui C, Kakkar F, Kitai I. Chapter 9: Pediatric Tuberculosis. Can J Resp Crit Care Sleep Med 2022;6(Suppl 1):129-48. doi: 24745332.2022.2043055
- Kitai I, Morris SK, Kordy F, Lam R. Diagnosis and management of pediatric tuberculosis in Canada. CMAJ 2017;189(1):E11–6.
- Mounchilia A, Pereraa R, Leeb RS, Njooa H, Brooks J. Chapter 1: The epidemiology of Tuberculosis in Canada; Canadian Tuberculosis Standards, 8th edition. Can J Resp Crit Care Sleep Med. 2022;6(Suppl 1):8-21.
- Getahun H, Matteelli A, Chaisson RE, Raviglione M. Latent Mycobacterium tuberculosis infection. N Engl J Med 2015;37(22)2:2127–35.
- Fletcher HA. Sleeping Beauty and the story of the Bacille Calmette-Guérin vaccine. MBio 2016;7(4):pii;e01370-16.
- Venkataraman A, Yusuff M, Liebeschuetz S, Riddell A, Prendergast AJ. Management and outcome of Bacille Calmette-Guérin vaccine adverse reactions. Vaccine 2015;33(41):5470–4.
- Marciano BE, Huang CY, Joshi G et coll. BCG vaccination in patients with severe combined immunodeficiency: Complications, risks, and vaccination policies. J Allergy Clin Immunol 2014;133(4):1134–41.
- Jones-López EC, Namugga O, Mumbowa F et coll. Cough aerosols of Mycobacterium tuberculosis predict new infection: A household contact study. Am J Respir Crit Care Med 2013;187(9):1007–15.
- Adam HJ, Guthrie JL, Bolotin S et coll. Genotypic characterization of tuberculosis transmission within Toronto’s under-housed population, 1997-2008. Int J Tuberc Lung Dis 2010;14(10):1350–3.
- Logan JJ, Jolly AM, Blanford JI. The sociospatial network: Risk and the role of place in the transmission of infectious diseases. PLoS One 2016;11(2):e0146915.
- Rossi C, Zwerling A, Thibert L et coll. Mycobacterium tuberculosis transmission over an 11-year period in a low-incidence, urban setting. Int J Tuberc Lung Dis 2012;16(3):312–8.
- Yeo IK, Tannenbaum T, Scott AN et coll. Contact investigation and genotyping to identify tuberculosis transmission to children. Pediatr Infect Dis J 2006;25(11):1037–43.
- Patterson B, Morrow CD, Kohls D, Deignan C, Ginsburg S, Wood R. Mapping sites of high TB transmission risk: Integrating the shared air and social behaviour of TB cases and adolescents in a South African township. Sci Total Environ 2017;583:97–103.
- Singh M, Mynak ML, Kumar L, Mathew JL, Jindal SK. Prevalence and risk factors for transmission of infection among children in household contact with adults having pulmonary tuberculosis. Arch Dis Child 2005;90(6):624–8.
- Perez-Velez CM, Marais BJ. Tuberculosis in children. N Engl J Med 2012;367(4):348–61.
- Hashemian SM, Tabarsi P, Karam MB et coll. Radiologic manifestations of pulmonary tuberculosis in patients of intensive care units. Int J Mycobacteriol 2015;4(3):233–8.
- Nachiappan AC, Rahbar K, Shi X et coll. Pulmonary tuberculosis: Role of radiology in diagnosis and management. Radiographics 2017;37(1):52–72.
- Lewinsohn DM, Leonard MK, LoBue PA et coll. Official American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention clinical practice guidelines: Diagnosis of tuberculosis in adults and children. Clin Infect Dis 2017;64(2):111–5.
- Swaminathan S, Raghavan A, Datta M, Paramasivan CN, Saravanan KC. Computerized tomography detects pulmonary lesions in children with normal radiographs diagnosed to have tuberculosis. Indian Pediatr 2005;42(3):258–61.
- Golub JE, Bur S, Cronin WA et coll. Delayed tuberculosis diagnosis and tuberculosis transmission. Int J Tuberc Lung Dis 2006;10(1):24–30.
- eedu PT, Bhalla AS, Vishnubhatla S et coll. Pediatric vs adult pulmonary tuberculosis: A retrospective computed tomography study. World J Clin Pediatr 2013;2(4):70–6.
- Marais BJ, Gie RP, Schaaf HS et coll. The natural history of childhood intra-thoracic tuberculosis: A critical review of literature from the pre-chemotherapy era. Int J Tuberc Lung Dis 2004;8(4):392–402.
- Salgame P, Geadas C, Collins L, Jones-López E, Ellner JJ. Latent tuberculosis infection—Revisiting and revising concepts. Tuberculosis (Édimb) 2015;95(4):373–84.
- Hatherill M, Hawkridge T, Zar HJ et coll. Induced sputum or gastric lavage for community-based diagnosis of childhood pulmonary tuberculosis? Arch Dis Child 2009;94(3):195–201.
- Pai M, Minion J, Jamieson F, Wolfe J, Behr M. Le diagnostic de la tuberculose active et de la pharmacorésistance. https://www.canada.ca/fr/sante-publique/services/maladies-infectieuses/normes-canadiennes-lutte-antituberculeuse-7e-edition/edition-22.html (consulté le 4 décembre 2017).
- Laurenti P, Raponi M, de Waure C, Marino M, Ricciardi W, Damiani G. Performance of interferon-ƴ release assays in the diagnosis of confirmed active tuberculosis in immunocompetent children: A new systematic review and meta-analysis. BMC Infect Dis 2016;16:131.
- Lowenthal P, Barry PM, Flood J. High discordance between pre-US and post-US entry tuberculosis test results among immigrant children. Is it time to adopt interferon gamma release assay for preentry tuberculosis screening? Ped Inf Dis J 2016;35(3):231-6.
- Pai M, Kunimoto D, Jaimieson F, Menzies D. Le diagnostic de l’infection tuberculeuse latente. https://manuals.cts-sct.ca/documentation/preface/?lang=fr (consulté le 4 décembre 2017).
- Pai M, Denkinger CM, Kik SV et coll. Gamma interferon release assays for detection of Mycobacterium tuberculosis infection. Clin Microbiol Rev 2014;27(1):3–20.
- Yun KW, Kim YK, Kim HR, Lee MK, Lim IS. Usefulness of interferon- ƴ release assay for the diagnosis of latent tuberculosis infection in young children. Korean J Pediatr 2016;59(6):256–61.
- Rea E, Rivest P. Le suivi des contacts et la gestion des éclosions dans le cadre de la lutte antituberculeuse. https://manuals.cts-sct.ca/documentation/preface/?lang=fr (consulté le 4 décembre 2017).
- Diallo T, Adjobimey M, Ruslami R et coll. Safety and side effects of rifampin versus isoniazid in children. N Engl J Med 2018;379(5):454–63.
- Menzies D, Adjobimey M, Ruslami R et coll. Four months of rifampin or nine months of isoniazid for latent tuberculosis in adults. N Engl J Med 2018;379(5):440–53.
- Sterling TR, Villarino ME, Borisov AS et coll. Three months of rifapentine and isoniazid for latent tuberculosis infection. N Engl J Med 2011;365(23):2155–66.
- Menzies D, Alvarez GG, Khan K. Le traitement de l’infection tuberculeuse latente. https://manuals.cts-sct.ca/documentation/preface/?lang=fr (consulté le 4 décembre 2017).
- Kitai I, Demers A. La tuberculose de l’enfant. https://manuals.cts-sct.ca/documentation/preface/?lang=fr (consulté le 4 décembre 2017).
- Menzies D, Elwood K. Le traitement de la tuberculose active. https://manuals.cts-sct.ca/documentation/preface/?lang=fr (consulté le 4 décembre 2017).
- American Academy of Pediatrics. Tuberculosis. In: Kimberlin DW, Banerjee R, Barnett ED, Lynfield R, Sawyer MH, eds. Red Book: 2024 Report of the Committee on Infectious Diseases. Itasca, IL: AAP; 2024.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.