Document de principes

La prise en charge de l’otite moyenne aiguë chez les enfants de six mois et plus
Affichage : le 5 février 2016 | Reconduit : le 1 juin 2022
Auteur(s) principal(aux)
Nicole Le Saux, Joan L Robinson; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Paediatr Child Health 2016;21(1):45-50
Résumé
L’otite moyenne aiguë (OMA) continue d’être une infection courante chez les jeunes enfants. Les maladies plus bénignes, qui sont généralement causées par des bactéries ou des virus moins virulents, guérissent tout aussi rapidement avec ou sans la prise d’antibiotiques. Un tympan bombé, particulièrement s’il est jaunâtre ou hémorragique, est un signe très sensible d’OMA d’origine bactérienne et un critère diagnostique important d’OMA. La perforation du tympan accompagnée d’un écoulement purulent est également indicatrice d’une cause bactérienne. Une antibiothérapie immédiate est recommandée pour les enfants qui font une forte fièvre (39 °C ou plus), qui présentent des signes systémiques modérés ou majeurs, qui souffrent d’otalgie importante ou qui sont très malades depuis 48 heures. Dans tous les autres cas, les parents peuvent recevoir une prescription d’antibiotiques qu’ils pourront faire remplir si l’état de l’enfant ne s’améliore pas dans les 48 heures. Dans une telle situation, on peut également réévaluer l’enfant. De toute évidence, l’amoxicilline demeure le médicament de choix. Un traitement de dix jours convient pour les enfants de moins de deux ans, tandis que cinq jours suffisent pour les enfants plus âgés.
Le présent document de principes remplace celui qui a été publié par la Société canadienne de pédiatrie (SCP) en 2009.[1] D’après les données probantes publiées, la présente révision vise à orienter une prise de décision clinique éclairée. Les recommandations ne sont pas destinées au traitement des nourrissons de moins de six mois ou de ceux qui présentent une anomalie craniofaciale ou un trouble immunodépressif, qui se sont fait poser des drains transtympaniques ou qui contractent des otites moyennes aiguës (OMA) récurrentes.
La pathogenèse de l’OMA
L’OMA est très fréquente, et 75 % de tous les enfants souffrent d’au moins une otite avant de commencer à aller à l’école.[2] En temps normal, les mécanismes de clairance mucociliaire des trompes d’Eustache (TE) ventilent l’oreille moyenne et en drainent le liquide. La dysfonction ou l’obstruction des TE, causée par une infection virale ou d’autres inflammations des muqueuses, peut nuire à ce mécanisme normal. Le liquide qui s’accumule dans l’oreille moyenne non drainée peut entraîner une OMA s’il est colonisé par des agents pathogènes bactériens ou viraux. Les enfants sont prédisposés à l’OMA parce qu’ils contractent plus d’infections virales que les adultes et parce que leurs TE, plus courtes, sont situées dans un plan plus horizontal que celles des adultes.[3][4]
Les facteurs de risque d’OMA incluent un jeune âge et des contacts fréquents avec d’autres enfants, ce qui accroît l’exposition à des maladies virales. Parmi les autres facteurs de risque, soulignons les anomalies orofaciales (telles qu’une fente labiopalatine), l’entassement dans les ménages, l’exposition à la fumée de cigarette, l’utilisation de la sucette, un allaitement de courte durée, l’utilisation prolongée du biberon en position couchée et des antécédents familiaux d’otite moyenne. Les enfants inuits ou des Premières nations sont également plus vulnérables à l’OMA.[5][6] Une petite proportion d’enfants présente un plus faible taux d’immunoglobuline A sécrétoire ou des biofilms persistants dans l’oreille moyenne, ce qui peut contribuer à accroître le risque d’OMA récurrentes.[7]-[9]
Un spectre clinique d’infections de l’oreille moyenne s’associe à l’apparition ou à la progression de l’infection vers une OMA bactérienne. En cas d’OMA, le liquide contenu dans l’oreille moyenne renferme souvent à la fois des virus et des bactéries, mais les enfants chez qui l’OMA est spontanément résolutive sont plus susceptibles d’avoir une simple infection virale ou d’héberger des organismes bactériens moins virulents (p. ex., le Moraxella catarrhalis et certaines souches d’Haemophilus influenzae) que le Streptococcus pneumoniae et le Streptococcus pyogenes (streptocoque du groupe A [SGA]).[10] Dans une étude prospective, 22 % des enfants âgés de six mois à trois ans contractaient une OMA dans la semaine suivant l’apparition d’une infection des voies respiratoires supérieures, tandis que 7 % d’autres souffraient d’une myringite sans épanchement.[11] Ainsi, la présentation clinique de l’OMA peut varier en fonction du stade de la maladie (précoce ou plus avancée). De plus, une OMA bactérienne manifeste peut finir par faire son apparition selon les virus ou les bactéries présents dans le nasopharynx.[12]
Les bactéries fréquentes en cas d’OMA
Les principales bactéries responsables de l’OMA sont le S pneumoniae, l’H influenzae, le M catarrhalis et, dans une moindre mesure, le SGA. En général, un seul agent pathogène bactérien est responsable de la maladie, mais des co-infections sont possibles. Les études sur l’administration systématique du vaccin conjugué septavalent contre le pneumocoque (Pneu-C-7) ont démontré l’importance croissante du S pneumoniae de souches non vaccinales et de l’H influenzae de souches non typables.[13] Cependant, selon des études plus récentes réalisées depuis que le vaccin 13-valent contre le pneumocoque (Pneu-C-13) est utilisé, le taux global de portage du S pneumoniae a diminué.[14] On ne sait pas encore si le nombre absolu ou seul le pourcentage de cas d’OMA causés par l’H influenzae et le M catarrhalis augmentera après la systématisation de l’utilisation du vaccin Pneu-C-13.
Au Canada, on estime que l’utilisation systématique du Pneu-C-7 a réduit de 13 % à 19 % l’incidence d’OMA grâce à la réduction marquée de la colonisation nasopharyngée par le S pneumoniae de souche vaccinale chez les enfants.[15][16] Selon une étude récente, les cas d’OMA (et peut-être les épisodes les plus graves) causés par le S pneumoniae sont moins fréquents depuis l’adoption du Pneu-C-13 en 2011, particulièrement chez les nourrissons de moins de deux ans.[17] D’après une autre étude récente menée en Israël, les OMA attribuables aux sérotypes du Pneu-C-13 ont reculé de 85 % depuis l’adoption universelle du vaccin Pneu-C-13, ce qui correspond à une diminution globale de 77 % des OMA d’origine pneumococcique entre l’année d’homologation du vaccin Pneu-C-7 et maintenant (après l’adoption du vaccin Pneu-C-13).[18]
Pourquoi est-il essentiel de poser un diagnostic précis d’OMA?
Le diagnostic d’OMA est le pilier de la prise en charge, mais il est souvent très difficile à poser en clinique. L’utilisation d’antimicrobiens pour traiter une OMA virale, une OMA causée par des bactéries peu virulentes (toutes deux plus susceptibles d’être spontanément résolutives) ou une otite moyenne avec épanchement (OME) sans OMA, provoque des effets secondaires inutiles qui peuvent être nuisibles et contribue à la colonisation par des bactéries résistantes aux antimicrobiens. Des études plus anciennes sur le traitement de l’OMA ne faisaient pas appel à des critères diagnostiques rigoureux et pouvaient inclure de nombreux enfants atteints d’OMA bénigne, ce qui diluait l’effet thérapeutique des antibiotiques.[19] Dans certains cas, il est démontré que l’incapacité d’éradiquer les bactéries responsables de l’OMA accroissait le risque de rechute.[20] Il est donc essentiel de déterminer quels enfants devront recevoir des antimicrobiens pour guérir plus rapidement de l’OMA.[21][22]
Les symptômes
Les symptômes ne sont pas spécifiques et, pris isolément, ils ne suffisent pas à poser un diagnostic d’OMA. Les symptômes systémiques, tels que les problèmes de sommeil ou le manque d’entrain, l’irritabilité et la fièvre, sont courants en cas d’infection virale des voies respiratoires (p. ex., infections par l’influenza et par le virus respiratoire syncytial), même en l’absence d’OMA.[23] Des symptômes comme le fait de se tirer l’oreille ou les maux d’oreille (otalgie), même s’ils sont souvent utiles chez les enfants qui savent parler, peuvent également être révélateurs d’une myringite causée par une infection virale ou une dysfonction des TE responsable d’une diminution de l’audition. Il faut distinguer le symptôme d’otalgie de la douleur du canal auriculaire causée par l’otite externe (douleur causée par le mouvement du tragus et l’inflammation du conduit auditif, généralement sans autres symptômes systémiques). Il est également important de déterminer l’évolution, la gravité et la durée de la maladie, car un enfant dont l’état se détériore ou qui est gravement malade est plus susceptible de présenter un processus bactérien qui ne sera pas spontanément résolutif.
La détermination et la caractérisation d’un épanchement dans l’oreille moyenne
Le recours aux seuls symptômes non spécifiques pour diagnostiquer l’OMA entraînera non seulement bien des surdiagnostics, mais également des sous-diagnostics chez les patients dont les symptômes non spécifiques ne touchent pas l’oreille moyenne.[24] L’utilisation d’un otoscope doté d’une source de lumière vive (il faut remplacer l’ampoule de l’otoscope chaque année) et du plus gros spéculum qui loge dans l’oreille de l’enfant facilite la visualisation et l’utilisation de critères validés pour diagnostiquer l’OMA.
La présence d’un épanchement dans l’oreille moyenne (EOM) est un critère diagnostique minimal essentiel de l’OMA. Cet épanchement est présent lorsque le tympan est peu mobile ou n’est pas mobile à l’application d’une pression positive ou négative à l’aide d’un otoscope pneumatique. La diminution marquée de la mobilité du tympan (visualisée à l’otoscope pneumatique) est un critère sensible et spécifique d’EOM. Il faut de la pratique pour bien utiliser l’otoscope pneumatique, mais cette technique utile n’est malheureusement pas maîtrisée par tous les cliniciens de première ligne. La tympanométrie automatique n’est pas fiable chez les nourrissons de moins de sept mois, et dans les autres groupes d’âge, sa sensibilité et sa spécificité dépendent d’une bonne utilisation et d’une bonne interprétation. Ainsi, il faut corréler l’information obtenue à l’aide de cet appareil à d’autres observations.[25][26] Les autres signes d’EOM incluent la perte des repères osseux ou le niveau hydroaérique. La position et la forme du tympan peuvent être neutres, rétractées ou bombées, selon l’inflammation et la chronicité. En temps normal, le tympan est grisâtre, mais il peut rougir à cause des pleurs ou de l’infection. Il est essentiel d’examiner et d’évaluer tant la couleur que la position du tympan, qui sont indispensables au diagnostic d’inflammation de l’oreille moyenne.
Les critères diagnostiques d’OMA
L’OMA se caractérise par l’apparition aiguë des symptômes (p. ex., otalgie ou otalgie présumée), la présence d’un EOM et une inflammation importante de l’oreille moyenne. Il faut la distinguer de l’OME, qui se caractérise également par la présence d’un EOM. Cependant, contrairement à l’OMA, l’OME ne s’accompagne pas d’une inflammation de l’oreille moyenne.
Comme dans tout processus clinique, on observe un continuum dans la gravité de la présentation. D’après une étude auprès de nourrissons de moins d’un an, 27 % des cas d’infection des voies respiratoires supérieures symptomatiques entraînaient une OMA.[27] Dans une autre étude portant sur des enfants atteints d’une infection des voies respiratoires supérieures depuis moins d’une semaine, 6 % souffraient d’une légère inflammation, 59 %, d’une inflammation modérée, et 35 %, d’une inflammation grave du tympan. Dans 28 cas atteints d’une OMA bénigne chez qui l’attente vigilante avait été privilégiée, l’état de quatre enfants s’est aggravé, et trois ont dû se soumettre à une antibiothérapie.[11] Selon une autre étude auprès d’enfants atteints d’une OMA sans gravité, les deux tiers des cas semblaient guérir sans antibiotiques, bien que plus lentement que ceux qui avaient reçu des antimicrobiens.[28] Ces données appuient la perception selon laquelle certains enfants infectés par des agents pathogènes viraux et bactériens peuvent contracter une simple OMA légère et guérir spontanément.
De nombreuses études ont cherché à corréler l’apparence du tympan avec la présence d’agents pathogènes bactériens.[29]-[31] Dans une étude réalisée en Finlande,[29] la diminution de la mobilité du tympan était l’élément prédictif le plus sensible et le plus spécifique d’EOM associé à l’OMA (95 % et 85 %, respectivement). Un bombement du tympan avait une haute spécificité (plus de 97 %), mais une sensibilité plus faible de 51 %, tandis qu’un tympan opaque présentait également une spécificité élevée (93 %) et une bonne sensibilité (74 %) à la présence d’EOM et de symptômes cliniques d’OMA. Selon d’autres études, un bombement du tympan s’associait également à une plus forte spécificité à la présence de S pneumoniae et d’autres bactéries, quelle que soit la présence des virus, et à une maladie plus grave.[10][29] Outre le bombement du tympan, un agent pathogène bactérien était mis en culture dans 80 % des cas de tympan jaunâtre.[30] À; l’aide d’un échantillon de commodité de 264 enfants malades qui avaient consulté en soins de première ligne à cause de symptômes classiques d’OMA, des otoscopistes d’expérience ont voulu déterminer et valider le signe le plus prédictif d’OMA. Ils ont conclu que tous les enfants qui avaient un tympan bombé et seulement 8 % de ceux dont le tympan n’était pas bombé étaient atteints d’une OMA, ce qui fait du bombement le principal critère dia-gnostique.[32] D’autres caractéristiques, telles que les plaques hémorragiques ou le tympan érythémateux, ralliaient peu les observateurs, tandis que l’érythème, l’opacité ou un simple niveau hydroaérique, sans bombement du tympan, avaient une mauvaise valeur prédictive.[29][32] Ainsi, le bombement du tympan est un indicateur très sensible et très spécifique d’inflammation aiguë évocatrice d’une OMA.
De même, en cas d’OMA, une perforation aiguë associée à un écoulement purulent (otorrhée) est fortement indicatrice d’une cause bactérienne. Bien que le S pneumoniae soit la principale cause d’OMA, plusieurs études ont isolé le S pyogenes chez un plus fort pourcentage de patients qui avaient des perforations spontanées que chez ceux dont le tympan demeurait intact.[33] Fait important, l’écoulement associé aux symptômes aigus d’OMA et à la perforation tympanique doit toujours être distingué de l’otite externe, de l’écoulement chronique de l’oreille découlant d’une perforation antérieure (sans inflammation de l’oreille moyenne) ou de l’écoulement associé aux drains transtympaniques, car la prise en charge de ces affections est très différente.
Les caractéristiques cliniques qui ne sont pas évocatrices d’une OMA sont un tympan à la mobilité normale ou légèrement réduite, ou un tympan non bombé ou sans érythème ni opacité. Un simple niveau hydroaérique, sans bombement du tympan, n’est pas prédictif de l’OMA.
Une excellente vidéo de la technique d’otoscopie et des critères diagnostiques de l’otite moyenne figure, en anglais, dans le site www.nejm.org/doi/full/10.1056/NEJMvcm0904397.[34]
L’OMA bactérienne complexe à la présentation
Dans de très rares cas, à la présentation initiale de l’OMA, l’infection a déjà atteint les structures adjacentes.[35] Dans certaines situations, d’autres signes ou symptômes connexes prédominent. Il faut administrer des antimicrobiens systémiques à tous les patients dont l’infection dépasse l’oreille moyenne et évaluer la possibilité d’une intervention chirurgicale ou d’une imagerie pour circonscrire l’étendue de l’infection.
La mastoïdite aiguë est la principale complication de l’OMA. Même si celle-ci s’accompagne généralement d’une inflammation des cellules mastoïdes aériennes (y compris des modifications radiographiques à la tomodensitométrie), les symptômes cliniques, tels que la douleur ou l’œdème au-dessus de l’os mastoïde (derrière l’oreille), évoquent une mastoïdite.
D’autres syndromes moins courants, mais importants sur le plan clinique, s’associent à l’OMA : la paralysie aiguë du nerf facial (septième nerf crânien), qui est également liée à une inflammation de l’os temporal, ou la paralysie du sixième nerf crânien (absence d’abduction ipsilatérale de l’œil) causée par une inflammation ou une infection du rocher (syndrome de Gradenigo). D’autres complications peuvent inclure une labyrinthite lorsque l’infection s’étend dans l’espace cochléaire, la thrombose du sinus veineux transverse, latéral ou sigmoïde et la méningite.
La prise en charge de l’OMA selon des critères acceptés
Tous les enfants dont le tympan est perforé et qui présentent des symptômes d’OMA devraient recevoir des antimicrobiens systémiques rapidement et être examinés afin de déceler toutes complications connexes.
Afin de déterminer quels enfants dont le tympan n’est pas perforé profiteraient le plus du traitement antimicrobien de l’OMA, deux grandes études contrôlées contre placebo auprès d’enfants de plus de six mois ont été réalisées en Europe et en Amérique du Nord. Les critères d’OMA étaient des symptômes aigus de fièvre, d’otalgie ou de problèmes respiratoires couplés à des critères d’évaluation rigoureux et objectifs de l’oreille moyenne (EOM ou niveau hydroaérique et bombement modéré ou marqué du tympan accompagné d’un érythème important, d’une hémorragie ou d’une couleur jaunâtre).[21][22] Selon ces critères, le groupe placebo présentait beaucoup plus d’échecs (35 %) que le groupe traité (19 %), ce qui donne fortement à penser que le traitement antimicrobien était bénéfique chez les enfants diagnostiqués selon des critères rigoureux. Même alors, il fallait traiter environ quatre enfants pour qu’un seul d’entre eux profite de l’antimicrobien. Lorsqu’on comparait les résultats des deux études auprès de nourrissons de six mois à deux ans diagnostiqués au moyen de critères rigoureux, le taux d’échec d’un placebo se situait entre 40 % et 59 %, mais celui des antimicrobiens, seulement entre 14 % et 25 %, ce qui démontre de nouveau les avantages du traitement antimicrobien dans ces situations cliniques.[36]
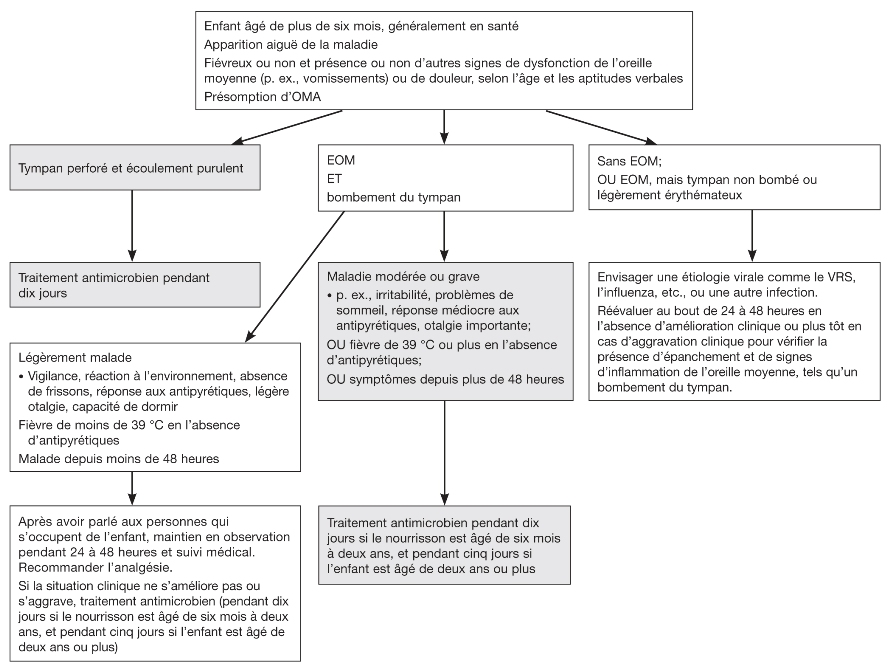
Cependant, la sélection des enfants à traiter en toute sécurité sans antimicrobiens empiriques doit dépendre quelque peu du jugement clinique, mais également de critères objectifs tels que la durée et la gravité de la maladie. Les enfants présentant un bombement léger à modéré du tympan, qui sont légèrement malades et vigilants, répondent aux antipyrétiques et sont atteints d’une faible fièvre (moins de 39 °C) et d’une légère otalgie peuvent être maintenus en toute sécurité en simple observation (ou sous attente vigilante) pendant 24 à 48 heures. Une réévaluation planifiée, l’accès à une réévaluation rapide ou la prescription d’antimicrobiens « au cas où » peuvent être des démarches acceptables, en fonction de la situation clinique ou sociale. Les enfants atteints d’une OMA (définie par un bombement du tympan) qui sont très fiévreux (39 °C ou plus) et qui présentent des signes systémiques modérés ou majeurs, qui souffrent d’otalgie importante ou qui sont très malades depuis 48 heures devraient recevoir des antimicrobiens (figure 1).
Dans toutes les situations, il faut informer les personnes qui s’occupent de l’enfant de rester attentives à la modification ou à l’aggravation des symptômes et leur assurer un accès rapide à des soins médicaux. Si les symptômes s’aggravent ou ne s’améliorent pas dans les 24 à 48 heures, la prescription d’antimicrobiens s’impose. Il faut expliquer le plan de prise en charge aux personnes qui s’occupent de l’enfant, afin de partager la prise de décision. Il est essentiel de leur donner des conseils appropriés au sujet des analgésiques.
La prise en charge en cas d’incertitude diagnostique
Dans les faits, le clinicien affronte souvent un dilemme auprès des enfants chez qui il est impossible de bien évaluer le tympan. Pour bien des raisons (p. ex., un patient moins coopératif, un petit conduit auditif, un observateur inexpérimenté ou de l’équipement inadéquat), les cliniciens ne seront peut-être pas en mesure de déterminer de manière concluante si le tympan est bombé. Dans ces situations courantes, le diagnostic différentiel peut tout de même inclure une maladie virale qui touche les voies respiratoires supérieures associée à une OME, une maladie virale systémique ou une OMA qui pourrait guérir spontanément. Le plan d’action le plus prudent ne consiste donc pas toujours à administrer des antimicrobiens.
Si l’enfant est seulement légèrement malade, qu’il ne semble pas avoir une otalgie importante, qu’il s’alimente encore plutôt bien, qu’il a une température inférieure à 39 °C depuis moins de 24 heures et que les personnes qui s’occupent de lui sont fiables, il demeure toujours raisonnable de le maintenir en observation et de demander à la personne qui s’occupe de lui de le ramener le lendemain pour un suivi. La réévaluation se fonde sur l’évolution du tympan ou l’apparition d’autres signes ou symptômes. Tout comme dans le scénario d’attente vigilante en cas d’OMA confirmée, il faut expliquer le plan de prise en charge aux personnes qui s’occupent de l’enfant afin de pouvoir partager la prise de décision. Cette fois encore, il est essentiel de donner des conseils appropriés au sujet de l’analgésie.
|
Figure 1) Organigramme pour la prise en charge des enfants ayant une otite moyenne aiguë présumée ou confirmée. EOM Épanchement dans l’oreille moyenne; OMA Otite moyenne aiguë; VRS Virus respiratoire syncytial |
L’importance du choix et de la dose d’antimicrobien
Il y a moins de données sur la susceptibilité antimicrobienne des bactéries responsables de l’OMA, mais le taux de susceptibilité à la pénicilline du S pneumoniae, qui est responsable d’une maladie invasive, est supérieur à 90 % dans la plupart des régions sociosanitaires du Canada.[37]-[39] Puisque le S pneumoniae est le principal agent pathogène de l’OMA, et puisque l’amoxicilline administrée de manière empirique soigne également le SGA, celle-ci demeure le médicament de choix. Le M catarrhalis et certaines souches d’H influenzae risquent davantage de résister à l’amoxicilline (de produire des bêtalactamases), mais sont des agents pathogènes beaucoup moins courants, et l’OMA causée par l’une ou l’autre de ces bactéries est plus susceptible d’être spontanément résolutive.
L’amoxicilline pénètre remarquablement dans l’oreille moyenne (et peut donc être efficace malgré une résistance in vitro), est peu coûteuse et bien tolérée et a un spectre antimicrobien relativement étroit. Elle a une courte demi-vie d’environ une heure. Si elle est bien dosée par voie orale, l’amoxicilline est plus susceptible que d’autres antimicrobiens par voie orale d’être efficace contre le S pneumoniae sensible à la pénicilline et contre certains S pneumoniae pénicillinorésistants, l’H influenzae non producteur de bêtalactamase et le SGA. Pour assurer la guérison clinique de l’OMA, l’amoxicilline doit atteindre un taux suffisant dans l’oreille moyenne pendant plus de la moitié de la journée. L’administration de 45 mg/kg/jour à 60 mg/kg/jour d’amoxicilline répartis en trois doses en garantira un taux suffisant dans l’oreille moyenne, tandis que pour se limiter à deux doses par jour, les doses quotidiennes totales doivent atteindre de 75 mg/kg/jour à 90 mg/kg/jour pour maintenir des taux suffisants pendant un pourcentage comparable de la journée (tableau 1).[40]
Dans certaines situations cliniques, il faut envisager d’autres antimicrobiens en première ligne. Lorsque l’OMA s’accompagne d’une conjonctivite purulente (syndrome otite-conjonctivite), l’H influenzae et le M catarrhalis sont des agents pathogènes courants, et par conséquent, il est préférable d’opter pour un traitement combiné d’inhibiteur de bêtalactamase et d’amoxicilline (p. ex., amoxicilline-clavulanate) ou d’une céphalosporine de deuxième génération (p. ex., céfuroxime-axétil).[41] Il faut effectuer des cultures bactériennes de l’écoulement conjonctival purulent lorsque l’infection se résorbe trop lentement. Il peut également être prudent d’utiliser de l’amoxicilline-clavulanate si l’enfant a récemment reçu un traitement à l’amoxicilline (dans les 30 jours précédents) ou si l’infection laisse croire à la récidive d’une infection récente ou à une absence de réponse à l’amoxicilline.
Si l’enfant a des antécédents de réaction d’hypersensibilité à l’amoxicilline ou à la pénicilline, il est acceptable d’utiliser des céphalosporines de deuxième génération (cefprozil ou céfuroxime-axétil) ou une céphalosporine de troisième génération, à moins que la réponse antérieure ait mis en jeu le pronostic vital (c’est-à-dire qu’elle a été associée à un œdème de Quincke, un bronchospasme ou une hypotension).[42] Il est également possible d’utiliser un macrolide-azalide (clarithromycine ou azithromycine) ou de la clindamycine, mais ces antibiotiques ont généralement une activité bactéricide moins élevée que les bêtalactamines (p. ex., pénicillines ou céphalosporines), particulièrement contre le S pneumoniae et l’H influenzae. Il est rare que d’autres médicaments soient indiqués, tels que la doxycycline chez les enfants de huit ans ou plus ou les quinolones; cependant, il faut alors envisager de consulter un infectiologue.
Les symptômes devraient s’atténuer dans les 24 heures et disparaître de deux à trois jours après le début de la prise d’antimicrobiens. Si les symptômes persistent ou s’aggravent, il faut réévaluer le patient pour vérifier la présence de complications ou d’une OMA persistante. Si l’OMA persiste malgré l’administration d’amoxicilline aux doses recommandées et une bonne compliance, l’H influenzae et le M catarrhalis peuvent en être responsables. Dans une telle situation, le traitement doit être remplacé par de l’amoxicilline-clavulanate, et la ceftriaxone par voie intraveineuse ou intramusculaire doit être réservée aux cas où les médicaments par voie orale ne sont pas tolérés ou à ceux où l’amoxicilline-clavulanate n’a pas fonctionné (tableau 1). Dans cette situation peu courante, il faut administrer la ceftriaxone pendant trois jours, car elle a une demi-vie plus longue (environ 12 à 24 heures), et on doit également envisager un prélèvement de liquide dans l’oreille moyenne.
Les EOM peuvent persister pendant des mois, malgré une résolution clinique et bactériologique. Il n’est pas nécessaire de changer d’antimicrobiens en présence d’un EOM.
La durée appropriée du traitement antimicrobien de l’OMA
Il est démontré qu’un traitement antimicrobien de cinq jours à l’amoxicilline par voie orale est tout aussi efficace qu’un traitement de dix jours chez la plupart des enfants de deux ans ou plus qui sont atteints d’une maladie sans complication.[43]-[45] Un cycle de traitement antimicrobien par voie orale de dix jours convient aux nourrissons de moins de deux ans, aux enfants qui souffrent d’une OMA récurrente ou d’une otite moyenne associée à une perforation du tympan et aux situations où le traitement initial a échoué.
Recommandations
- Pour diagnostiquer une OMA, il faut constater l’apparition aiguë de symptômes comme l’otalgie (ou de symptômes non spécifiques chez les enfants qui ne parlent pas encore), des signes d’épanchement dans l’oreille moyenne associé à l’inflammation de l’oreille moyenne (c’est-à-dire un tympan bombé, généralement très érythémateux ou hémorragique, et de couleur jaunâtre ou d’aspect opaque) ou à une perforation du tympan.
- Chez les enfants autrement en santé de six mois ou plus qui sont atteints d’une maladie légère et chez qui les critères diagnostiques d’OMA sont respectés ou chez les enfants qui ne respectent pas pleinement les critères diagnostiques, il est possible d’opter pour une attente vigilante pendant 48 heures si le suivi est assuré. Il faut donner des conseils sur l’analgésie. Il est recommandé de :
- réévaluer l’enfant dans les 24 à 48 heures pour en vérifier l’évolution clinique; OU
- demander à la personne qui s’occupe de l’enfant de revenir avec lui si son état ne s’améliore pas ou s’aggrave dans les 48 heures; OU
- remettre une prescription d’antimicrobiens à remplir si l’état de l’enfant ne s’améliore pas.
- Les enfants dont le tympan est bombé, qui font de la fièvre (39 °C ou plus) et qui présentent des signes systémiques modérés ou majeurs, qui souffrent d’otalgie importante ou qui sont déjà très malades depuis 48 heures devraient recevoir des antimicrobiens.
- Si l’administration d’un antimicrobien est privilégiée, de 75 mg/kg/jour à 90 mg/kg/jour d’amoxicilline divisés en deux doses par jour ou de 45 mg/kg/jour à 60 mg/kg/jour divisés en trois doses par jour sont le traitement de premier choix contre l’OMA.
Il est recommandé d’administrer un cycle d’antimicrobiens aux doses adéquates pendant cinq jours à la plupart des enfants de deux ans ou plus qui sont atteints d’une OMA sans complication, tandis que le traitement de dix jours est réservé aux nourrissons de six à 23 mois et aux cas de perforation du tympan ou d’OMA récurrente.
Remerciements
Le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie a révisé le présent document de principes.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SCP
Membres : Natalie A Bridger MD; Shalini Desai MD; Ruth Grimes MD (représentante du conseil); Charles PS Hui MD (membre sortant); Timothy Mailman MD; Joan L Robinson MD (présidente); Marina Salvadori MD (membre sortante); Otto G Vanderkooi MD
Représentants : Upton D Allen MBBS, Groupe de recherche canadien sur le sida chez les enfants; Tobey Audcent MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Carrie Byington MD, comité des maladies infectieuses, American Academy of Pediatrics; Rhonda Kropp B. Sc. inf. MHP, Agence de la santé publique du Canada; Nicole Le Saux MD, Programme canadien de surveillance de l’immunisation (IMPACT); Dorothy L Moore MD, Comité consultatif national de l’immunisation; Patricia Mousmanis MD, Le Collège des médecins de famille du Canada
Conseillère : Noni E MacDonald MD
Auteures principales : Nicole Le Saux MD, Joan L Robinson MD
Références
- Forgie S, Zhanel G, Robinson J; comité des maladies infectieuses et d’immunisation de la SCP. La prise en charge de l’otite moyenne aiguë. Paediatr Child Health 2009;14(7):461-4.
- Vergison A, Dagan R, Arguedas A et coll. Otitis media and its consequences: Beyond the earache. Lancet Infect Dis 2010;10(3):195-203.
- Coticchia JM, Chen M, Sachdeva L, Mutchnick S. New paradigms in the pathogenesis of otitis media in children. Front Pediatr 2013;1:52.
- Marom T, Nokso-Koivisto J, Chonmaitree T. Viral-bacterial interactions in acute otitis media. Curr Allergy Asthma Rep 2012;12(6):551-8.
- Macintyre EA, Karr CJ, Koehoorn M et coll. Otitis media incidence and risk factors in a population-based birth cohort. Paediatr Child Health 2010;15(7):437-42.
- Moore HC, Jacoby P, Taylor A et coll. The interaction between respiratory viruses and pathogenic bacteria in the upper respiratory tract of asymptomatic Aboriginal and non-Aboriginal children. Pediatr Infect Dis J 2010;29(6):540-5.
- Marchisio P, Nazzari E, Torretta S, Esposito S, Principi N. Medical prevention of recurrent acute otitis media: An updated overview. Expert Rev Anti Infect Ther 2014;12(5):611-20.
- Bakaletz LO. Bacterial biofilms in the upper airway – Evidence for role in pathology and implications for treatment of otitis media. Paediatr Respir Rev 2012;13(3):154-9.
- Verhoeven D, Pichichero ME. Divergent mucosal and systemic responses in children in response to acute otitis media. Clin Exp Immunol 2014;178(1):94-101.
- Palmu AA, Herva E, Savolainen H, Karma P, Mäkelä PH, Kilpi TM. Association of clinical signs and symptoms with bacterial findings in acute otitis media. Clin Infect Dis 2004;38(2):234-42.
- Kalu SU, Ataya RS, McCormick DP, Patel JA, Revai K, Chonmaitree T. Clinical spectrum of acute otitis media complicating upper respiratory tract viral infection. Pediatr Infect Dis J 2011;30(2):95-9.
- Pettigrew MM, Gent JF, Pyles RB, Miller AL, Nokso-Koivisto J, Chonmaitree T. Viral-bacterial interactions and risk of acute otitis media complicating upper respiratory tract infection. J Clin Microbiol 2011;49(11):3750-5.
- Casey JR, Adlowitz DG, Pichichero ME. New patterns in the otopathogens causing acute otitis media six to eight years after introduction of pneumococcal conjugate vaccine. Pediatr Infect Dis J 2010;29(4):304-9.
- Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of 13-valent pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute otitis media. Pediatr Infect Dis J 2012;31(3):297-301.
- Taylor S, Marchisio P, Vergison A, Harriague J, Hausdorff WP, Haggard M. Impact of pneumococcal conjugate vaccination on otitis media: A systematic review. Clin Infect Dis 2012;54(12):1765-73.
- De Wals PD, Carbon M, Sévin E, Deceuninck G, Ouakki M. Reduced physician claims for otitis media after implementation of pneumococcal conjugate vaccine program in the province of Quebec, Canada. Pediatr Infect Dis J 2009;28(9):e271-5.
- Tamir S, Roth Y, Dalal I, Goldfarb A, Grotto I, Marom T. Changing trends of acute otitis media bacteriology in Israel in the pneumococcal conjugate vaccine era. Pediatr Infect Dis J 2014;34:1959.
- Ben-Shimol S, Givon-Lavi N, Leibovitz E, Raiz S, Greenberg D, Dagan R. Near-elimination of otitis media caused by 13-valent pneumococcal conjugate vaccine (PCV) serotypes in southern Israel shortly after sequential introduction of 7-valent/13-valent PCV. Clin Infect Dis 2014;59(12):1724-32.
- Le Saux N, Gaboury I, Baird M et coll. A randomized, double-blind, placebo-controlled noninferiority trial of amoxicillin for clinically diagnosed acute otitis media in children 6 months to 5 years of age. CMAJ 2005;172(3):335-41.
- Dagan R, Schneider S, Givon-Lavi N et coll. Failure to achieve early bacterial eradication increases clinical failure rate in acute otitis media in young children. Pediatr Infect Dis J 2008;27(3):200-6.
- Hoberman A, Paradise JL, Rockette HE et coll. Treatment of acute otitis media in children under 2 years of age. N Engl J Med 2011;364(2):105-15.
- Tähtinen PA, Laine MK, Huovinen P, Jalava J, Ruuskanen O, Ruohola A. A placebo-controlled trial of antimicrobial treatment for acute otitis media. N Engl J Med 2011;364(2):116-26.
- Shaikh N, Hoberman A, Paradise JL et coll. Development and preliminary evaluation of a parent-reported outcome instrument for clinical trials in acute otitis media. Pediatr Infect Dis J 2009;28(1):5-8.
- Laine MK, Tähtinen PA, Ruuskanen O, Huovinen P, Ruohola A. Symptoms or symptom-based scores cannot predict acute otitis media at otitis-prone age. Pediatrics 2010;125(5):e1154-61.
- Onusko E. Tympanometry. Am Fam Physician 2004;70(9):1713-20.
- Takata GS, Chan LS, Morphew T, Mangione-Smith R, Morton SC, Shekelle P. Evidence assessment of the accuracy of methods of diagnosing middle ear effusion in children with otitis media with effusion. Pediatrics 2003;112(6 Pt 1):1379-87.
- Chonmaitree T, Alvarez-Fernandez P, Jennings K et coll. Symptomatic and asymptomatic respiratory viral infections in the first year of life: Association with acute otitis media development. Clin Infect Dis 2015;60(1):1-9.
- McCormick DP, Chonmaitree T, Pittman C et coll. Nonsevere acute otitis media: A clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment. Pediatrics 2005;115(6):1455-65.
- Karma PH, Penttilä MA, Sipilä MM, Kataja MJ. Otoscopic diagnosis of middle ear effusion in acute and non-acute otitis media. I. The value of different otoscopic findings. Int J Pediatr Otorhinolaryngol 1989;17(1):37-49.
- McCormick DP, Lim-Melia E, Saeed K, Baldwin CD, Chonmaitree T. Otitis media: Can clinical findings predict bacterial or viral etiology? Pediatr Infect Dis J 2000;19(3):256-8.
- Friedman NR, McCormick DP, Pittman C et coll. Development of a practical tool for assessing the severity of acute otitis media. Pediatr Infect Dis J 2006;25(2):101-7.
- Shaikh N, Hoberman A, Rockette HE, Kurs-Lasky M. Development of an algorithm for the diagnosis of otitis media. Acad Pediatr 12(3):214-8.
- Leibovitz E, Serebro M, Givon-Lavi N et coll. Epidemiologic and microbiologic characteristics of culture-positive spontaneous otorrhea in children with acute otitis media. Pediatr Infect Dis J 2009;28(5):381-4.
- Shaikh N, Hoberman A, Kaleida PH, Ploof DL, Paradise JL. Videos in clinical medicine. Diagnosing otitis media – Otoscopy and cerumen removal. N Engl J Med 2010:362(20):e62.
- Mattos JL, Colman KL, Casselbrant ML, Chi DH. Intratemporal and intracranial complications of acute otitis media in a pediatric population. Int J Pediatr Otorhinolaryngol 2014;78(12):2161-4.
- Hoberman A, Ruohola A, Shaikh N, Tähtinen PA, Paradise JL. Acute otitis media in children younger than 2 years. JAMA Pediatr 2013;167(12):1171-2.
- Powis J, McGeer A, Green K et coll. In vitro antimicrobial susceptibilities of Streptococcus pneumoniae clinical isolates obtained in Canada in 2002. Antimicrob Agents Chemother 2004;48(9):3305-11.
- Leal J, Vanderkooi OG, Church DL, MacDonald J, Tyrrell GJ, Kellner JD. Eradication of invasive pneumococcal disease due to the seven-valent pneumococcal conjugate vaccine serotypes in Calgary, Alberta. Pediatr Infect Dis J 2012;31(9):e169-75.
- Vanderkooi OG, McConnell A, Church DL, Kellner JD. Antimicrobial susceptibility of invasive and lower respiratory tract isolates of Streptococcus pneumoniae, 1998 to 2007. Can J Infect Dis Med Microbiol 2009;20(4):e139-44.
- Piglansky L, Leibovitz E, Raiz S et coll. Bacteriologic and clinical efficacy of high dose amoxicillin for therapy of acute otitis media in children. Pediatr Infect Dis J 2003;22(5):405-13.
- Block SL, Hedrick J, Tyler R et coll. Increasing bacterial resistance in pediatric acute conjunctivitis (1997-1998). Antimicrob Agents Chemother 2000;44(6):1650-4.
- Lagacé-Wiens P, Rubinstein E. Adverse reactions to ß-lactam antimicrobials. Expert Opin Drug Saf 2012;11(3):381-99.
- Cohen R, Ovetchkine P, Géhanno P. Current approaches to otitis media. Curr Opin Infect Dis 2001;14(3):337-42.
- Pichichero ME, Marsocci SM, Murphy ML, Hoeger W, Francis AB, Green JL. A prospective observational study of 5-, 7-, and 10-day antibiotic treatment for acute otitis media. Otolaryngol Head Neck Surg 2001;124(4):381-7.
- Kozyrskyj A, Klassen TP, Moffatt M, Harvey K. Short-course antibiotics for acute otitis media. Cochrane Database Syst Rev 2010;9:CD001095.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 7 février 2024